Лекции 1-17 (1043960), страница 12
Текст из файла (страница 12)
кинетическое уравнение имеет вид
Разделяя переменные в (8.95) и интегрируя, получаем решение уравнения (8.96)
Отсюда находим выражение для константы скорости
причем размерность константы скорости равна с–1.
При x = 0,5a получим t0,5 = 1/(K2a), т. е. время полураспада зависит и от концентрации исходных веществ.
Следует указать, что под влиянием катализаторов порядок реакции может измениться. Так, диссоциация аммиака идет в газовой фазе по уравнению реакции второго порядка, а при каталитическом действии твердого ванадия реакция идет по уравнению реакции первого порядка, т. е. без влияния концентрации реагента, которая остается как бы постоянной величиной.
Скорость концентрационной диффузии
Процессы переноса вещества путем диффузии связаны с наличием градиента концентраций диффундирующего вещества в среде, заполненной другим веществом. Процессы диффузии описываются уравнениями, выражающими законы Фика:
где m – количество диффундирующего вещества; S – площадь сечения диффузионного потока; t – время; ![]() – градиент концентрации (имеет отрицательное значение потому, что диффузия идет от большей концентрации к меньшей); D – коэффициент пропорциональности, или коэффициент диффузии.
– градиент концентрации (имеет отрицательное значение потому, что диффузия идет от большей концентрации к меньшей); D – коэффициент пропорциональности, или коэффициент диффузии.
Коэффициенты диффузии в газообразных системах вычисляют на основании кинетической теории газов:
где ![]() и
и ![]() – соответственно длина свободного пробега и средняя скорость движения молекул газа. Порядок величины D для газов при стандартных условиях составляет
– соответственно длина свободного пробега и средняя скорость движения молекул газа. Порядок величины D для газов при стандартных условиях составляет ![]() м2/с.
м2/с.
Коэффициенты диффузии в жидкостях могут быть рассчитаны по уравнению Стокса:
где k – постоянная Больцмана; ![]() – коэффициент вязкости среды;
– коэффициент вязкости среды;
r – радиус частицы. Порядок величины D для жидкостей при стандартных условиях составляет ![]() м2/с.
м2/с.
Для твердых кристаллических тел коэффициент диффузии имеет еще меньшие значения, например алюминий, диффундирующий в твердую медь, при температуре 1123 К имеет коэффициент диффузии D = 2,19![]()
![]() м2/с.
м2/с.
Помимо изотермической диффузии, описываемой законами Фика (см. (8.97)), перенос атомов может возникнуть под действием разности температур и напряжений, т. е. в неоднородном температурном поле. Такая изотермическая диффузия, называемая термодиффузией, может вызвать перераспределение или сегрегацию компонентов сплава в температурном поле, созданном сварочным термическим циклом. Это будет особенно заметно для элементов, обладающих высокой подвижностью, например для водорода, который будет диффундировать из основного металла к оси шва, где выше температура и больше растворимость.
Скорость гетерогенных процессов
В гетерогенных системах необходимо учитывать как процессы, протекающие в пределах каждой фазы, так и взаимодействие между фазами. Система может состоять из нескольких фаз, различных по физическому состоянию и химическому составу. Превращения в системе могут быть очень сложными, но во всех случаях они подчиняются общему закону, согласно которому каждый компонент стремится распределиться в системе так, чтобы его химический потенциал в каждой фазе был одинаковым. Наибольшую роль в этом отношении играют явления диффузии и химические взаимодействия.
В практике сварочного производства часто приходится иметь дело с системами, состоящими из четырех фаз, а именно газовой, слоя флюса, расплавленного металла шва и твердого металла. Процесс взаимодействия компонентов газовой фазы с элементами металлической фазы в гетерогенной системе состоит из нескольких звеньев. Одним из них является диффузия активного компонента из объема газовой фазы к поверхности флюса, в результате которой у поверхности флюса в слое толщиной ![]() поддерживается постоянная концентрация активного компонента. В отсутствие перемешивания диффузия в объеме газовой фазы протекает по закону Фика со скоростью
поддерживается постоянная концентрация активного компонента. В отсутствие перемешивания диффузия в объеме газовой фазы протекает по закону Фика со скоростью
где D – коэффициент диффузии, см2/с; S – площадь поперечного сечения диффузионного потока, см2; ∆С – разность концентраций на расстоянии δ; δ – толщина диффузионного слоя.
В турбулентном потоке происходит интенсивное перемешивание газа и выравнивание его состава во всем объеме. Только у поверхности раздела фаз остается слой толщиной δ, не подверженный перемешиванию, через который диффузия протекает по закону Фика. Толщина этого слоя пропорциональна вязкости газа и обратно пропорциональна скорости его движения.
Из внешней среды компонент газовой фазы диффундирует сквозь слой флюса толщиной δ со скоростью
к границе раздела флюс – металл и вступает в реакцию с элементами металлического сплава со скоростью
где k – коэффициент пропорциональности.
При постоянных С0 и δ концентрация С на границе раздела флюс – металл определяет как скорость диффузии (8.100), так и скорость химической реакции (8.101). В установившемся процессе концентрация С определяется из условия: ![]() или
или ![]() откуда
откуда  . В таком случае скорость процесса выражается уравнением
. В таком случае скорость процесса выражается уравнением
или
где ![]() – скорость химического взаимодействия при наибольшей концентрации реагирующего вещества С0;
– скорость химического взаимодействия при наибольшей концентрации реагирующего вещества С0; ![]()
![]() – скорость диффузии при наибольшем градиенте концентрации (С0 – 0)/δ.
– скорость диффузии при наибольшем градиенте концентрации (С0 – 0)/δ.
Из уравнения (8.102) следует, что скорость гетерогенного процесса определяется совокупным влиянием скорости диффузии и скорости химического взаимодействия. Во всех случаях наибольшее влияние на скорость процесса оказывает медленное звено.
Когда D/δ ![]() k, величина δ/(DC0)
k, величина δ/(DC0) ![]() 0 и скорость процесса лимитируется скоростью химического взаимодействия. При условии
0 и скорость процесса лимитируется скоростью химического взаимодействия. При условии
k ![]() D/δ скорость процесса лимитируется диффузией. В последнем случае перемешивание уменьшает диффузионное сопротивление и ускоряет процесс.
D/δ скорость процесса лимитируется диффузией. В последнем случае перемешивание уменьшает диффузионное сопротивление и ускоряет процесс.
Роль диффузионных процессов в гетерогенной системе
Концентрация газа в объеме фазы всегда будет отличаться от концентрации в поверхностном слое, в котором совершается реакция. При низких температурах в результате адсорбции в поверхностном слое концентрация молекул газа может быть значительно выше, чем в объемном слое, но при достаточно высоких температурах вследствие вступления в реакцию концентрация газа в поверхностном слое будет ниже, чем в объемном.
Рассмотрим случай, когда концентрация C, например водорода, в приповерхностном слое шва будет меньше концентрации газа в объеме шва. Градиент концентраций определяет диффузионный поток, направленный к поверхности. Количество газа ![]() перенесенного в результате диффузии, можно найти по первому из уравнений Фика (8.97).
перенесенного в результате диффузии, можно найти по первому из уравнений Фика (8.97).
Для установившегося режима диффузии, т. е. при наличии постоянного градиента концентраций и при постоянной температуре, решение первого уравнения (8.97) имеет вид
где (С0 – С) – разность концентраций в объеме газа и на поверхности; Δх – толщина приповерхностного слоя.
Н
Рис. 8.19. Изменение концентрации углерода в зоне сплавления Ст3 и 08Х18Н11М3 после сварки (кривая I) и
после нагрева до 873 К и выдержки в течение 300 часов
(кривая II)
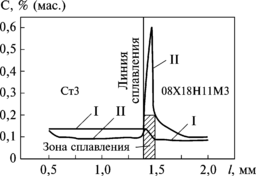
аряду с концентрационной (выравнивающей) диффузией в гетерогенной системе наблюдается и восходящая диффузия. В качестве примера рассмотрим процесс перераспределения углерода в сварном соединении низкоуглеродистой стали Cт3 и высоколегированной стали 08Х18Н11М3 (рис. 8.19). При сварке в результате перемешивания жидкого металла и диффузии происходит практически мгновенное выравнивание концентрации углерода, хрома и других элементов по сечению шва, а при замедленном охлаждении и особенно при длительном послесварочном нагреве развивается восходящая (реактивная) диффузия углерода из Cт3 в зону, содержащую 18 % Cr. Движущей силой этой диффузии является высокое сродство углерода с хромом, что приводит к образованию карбидов Cr23C6, сопровождаемому снижением энергии Гиббса. В результате формируется склонность к межкристаллитной коррозии в стали с 18 % Cr и создается обезуглероженная зона малой прочности в Ст3.
Кинетический и диффузионный режимы
Если масса перенесенного диффузией компонента будет больше, чем может быть израсходовано в химической реакции, то общая скорость процесса будет определяться кинетикой, т. е. скоростью химической реакции (кинетический режим). Если в химической реакции за единицу времени может быть поглощено больше компонента, чем может его поступить путем диффузии, то общая скорость процесса будет определяться скоростью диффузии (диффузионный режим). Лимитирующим будет самое медленное звено.
Режим одного и того же процесса гетерогенной реакции, например окисления металла кислородом, может меняться в зависимости от температуры.


















