Лекции 1-17 (1043960), страница 10
Текст из файла (страница 10)
Смачиваемость твердого тела жидкостью
К апля жидкости на подложке (горизонтальной поверхности твердого тела) приобретает формы, представленные на рис. 8.17. Угол
апля жидкости на подложке (горизонтальной поверхности твердого тела) приобретает формы, представленные на рис. 8.17. Угол ![]() между векторами поверхностных натяжений
между векторами поверхностных натяжений ![]() (на межфазной поверхности раздела жидкость – воздух) и
(на межфазной поверхности раздела жидкость – воздух) и ![]() (на межфазной поверхности раздела жидкость – твердое тело) называют краевым углом. В условиях равновесия сил в точке О сумма проекций сил на горизонтальную ось дает нуль, т. е.
(на межфазной поверхности раздела жидкость – твердое тело) называют краевым углом. В условиях равновесия сил в точке О сумма проекций сил на горизонтальную ось дает нуль, т. е.
где I – поверхностное натяжение на межфазной поверхности воздух – твердое тело. Отсюда получаем уравнение Юнга
Жидкость смачивает подложку, если ![]() < 90 (I > I–II). При
< 90 (I > I–II). При
![]() = 0 (I – I–II = II) смачивание абсолютное. При
= 0 (I – I–II = II) смачивание абсолютное. При ![]() получим, что cos
получим, что cos![]() < 0, а
< 0, а ![]() > 90, т. е. жидкость не смачивает подложку.
> 90, т. е. жидкость не смачивает подложку.
Для повышения смачиваемости следует уменьшать II и увеличивать разность I – I–II. Этого достигают за счет уменьшения I–II с понижением поверхностного натяжения между жидкостью и газом, между жидкостью и поверхностью твердого тела путем применения специальных флюсов, очистки поверхности. Повышение температуры также приводит к снижению сил межфазного натяжения.
При сварке смачиваемость металла жидким флюсом обеспечивает плавные переходы шва к металлу.
Растекание
Способность жидкости распространяться по поверхности твердого тела с образованием в пределе мономолекулярного слоя называется растеканием. Это самопроизвольный процесс, приводящий к равновесию в системе. Тенденция к растеканию существует, если увеличение поверхности покрытия жидкостью подложки сопровождается уменьшением энергии Гиббса системы жидкость – подложка – среда. Для жидкости, лежащей плоским слоем, приращения ее межфазной поверхности ΔII и общей поверхности с подложкой ![]() примерно одинаковы. Поэтому приращение энергии Гиббса принятой системы составит
примерно одинаковы. Поэтому приращение энергии Гиббса принятой системы составит
Выражая приращение энергии Гиббса на единицу поверхности, с учетом соотношения (8.78) можно записать:
Из выражения (8.80) следует, что при значениях краевого угла, обеспечивающих смачивание ![]() < 1, рис. 8.17, б), приращение поверхностного натяжения Δ и приращение энергии Гиббса G положительны. Ситуация не изменится, если
< 1, рис. 8.17, б), приращение поверхностного натяжения Δ и приращение энергии Гиббса G положительны. Ситуация не изменится, если ![]() = 1, т. е. даже при абсолютном смачивании
= 1, т. е. даже при абсолютном смачивании ![]() = 1) жидкость самопроизвольно растекаться не будет. Условие самопроизвольного растекания
= 1) жидкость самопроизвольно растекаться не будет. Условие самопроизвольного растекания ![]() соответствует неравенству
соответствует неравенству ![]() > 1, и тогда зависимость (8.78) и понятие смачиваемости теряют смысл.
> 1, и тогда зависимость (8.78) и понятие смачиваемости теряют смысл.
Работа, совершаемая системой при растекании жидкости на единице поверхности, ![]() называется коэффициентом растекания и обозначается Sр. Коэффициент растекания выражается формулой
называется коэффициентом растекания и обозначается Sр. Коэффициент растекания выражается формулой
Чем больше значение Sp, тем большую скорость растекания жидкости по подложке следует ожидать. Растекаемость жидкостей играет важную роль в процессах пайки и сварки. Большая растекаемость припоев обеспечивает большую производительность пайки и высокое качество паяных соединений. Растекаемость шлака по поверхности жидкого металла увеличивает радиус перехода от шва к зоне термического влияния и является необходимым условием для активной его обработки (легирование, рафинирование). Повышению растекаемости жидкого металла по поверхности твердого тела способствует рост температуры и снижение межфазного натяжения на их поверхности. Высокие смачиваемость и растекаемость керосина используются при контроле сплошности сварных соединений.
Растворение металлов в электролитах
Самопроизвольное растворение поверхности металла в результате взаимодействия с газовой (SO2) или жидкой (H2S) средой, приводящее к уменьшению массы (толщины) металла, называют коррозией. Различают химическую и электрохимическую, равномерную и сосредоточенную коррозию.
Химическая коррозия имеет место при контакте метала с горячими сухими газами или неэлектропроводными жидкостями. Ее результатом является образование оксидной пленки, рост пленки по толщине, отслаивание и дальнейшее окисление. Пленки, образующие плотный сплошной слой, обладают защитными свойствами. Окалиностойкие стали содержат 12 % хрома, а также кремний, алюминий.
Электрохимическая коррозия – это растворение металла в электропроводных средах – электролитах вследствие самопроизвольного перехода системы в состояние с большей энтропией. (Кристаллический порядок переходит в беспорядок раствора.) Электролитами являются вода, содержащая воздух, раствор солей в воде, в том числе морская вода, различные кислоты и щелочи и и
Рис. 8.18. Схема коррозионного взаимодействия электролита с поверхностью ме-талла: переход ионов Fe в электролит на аноде А, сое-динение ионов H+ с элект-
ронами на катоде К
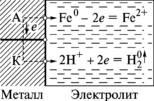 х водные растворы. Схема электрохимической коррозии представлена на рис. 8.18. Она объединяет два параллельных процесса – анодный, т. е. процесс перехода атомов металла в раствор в виде гидратированных ионов, обогащающих металл электронами, и катодный – процесс нейтрализации этих электронов положительно заряженными частицами раствора
х водные растворы. Схема электрохимической коррозии представлена на рис. 8.18. Она объединяет два параллельных процесса – анодный, т. е. процесс перехода атомов металла в раствор в виде гидратированных ионов, обогащающих металл электронами, и катодный – процесс нейтрализации этих электронов положительно заряженными частицами раствора (водорода и т. п.):
Если два различных металла контактируют между собой и электролитом, то возникает гальванический элемент, приводящий к протеканию электрического тока в замкнутой цепи металл – электролит – металл 2 – металл 1.
Разность потенциалов между металлами 1 и 2 измеряют путем наложения внешнего потенциала, при котором ток между металлами 1 и 2 равен нулю. Эта измеренная ![]() разность потенциалов будет максимальной, т. е. электродвижущей силой
разность потенциалов будет максимальной, т. е. электродвижущей силой ![]() гальванического элемента. Она может быть вычислена по формуле
гальванического элемента. Она может быть вычислена по формуле
где n – валентность иона, перешедшего в раствор; F – число Фарадея.
Электродвижущая сила определяет потенциал растворения данного металла в расплаве в сравнении с эталонным, т. е. со стеклянно-натриевым электродом. Например, ![]() магния в расплаве хлоридов равна +0,66 В, а алюминия +1,36 В, т. е. в 2 раза выше.
магния в расплаве хлоридов равна +0,66 В, а алюминия +1,36 В, т. е. в 2 раза выше.
На потенциал растворения влияют температура и активная концентрация ионов в электролите. Кроме того, он зависит от уровня остаточных или внешних упругих напряжений. Они определяют энергию Геймгольца ![]() аккумулированную металлом, которая снижает энергию Гиббса, что усиливает растворение:
аккумулированную металлом, которая снижает энергию Гиббса, что усиливает растворение:
где ![]() – значение энергии Гиббса для напряженного металла;
– значение энергии Гиббса для напряженного металла; ![]() – стандартное значение энергии Гиббса.
– стандартное значение энергии Гиббса.
Если в металле возникли участки с различным уровнем напряжений, то они могут при контакте с электролитом создать замкнутую электрическую цепь, т. е. гальванический элемент, вызывающий в одном участке растворение металла (переход положительных ионов металла в электролите, поляризацию системы), а в других участках – переход положительных ионов из электролита на поверхность металла, т. е. деполяризацию системы:
Сосредоточенное растворение металла возможно, если участок металла, погруженного в электролит, обладает макро- или микронеоднородностью, приводящей к различному электрохимическому потенциалу. Основными причинами сосредоточенного растворения являются включения, (карбиды, интерметаллиды, оксиды), примеси, неодинаковый наклеп, границы зерен и т. п.
Растворение металла усиливается на участках искажения кристаллической решетки, где ослаблены или нарушены связи
поверхностных атомов с металлом. Такими участками являются границы зерен. Растворение резко усиливается, если по границам зерен расположены избыточные фазы или неметаллические включения (сульфиды, карбиды, интерметаллиды). В этом случае
растворение, т. е. коррозия, металла переходит от равномерной, поверхностной к локальной межкристаллической коррозии (МКК) с резким изменением скорости коррозии соответственно от
0,1 мм/год до ![]() мм/год.
мм/год.
В сварных соединениях имеет место резко выраженная локализация коррозии в зоне термического влияния в результате нагрева, роста зерен, сегрегации углерода на границах зерен, а также вследствие выпадения карбидов ![]() и обеднения периферии зерен хромом.
и обеднения периферии зерен хромом.
Главный метод борьбы с МКК – обеспечение однородности структуры стали, содержащей свыше 12 % хрома. Этого достигают путем подавления роста зерен, уменьшения внутренних напряжений, снижения температуры и длительности перегрева, а также термической обработкой после сварки, приводящей к растворению карбидов и развитию выравнивающей диффузии.
Лекция 11
Скорость взаимодействия металлов со средой
Скорость химической реакции в равновесных условиях
Применительно к условиям сварки прогнозирование хода химических реакций для различных температур в условиях термодинамического равновесия необходимо дополнить анализом скоростей этих реакций при конкретных температурах. Быстротечность сварочных операций обеспечивается химическими реакциями между металлом и средой, а также диффузионными процессами, особенно интенсивно развивающимися при высокотемпературном нагреве.
Скорости химических реакций и диффузионных процессов
характеризуются изменением концентрации вещества во времени,
т. е. изменением числа частиц в единице объема за единицу времени. Скорость химической реакции определяется числом появившихся новых или исчезнувших старых молекул в единице объема за единицу времени.
















