Электрохимические методы исследования
Лекция №2
Электрохимические методы исследования
1 Общие сведения об электрохимических методах исследования
2 Кондуктометрия
3 Потенциометрия
4 Характеристика измерительных устройств, используемых в потенциометрических исследованиях. Применение потенциометрии
1 Общие сведения об электрохимических методах исследования
Электрохимические методы исследования основаны на использовании процессов, происходящих в электролитической ячейке (гальваническом элементе), которая состоит из системы электродов и электролитов, контактирующих между собой.
В состав электролитической ячейки входят два или три электрода, один из которых – индикаторный или рабочий, второй – электрод сравнения и третий – вспомогательный. Электрод, действующий как датчик и реагирующий на фактор возбуждения, но не изменяющий состава раствора за время измерения, является индикаторным. Если под действием тока, протекающего через ячейку, значительно изменяется состав раствора, то электрод – рабочий. Электрод сравнения служит для создания измерительной цепи и поддержания постоянного значения потенциала индикаторного (рабочего) электрода.
Рекомендуемые материалы
Электрохимические методы анализа используют либо для прямых измерений, основанных на зависимости «аналитический сигнал – состав исследуемой среды», либо для индикации конечной точки титрования в титриметрии. Электрохимические методы анализа позволяют определять концентрацию вещества в широком интервале (1 – 10-9 моль/дм3) с достаточной точностью и воспроизводимостью.
Электрохимические методы анализа объединяют методы без протекания электродной реакции (на границе раздела – мембране электрода), в которых строение двойного электрического слоя в расчет не принимается (кондуктометрия), и методы, основанные на электродных реакциях в отсутствие тока (потенциометрия).
2 Кондуктометрия
Кондуктометрический метод основан на определении электрической проводимости веществ в растворах электролитов. Наиболее широко используют удельную (См/м) электропроводность раствора.
Электропроводность раствора электролита – результат диссоциации растворенного вещества и миграции ионов под действием внешнего источника напряжения. По величине электропроводности можно судить о концентрации растворенного вещества (электролита), так как по мере возрастания концентрации электролита в растворе увеличивается количество ионов-переносчиков заряда, что приводит к росту удельной электропроводности раствора.
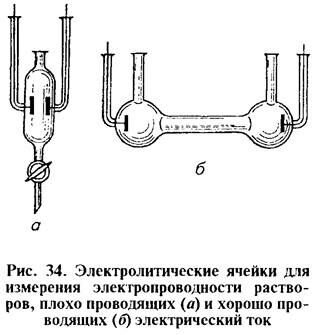
Электропроводность раствора измеряют в электролитической ячейке, представляющей собой стеклянный сосуд с вмонтированными электродами.
Как правило, электроды, изготовленные из листовой платины (электропроводящий материал, устойчивый к Ox/Red реакциям), жестко закреплены, так что расстояние между ними не изменяется. Расстояние между электродами и площадь их поверхности выбирают в зависимости от сопротивления раствора: чем выше измеряемое сопротивление, тем больше должна быть площадь электродов и меньше расстояние между ними (рисунок 1 «34»).
|
|
Применение кондуктометрии.
Большое распространение в аналитической практике получил метод кондуктометрического титрования.
3 Потенциометрия
Потенциометрический метод основан на измерении разности потенциалов электродов (ЭДС), погруженных в исследуемый раствор (внешнее напряжение к электродам при этом не подводится).
В потенциометрии обычно применяют гальванический элемент, включающий два электрода: индикаторный (потенциал которого зависит от активности (концентрации) определяемых ионов в растворе) и сравнения (потенциал которого не зависит от концентрации определяемых ионов).
Типы и свойства индикаторных электродов
При проведении потенциометрических исследований используют два основных типа индикаторных электродов: электронно- и ионообменные (ионоселективные).
Электроннообменные электроды, на межфазных границах которых протекают реакции с участием электронов, изготавливают из инертных металлов (платины, золота). Электроды указанного типа содержат чувствительный элемент – мембрану, разделяющую внутренние раствор и электрод и одновременно служащую средством электролитического контакта с внешним (исследуемым) раствором. Через мембрану могут перемещаться только электроны.
Ионообменные (ионоселективные) электроды, на межфазных границах которых протекают ионообменные реакции. При этом через чувствительный элемент электрода мембрану могут перемещаться ионы только определенного типа в направлении к раствору с меньшей активностью (концентрацией) подвижного иона.
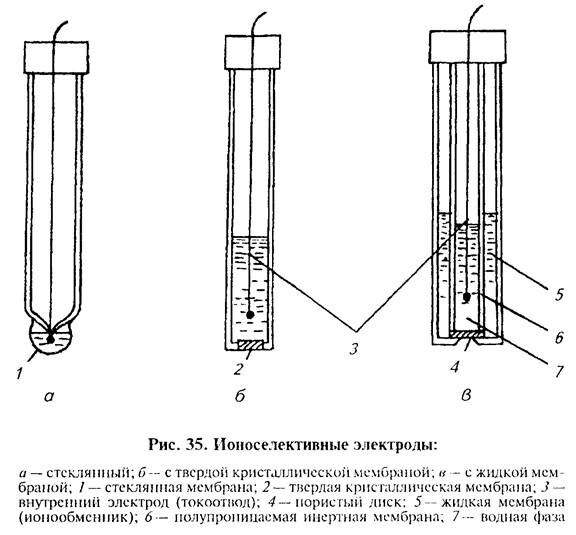
В зависимости от типа мембраны электроды бывают стеклянные, с твердой, жидкой, пленочной и другими мембранами (рисунок 3 «35»).
Стеклянный электрод представляет собой сосуд из изолирующего стекла с напаенным полым шариком-мембраной из специального электродного стекла. В качестве внутреннего стандартного раствора в стеклянном электроде используют 0,1 М раствор соляной кислоты обычно с добавкой хлорида натрия или калия. Внутренним электродом (токоотводом) служит хлорсеребряный электрод, представляющий собой серебряную проволоку, покрытую хлоридом серебра.
Стеклянные электроды широко применяют, как правило, для измерения активности водородных ионов (рН). Выпускают также стеклянные электроды для измерения активности ионов щелочных металлов (натрия, калия).
Типы и свойства электродов сравнения
При измерении ЭДС гальванических элементов необходим полуэлемент, потенциал которого был бы известен, постоянен и не зависел бы от состава исследуемого раствора. Электрод, удовлетворяющий этим требованиям, называют электродом сравнения. Наиболее распространен хлорсеребряный электрод сравнения (Ag, AgCl|KCl), который изготавливают путем нанесения хлорида серебра на серебряную проволоку. Электрод погружают в насыщенный раствор хлорида калия, который связан солевым мостиком с исследуемым раствором.
4 Характеристика измерительных устройств, используемых в потенциометрических исследованиях. Применение потенциометрии
Устройства, применяемые для измерения потенциала – потенциометры (рН-метр, иономер), состоят из двух блоков: измерительного (высокоомный преобразователь) и датчика (электродная система).
Электродная система может быть выполнена конструктивно в виде двух отдельных электродов (индикаторного и электрода сравнения) или в виде комбинированного электрода, где оба электрода объединены в одном корпусе.
Информация в лекции "Разрыв мышц" поможет Вам.
рН-метр является более простым прибором и предназначен для измерения активности протонов водорода (рН), а также окислительно-восстановительного потенциала исследуемой среды.
Иономер предназначен для измерения активности одновалентных и двухвалентных анионов и катионов (рХ), в том числе ионов водорода, окислительно-восстановительного потенциала в водных растворах.
Работа приборов основана на преобразовании ЭДС электродной системы в пропорциональное по величине напряжение, преобразуемое в дальнейшем в аналоговый сигнал или цифровой код, который обрабатывается микропроцессором. Результаты обработки выводятся на дисплей, расположенный на передней панели прибора. На задней панели находятся разъемы для подключения измерительного электрода и электрода сравнения, компьютера или других исполнительных устройств.
Применение потенциометрии
Потенциометрия широко применяется для непосредственного определения активности ионов, находящихся в растворе (ионометрия), окислительно-восстановительного потенциала раствора, а также для индикации точки эквивалентности при титровании по изменению потенциала индикаторного электрода в ходе титрования (потенциометрическое титрование).
Главное достоинство потенциометрического метода – быстрота и простота проведения измерений. Потенциометрическим методом исследуют мутные и окрашенные растворы, вязкие пасты, при этом исключаются операции фильтрации и перегонки.