Твердые растворы с неограниченной и ограниченной взаимной растворимостью компонентов
Лекция 26
Твердые растворы с неограниченной и ограниченной взаимной растворимостью компонентов.
Твердые растворы (смешанные кристаллы) - однородные системы переменного состава (как и жидкие растворы), т.е. твердая фаза не представляет собой кристаллов чистого компонента или химического соединения, а состоит из двух или более компонентов, одновременно участвующих в образовании кристаллов и равномерно распределяющихся в нем.
Твердые растворы бывают двух типов :
1. Твердые растворы внедрения - атомы (молекулы) растворяемого компонента размещаются в пустых местах решетки растворителя между ее узлами. Эти растворы могут образоваться лишь при условии, что размеры частиц растворяющегося вещества невелики. По мере накопления внедряемого вещества устойчивость решетки растворителя уменьшается, и, следовательно, имеет место ограниченная растворимость. Пример - раствор углерода в железе.
2. Твердые растворы замещения - атомы (ионы) растворяемого вещества располагаются в узлах кристаллической решетки вместо атомов растворителя. Важно, чтобы кристаллические структуры замещающего и замещаемого компонента были достаточно близки и чтобы радиусы атомов (ионов) различались не очень сильно. При этих условиях устойчивыми могут оказаться твердые растворы любого состава и имеет место неограниченная растворимость компонентов бинарной смеси; можно получить непрерывный ряд твердых растворов от 0 до 100% каждого компонента. Пример : системы AgCl-NaCl, Au-Ag, Au-Pd, Ag-Pd, Cu-Pd, Cu-Ni, Cu-Au.
В некоторых кристаллических системах в зависимости от условий (от Т) наблюдается как неограниченная, так и ограниченная растворимость компонентов. При этом однородный твердый раствор превращается в смесь мелких кристаллов двух типов. Этот переход называется разрывом сплошности; он соответствует расслоению жидких растворов.
Твердые растворы, компоненты которых взаимно неограниченно растворимы (изоморфные твердые смеси).
Диаграмма состояния изоморфных твердых смесей аналогична диаграмме жидкость -пар для полностью смешивающихся жидкостей. Изоморфные смеси образуют геометрически и химически подобные вещества, т.е. такие, частицы которых близки по объемам и характеру связи. Поэтому оба вещества при любом соотношении между ними, кристаллизуясь, образуют твердый раствор.
Рекомендуемые материалы-50% Электромагнитная индукция + Электромагнитные волны -50% Статически определимые балки -50% Расчет передачи -51% Колебания линейной системы с одной степенью свободы Защита модуля -66% Теория
| Линия acf - линия ликвидуса ; линия bdg - линия солидуса. Когда фигуративная точка системы лежит на линиях ликвидуса или солидуса, система состоит из одной фазы. Между линией ликвидуса и линией солидуса лежит область значений состава и температур, при которых каждой фигуративной точке всей системы (например, точке е), отвечают две точки (с и d), описывающие составы двух равновесных фаз, на которые распадается система. |
Соотношение между количествами этих фаз находится по правилу рычага.
При охлаждении системы, отвечающей фигуративной т.1, состав расплава не меняется до температуры t1. Дальнейшее понижение Т обусловливает выделение твердого раствора, более богатого веществом В, чем исходный расплав; жидкая фаза при этом обогащается веществом А (более легкоплавким компонентом); Т ее отвердевания понижается. Состав расплава в процессе кристаллизации изменяется по кривой acf , а состав кристаллической фазы - по кривой bdg . По мере понижения Т (начиная с t1) охлаждение замедляется, процентное содержание кристаллической фазы растет. Так, при t2 в системе будет  ×100% твердого раствора. При t3 исчезают следы расплава (состава f) с образованием кристаллика состава g ; система становится однофазной. После этого происходит охлаждение твердого раствора.
×100% твердого раствора. При t3 исчезают следы расплава (состава f) с образованием кристаллика состава g ; система становится однофазной. После этого происходит охлаждение твердого раствора.
Т.о., при выделении твердых растворов из жидкой фазы составы жидкости и кристаллов не совпадают (подобно тому, как не совпадают составы жидкого раствора и равновесного с ним пара); кристаллизация (и обратный процесс - плавление) происходят в некотором интервале Т (t1 - t3 в приведенном примере).
Система термодинамически устойчива в течение всей кристаллизации, если процесс охлаждения вести очень медленно. При этом ранее образовавшиеся кристаллы успевают за счет протекающей внутри их объема диффузии изменять свой состав так, чтобы сохранялось их равновесие с расплавом, состав которого постепенно меняется при охлаждении. При высоких Т это достижимо. При низких Т диффузия в твердой фазе замедленна, и уже невозможно достичь выравнивания состава кристаллической фазы. Подобная неоднородная система термодинамически неустойчива.
Твердые растворы, подобно жидким, могут давать смеси, аналогичные азеотропным (система Mn-Cu; с минимумом). В твердых растворах также возможны переходы от ограниченной растворимости к неограниченной при соответствующих критических Т.
Твердые растворы, компоненты которых взаимно ограниченно растворимы.
Если Вам понравилась эта лекция, то понравится и эта - 5 Сервисы Интернет.
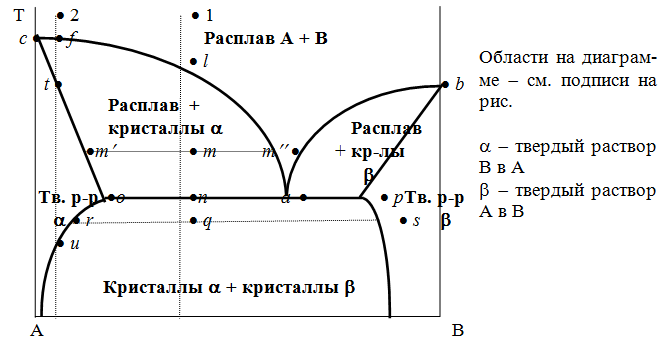
Рассмотрим равновесные состояния, через которые проходят при охлаждении два различных расплава.
Расплав 1. Т понижается, фигуративная т. опускается; т. l отвечает предельному охлаждению, при котором система еще однофазна. При дальнейшем охлаждении выделяется твердый раствор, состав которого меняется по линии солидуса со ; состав равновесного с ним жидкого раствора меняется по линии ликвидуса са . Т.о., например, фигуративной точке всей системы m отвечают точки m¢¢ и m¢ равновесных жидкого и твердого растворов.
По достижении Т, которой отвечает т. n , система состоит из жидкого раствора а и твердого раствора о . Жидкий раствор а может находиться в равновесии одновременно с двумя твердыми растворами о и р ; он называется жидкой эвтектической смесью. При дальнейшем отнятии теплоты из эвтектической смеси выделяются два твердых раствора о и р . Во время кристаллизации эвтектики имеются три фазы : расплав а , кристаллы р и кристаллы о . После окончания кристаллизации остаются две кристаллические фазы, каждая из которых представляет твердый раствор.
При дальнейшем охлаждении смеси твердых растворов состав этих растворов изменяется; так, точке q отвечает смесь твердых растворов r и s .
Расплав 2. Система однофазна до т. f включительно. При дальнейшем охлаждении образуются две фазы, подобно предыдущему случаю. При Т точки t весь расплав затвердевает, и снова имеется одна равновесная фаза. Теперь это - твердый раствор того же состава, что и исходный жидкий раствор. Твердый раствор при дальнейшем охлаждении не изменяется, пока не будет достигнута Т его предельного охлаждения - т. и . При более низких Т происходит разрыв сплошности твердой фазы, и система А-В снова оказывается двухфазной, т.е. представляет собой тонкую смесь кристаллов твердых растворов двух типов - А в В и В в А.






















