Двухкомпонентные системы с простой эвтектикой. Термический анализ
Лекция 25
Двухкомпонентные системы с простой эвтектикой. Термический анализ.
В уравнениях состояния двухкомпонентных систем число переменных равно 4 : Т, Р, С1, С2. Т.о., для построения полной диаграммы состояния необходимо располагать системой координат четырех измерений. Подобное построение невозможно, и это вынуждает прибегать к некоторым упрощениям. С этой целью вместо переменных Т, Р, С1, С2 переходим к переменным Т, Р, мольному объему и мольной доле 1-го компонента N1 (мольная доля 2-го компонента N2 = 1 - N1); вместо мольных долей можно выражать содержание компонентов в весовых %.
Значение мольного объема обычно представляет меньший интерес, поэтому выбираем в качестве независимых переменных Т, Р, N1 и строим трехмерную диаграмму в этих координатах. Все пространство объемной диаграммы разделено поверхностями раздела на области существования определенных фаз.
В практической работе пользуются еще более упрощенными диаграммами - сечениями объемной диаграммы плоскостями, отвечающими P = const или T = const. Такие диаграммы удобны, компактны и вполне удовлетворяют многим потребностям теории и практики.
ДИАГРАММА СОСТОЯНИЯ СИСТЕМЫ С ПРОСТОЙ ЭВТЕКТИКОЙ.
(Неизоморфная смесь, компоненты которой не образуют химического соединения и совершенно нерастворимы в твердом состоянии)
Рекомендуемые материалы
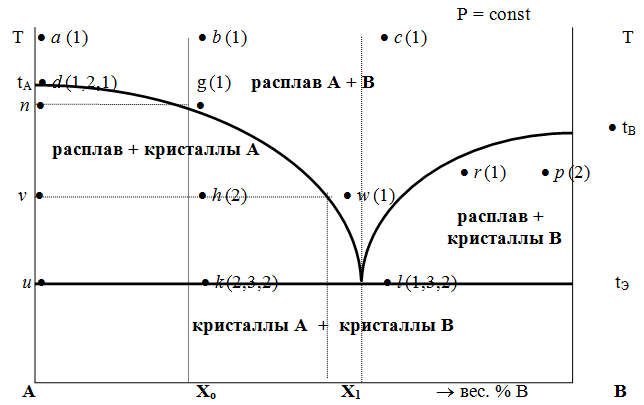
Это простейший случай диаграмм двухкомпонентных смесей. При кристаллизации двухкомпонентного расплава выделяются только чистые кристаллы каждого из компонентов (пример - система Cd-Bi).
Проследим за процессом кристаллизации этой системы при Р = const на примере расплавов различного состава.
Точка а : одна фаза - жидкий компонент А. Число фаз не меняется, пока не будет достигнута температура кристаллизации tA (точка d). В момент достижения этой температуры налицо одна жидкая фаза; при дальнейшем отнятии теплоты появится вторая фаза - кристаллы А. Весь процесс кристаллизации чистого вещества протекает при tA = const, фигуративная точка системы не смещается. Пока идет превращение, С = 1 - 2 + 1 = 0. По окончании кристаллизации фигуративной точке снова отвечает одна, но уже твердая фаза. Т.о., число фаз в точке d меняется так : 1 - 2 - 1 (на рис. количество фаз в каждой точке отмечено цифрами в скобках). Дальнейшее отнятие теплоты вызывает понижение температуры кристаллов, и фигуративная точка опускается.
При охлаждении бинарного расплава, отвечающего фигуративной точке b, кристаллизация протекает иначе. При охлаждении расплава фигуративная точка доходит до положения g , в котором расплав оказывается предельно насыщенным относительно А и представляет собой только одну фазу. При дальнейшем отнятии теплоты начинается кристаллизация вещества А. Но выделение кристаллов А изменяет состав остающегося расплава в сторону обогащения его веществом В, и кристаллы А оказываются в равновесии с жидкой фазой уже иного состава, чем в точке g. По мере выделения вещества А его содержание в расплаве постепенно уменьшается, а следовательно, температура, необходимая для дальнейшей кристаллизации, непрерывно понижается.
В продолжение всей кристаллизации фигуративной точке всей системы отвечают две фигуративные точки твердой и жидкой фаз, например точке h отвечают точки v и w. Фигуративная точка твердой фазы опускается по вертикали, начиная от точки n, и доходит до точки u. Фигуративная точка расплава перемещается по кривой gl.
Выделение кристаллов А продолжается до тех пор, пока фигуративная точка жидкой фазы не совпадет с точкой l. Расплав этого состава находится в равновесии как с кристаллами А, так и с кристаллами В, а потому при отнятии теплоты из жидкой фазы одновременно выделяются кристаллы обоих компонентов; состав расплава остается при этом постоянным. Расплавы, которые могут быть в равновесии с кристаллами обоих компонентов, называются жидкой эвтектической смесью или просто жидкой эвтектикой, а температура ее кристаллизации - эвтектической точкой. Жидкая эвтектика в процессе кристаллизации переходит в твердую эвтектику. Вследствие постоянства состава жидкой фазы кристаллизация эвтектической смеси протекает при постоянной Т, подобно кристаллизации индивидуального вещества.
Когда фигуративная точка всей системы достигает положения k, система состоит из двух фаз - кристаллов А и жидкой эвтектики. В процессе кристаллизации жидкой эвтектики система состоит из трех фаз : расплава, кристаллов А (как выделившихся раньше, так и образующихся при кристаллизации эвтектики) и кристаллов В, выделяющихся из жидкой эвтектики. По окончании кристаллизации система состоит из двух кристаллических фаз, которые и сохраняются при дальнейшем охлаждении.
Если в исходном расплаве имеется избыток вещества В, то в процессе охлаждения в первую очередь происходит выделение кристаллов В (кривая tBl - начало кристаллизации), и расплав постепенно обогащается веществом А. Порядок изменения числа фаз при этом тот же, что и в описанном выше примере кристаллизации вещества А.
При охлаждении расплава, состав которого в точности отвечает составу эвтектики (фигуративная точка с), кристаллизация начинается в точке l без предварительного выделения одного из компонентов. При Т, отвечающей этой точке (tЭ), система проходит последовательно три состояния : одна фаза - расплав, три фазы - расплав и два вида кристаллов, две фазы - два вида кристаллов (твердая эвтектика).
При Т более низких, чем tЭ, система состоит из двух кристаллических фаз.
Фигуративные точки, выражающие составы двух равновесных фаз, называются сопряженными точками, например точки v и w, а кривые, образованные рядами этих точек, - сопряженными кривыми, например линии dl и du. Линии, соединяющие сопряженные точки, называются нодами или коннодами (например, линия vw).
Согласно правилу рычага, фигуративная точка всей системы (например, точка h) делит проходящую через нее ноду (ноду vw) на отрезки, обратно пропорциональные массам фаз, на которые распадается равновесная система :
 =
= 
Правило рычага широко используется для вычисления масс отдельных фаз.
Определим число степеней свободы в разных точках :
т. b (c) С = 2 - 1 + 1 = 2 - т.е. система остается однофазной при произвольном одновременном изменении Т и содержания одного из компонентов.
т. g (r) С = 2 - 1 + 1 = 2 - аналогично т. b (c) ; разница в том, что температуру и %-ное содержание одного из компонентов можно изменять только в одну сторону, т.к. эти точки - пограничные.
т. h (p) С = 2 - 2 + 1 = 1 - т.е. для сохранения двух фаз допустимо изменять произвольно либо только Т, либо только %-ное содержание одного из компонентов расплава, т.к. каждой Т отвечает строго определенный состав раствора, равновесного с кристаллами.
т. l (k) С = 2 - 3 + 1 = 0 ; аналогично - для любой точки, лежащей на линии эвтектики.
Три - максимальное число фаз; возможно различное сочетание равновесных фаз : расплав + одна кристаллическая фаза, расплав + две кристаллические фазы, две кристаллические фазы. В точке эвтектики возможна и одна фаза.
Если взяты расплавы, отличающиеся по составу, то кристаллизация начнется при различных Т, однако закончится она независимо от состава исходной смеси при одной и той же Т : последняя капля жидкости будет отвердевать при tЭ. Если же нагревать твердые смеси различных составов, то конец плавления будет наблюдаться при различных Т, однако плавление начнется при tЭ, причем жидкая фаза будет иметь состав эвтектики. Т.о., понятия Т плавления и Т кристаллизации будут синонимами только для чистых компонентов и эвтектической смеси.
ТЕРМИЧЕСКИЙ АНАЛИЗ.
Диаграммы состояния строятся на основании опытных данных. Наиболее общим способом определения Т равновесия между твердыми и жидкими фазами является метод термического анализа.
Люди также интересуются этой лекцией: Демократия как политический режим.
Существуют две основные методики термического анализа :
1. Визуальный метод. Производится медленное охлаждение прозрачного раствора известной концентрации и отмечается Т, при которой появляются заметные на глаз кристаллы. Затем система медленно нагревается, и отмечается Т исчезновения кристаллов. При тщательной работе температуры расходятся менее чем на 0,1о. По данным строят кривую зависимости Т начала кристаллизации от состава раствора. Метод имеет ряд существенных недостатков (применим лишь к прозрачным растворам; можно построить лишь линию ликвидуса и др.).
2. Метод кривых охлаждения (кривых время - Т) основан на изучении изменений температуры охлаждаемой (нагреваемой) смеси. Является наиболее ценным методом термического анализа, т.к. применим к любым системам и любым Т. В методе кривых охлаждения используется тот факт, что пока в охлаждаемой системе не происходит никаких превращений, Т падает практически с постоянной скоростью. Появление кристаллов в расплаве или переход одной кристаллической модификации в др. сопровождается выделением теплоты, и падение Т замедляется или временно прекращается. Т.о., всякий излом на кривой охлаждения указывает на начало некоторого превращения.
На основании кривых охлаждения ряда растворов различного состава строится диаграмма состояния, являющаяся совокупностью линий (поверхностей), изображающих в координатах Т - Р - состав области и границы существования различных фаз.
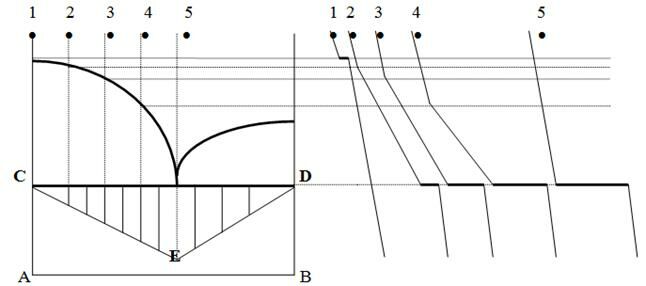
Кристаллизация расплавленного чистого вещества сопровождается температурной остановкой; ее длительность (т.е. размер горизонтального участка на кривой охлаждения) зависит от количества вещества и скорости отвода теплоты. При исчезновении последней капли жидкости Т вновь начнет падать. Температурной остановкой сопровождается и кристаллизация расплава эвтектического состава. Если условия охлаждения всех расплавов одинаковы, то для определения состава эвтектики можно воспользоваться тем, что длительность температурной остановки на кривых охлаждения пропорциональна количеству эвтектики. На оси абсцисс откладывается состав, на оси ординат - длины горизонтальных отрезков кривых охлаждения при tЭ. Соединив их концы, получим прямые линии, пересечение которых дает состав эвтектики. Треугольник СDЕ называется треугольником Таммана.