Однокомпонентные системы. Диаграммы состояния воды, серы, фосфора. Монотропия и энантиотропия
Лекция 24
Однокомпонентные системы. Диаграммы состояния воды, серы, фосфора. Монотропия и энантиотропия.
В однокомпонентных системах отдельные фазы представляют собой одно и то же вещество в различных агрегатных состояниях, а если вещество может давать различные кристаллические модификации, то каждая модификация является особой фазой. Вода, например, образует 6 модификаций льда, сера - ромбическую и моноклиническую и т.д. Каждая модификация устойчива в определенных интервалах Т и Р.
Правило фаз : С = 1 - Ф + 2 = 3 - Ф, т.е. Ф может быть равно 1, 2, 3. Т.о., ни одно индивидуальное вещество не может образовать равновесную систему, состоящую более чем из трех фаз; этот вывод полностью подтверждается опытом.
В общем случае нам неизвестен вид уравнений состояния различных фаз как многокомпонентных, так и однокомпонентных систем. Поэтому единственной возможностью найти зависимость между значениями переменных, определяющих состояние системы, остается метод непосредственных измерений Т, Р и концентраций (или объемов) компонентов равновесных систем. Полученные данные используются для построения диаграмм состояния, которые представляют собой графическое выражение искомых закономерностей.
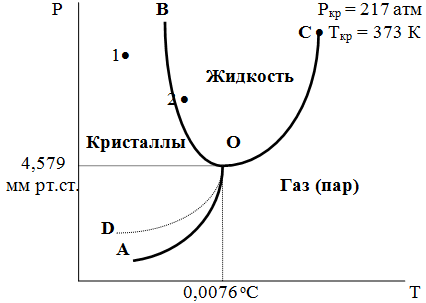
ПЛОСКАЯ ДИАГРАММА СОСТОЯНИЯ ВОДЫ.
В уравнение состояния входят 3 переменные : Т, Р, с (концентрация) или Т, Р, V (мольный объем). Любые две из них можно рассматривать как независимые переменные, а третью - как их функцию. В большинстве случаев Т и Р принимают в качестве независимых переменных.
|
| Рекомендуемые материалы-50% Электромагнитная индукция + Электромагнитные волны -50% Статически определимые балки -50% Расчет передачи Защита модуля -66% Теория -66% Динамические реакции подшипников Каждая точка на плоскости выражает условия (представляет сочетание Т и Р), при которых находится система, и называется фигуративной точкой . Вся плоская диаграмма разбита на несколько областей, каждая из которых охватывает все возможные сочетания Т и Р, отвечающие равновесному существованию определенной фазы (области твердой, жидкой и газообразной фаз). |
Пограничные линии ОА, ОВ, ОС принадлежат обеим соприкасающимся областям, и каждая точка на этих линиях может отвечать как совместному существованию обеих фаз, так и наличию только одной из фаз. Если переход еще не начинался или уже завершен, то система представляет собой только одну фазу.
Линия ОА отвечает равновесному сосуществованию твердой и газообразной фаз (кривая возгонки), линия ОВ - твердой и жидкой фаз (кривая плавления), линия ОС - жидкой и газообразной фаз (кривая кипения или испарения; заканчивается критической точкой). Линия OD показывает, как меняется давление пара над переохлажденной водой.
Переход охлаждаемой жидкости в кристаллическое состояние не всегда начинается точно при Т замерзания. Если жидкость не содержит хотя бы мельчайших твердых частиц, которые могут служить центрами кристаллизации, то имеет место переохлаждение, и выделение кристаллов начинается при более низкой Т. Процесс кристаллизации сопровождается выделением теплоты, вследствие чего Т системы вновь повышается и достигает равновесной Т замерзания, при которой и протекает весь остальной процесс кристаллизации.
Давление пара над переохлажденной жидкостью больше давления пара над кристаллами (кривая OD лежит выше кривой ОА). Þ Переохлажденная жидкость термодинамически неустойчива по отношению к кристаллической фазе, находящейся при той же Т.
Точка О - тройная точка ; в этой точке сходятся все три пограничные линии и возможно равновесное сосуществование как одновременно всех трех фаз, так и сосуществование любых двух фаз и наличие только одной из фаз.
Определим число степеней свободы в различных точках :
Т. 1 : однофазная однокомпонентная система : С1 = 1 - 1 + 2 = 2. Система бивариантна. При наличии одной фазы можно произвольно (в известных пределах, не переходя границ соответствующей области) менять Р и Т, не изменяя числа фаз. Фигуративную точку 1 можно смещать на некоторое расстояние в любом направлении.
Т. 2 : двухфазная однокомпонентная система моновариантна : С2 = 1 - 2 + 2 = 1. Þ если мы захотим изменить условия существования системы, сохраняя равновесие между двумя фазами (льдом и жидкой водой), то мы можем произвольно изменить лишь один параметр состояния, например, Т. Давление же при этом следует изменить на вполне определенную величину так, чтобы фигуративная точка системы (т.2) смещалась строго по кривой ОВ.
Т. О : тройная точка (система трехфазна и нонвариантна) : СО = 1 - 3 + 2 = 0. Равновесное сосуществование трех фаз возможно лишь при единственном сочетании значений Р и Т; любое изменение Р или Т выводит фигуративную точку всей системы из положения О, и она попадает в области, где возможно равновесное существование лишь двух фаз или где система однофазна.
Наклон кривых ОА, ОВ, ОС на плоской диаграмме состояния определяется знаком и величиной производной dP/dT, выражаемой уравнением Клапейрона-Клаузиуса. Знак этой производной определяется (т.к. теплоты процессов плавления, кипения и возгонки положительны) знаком разности мольных объемов фаз (V2 - V1). Кривая возгонки и кривая кипения всегда наклонены вправо; обычно процессы плавления также сопровождаются увеличением мольного объема, и кривая ОВ почти у всех веществ наклонена также вправо. Отличие диаграммы состояния воды от других диаграмм однокомпонентных систем : в случае воды (а также висмута, чугуна и галлия) мольный объем жидкой фазы меньше мольного объема твердой фазы, и кривая плавления наклонена влево.
Наклон кривой плавления воды влево наблюдается лишь при сравнительно низких Р. При Р около 2200 атм вода начинает кристаллизоваться с образованием иной модификации льда, плотность которой больше плотности жидкой воды. В этом случае кривая плавления уже наклонена вправо. Всего вода может давать 6 модификаций льда.
Отметим, что вблизи тройной точки кривая возгонки всегда обладает более крутым подъемом, чем кривая кипения, т.к. теплота возгонки больше теплоты кипения.
Т.о., плоская диаграмма состояния однокомпонентной системы позволяет определить возможное число и характер фаз при выбранных условиях, но она никак не отражает V системы и изменения V при переходе от одной фазы к др., а эти изменения могут быть очень значительными, особенно при переходе жидкости (кристаллов) в пар.
Чтобы изобразить графически соотношения между Т, Р, V, надо использовать систему координат из трех осей. Так строятся объемные диаграммы , позволяющие проследить за изменением всех переменных, входящих в уравнение состояния; они называются полными диаграммами состояния.
ДИАГРАММА СОСТОЯНИЯ СЕРЫ. Энантиотропия и монотропия.
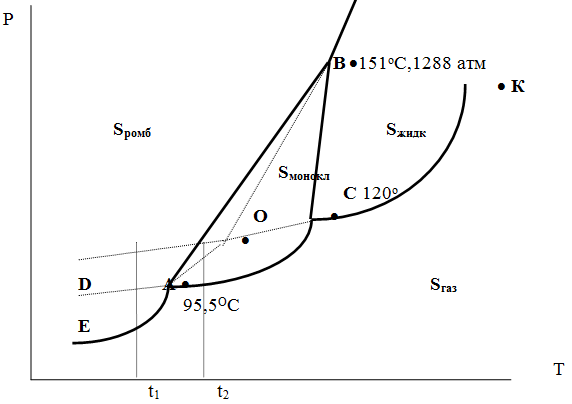
Кристаллическая сера может существовать в двух модификациях - ромбической и моноклинической. Þ S образует 4 фазы : две кристаллические, жидкую и пар; соответственно на диаграмме состояния - 4 области. Линии на диаграмме отвечают условиям, при которых возможно равновесное сосуществование двух фаз; три тройные точки : А, В, С.
Кроме того, существует еще одна тройная точка О, в которой могут сосуществовать перегретая ромбическая сера, переохлажденная жидкая сера и пересыщенный пар. Три термодинамически неравновесные фазы могут образовать метастабильную систему, т.е. систему, находящуюся в состоянии относительной устойчивости. Метастабильность заключается в том, что ни одна из трех фаз не стремится перейти в другую, однако при длительной выдержке или при внесении кристаллов моноклинической серы все три фазы переходят в серу моноклинную, которая является единственной термодинамически устойчивой фазой при условиях точки О.
Метастабильные тройные точки могут давать только те вещества, которые образуют несколько кристаллических модификаций. Точно так же метастабильными являются двойные равновесия ОА, ОВ, ОС.
Если одна кристаллическая модификация при повышении Т должна перейти в др., то возможен некоторый перегрев выше Т устойчивого равновесия. Это объясняется тем, что переход из одной модификации в др. не может совершаться столь же легко, как плавление. Перегретая модификация должна быть выдержана некоторое время при достигнутой Т для того, чтобы произошла перестройка кристаллической решетки. Если же кристаллы достигли Тпл , то перегрев невозможен, т.к. дальнейшее подведение теплоты приводит к немедленному разрушению решетки.
В случае серы : если Sромб нагревать достаточно быстро, то она не успевает перейти в Sмонокл ; вместе с тем кристаллическая решетка Sромб не может выдерживать неограниченного перегрева. При Т кривой ОВ кристаллы распадаются с образованием жидкой фазы, которая в данных условиях тоже неустойчива относительно Sмонокл . Кривые ОА и ОС представляют собой соответственно кривую возгонки перегретой Sромб и кривую кипения переохлажденной жидкой S.
Химические потенциалы Sр и Sм могут быть выражены через химические потенциалы равновесных с ними паров :
mSp = mo + RT ln PSp mSм = mo + RT ln PSм
mo одинаково в обеих формулах, т.к. Т сопоставляемых модификаций одинакова. Þ m будет больше у той модификации, давление насыщенных паров которой выше.
Кривая давления пара Sр (ЕАО) и кривая давления пара Sм (DАС) пересекаются в т. А, лежащей ниже кривой давления пара жидкости КСО. Þ
- при t < 95,5оС давление пара Sм > давления пара Sр и при этих t (например, при t1) возможен самопроизвольный переход Sм ® Sр .
- при t > 95,5о (например, t2) давление пара выше у Sр и должно идти превращение Sр ® Sм .
Такого типа взаимные превращения двух кристаллических модификаций, которые могут протекать самопроизвольно и в прямом, и в обратном направлении в зависимости от условий, называются энантиотропными превращениями.
Если исходить из жидкой S, переохлажденной до t1 или t2, то в первую очередь обычно выкристаллизовывается менее устойчивая модификация, которая уже после достаточной выдержки при той же Т переходит в более устойчивую модификацию. Согласно правилу Оствальда, в случае возможности ряда фазовых переходов от менее устойчивого состояния ко все более устойчивым обычно образуется ближайшая более устойчивая модификация, а не самая устойчивая.
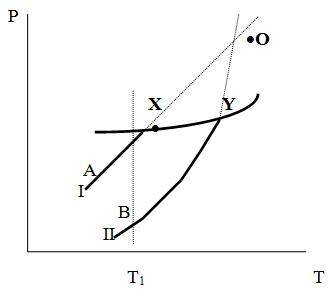
Бывают случаи, когда кривые давления паров двух кристаллических модификаций (например, бензофенона) должны пересечься выше кривой давления пара над жидкой фазой. Обе модификации плавятся в точках Х и Y; Р пара модификации I во всей области существования кристаллов выше Р пара модификации II, а следовательно, самопроизвольные превращения возможны лишь в направлении
|
| I ® II, например, после того как из жидкой фазы, переохлажденной до Т1, выделится модификация I. Точка пересечения О не может быть получена экспериментально. Она находится графически путем продолжения опытных кривых АХ и ВY. В лекции "19 Ультразвуковая диагностика заболеваний предстательной железы и органов мошонки" также много полезной информации. Взаимные превращения кристаллических фаз, которые могут протекать самопроизвольно лишь в одном направлении, называются монотропными. |
Другой пример диаграммы, описывающей реальную монотропную систему, - диаграмма состояния фосфора.
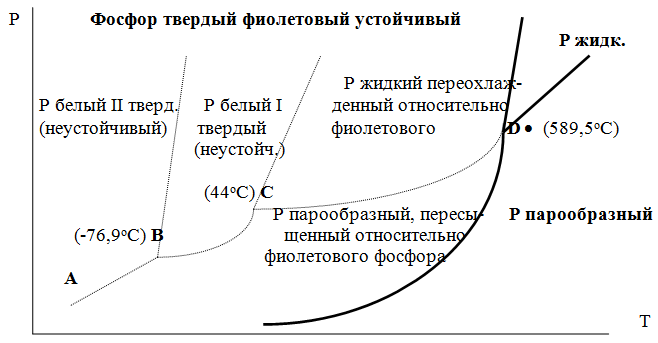
ДИАГРАММА СОСТОЯНИЯ ФОСФОРА.
|
|
Пунктиром обозначены кривые давления паров неустойчивых фаз. Т. D соответствует устойчивому сосуществованию жидкого фосфора, твердого фиолетового фосфора и парообразного фосфора. Точки В и С соответствуют неустойчивому сосуществованию трех фаз : т. В - двух модификаций белого фосфора и пара, т. С - белого фосфора I, переохлажденного жидкого фосфора и пара.
Диаграмма состояния фосфора - пример системы, в которой могут происходить как монотропные превращения (фосфора белого I в фосфор фиолетовый), так и энантиотропные превращения (фосфора белого I в фосфор белый II, хотя оба они и являются неустойчивыми модификациями по сравнению с фиолетовым фосфором).