Двухкомпонентные системы, образующие химическое соединение, плавящееся конгруентно и инконгруентно
Лекция 27
Двухкомпонентные системы, образующие химическое соединение, плавящееся конгруентно и инконгруентно. Трехкомпонентные системы.
КЛАССИФИКАЦИЯ КРИСТАЛЛИЧЕСКИХ СМЕСЕЙ.
| Изоморфные | Неизоморфные (совершенно нерастворимые в тв. состоянии) | Ограниченно растворимые |
Рекомендуемые материалы-50% Расчет передачи -50% Растяжение — сжатие, Кручение -50% Электромагнитная индукция + Электромагнитные волны -66% Теория поля -50% Растяжение — сжатие, Кручение -50% Статически определимые балки Системы, компоненты которых образуют твердые растворы в любых соотношениях | 1. Системы, не образующие химических соединений - системы с простой эвтектикой 2. Системы, образующие устойчивое химическое соединение, плавящееся без разложения (конгруентно) 3. Системы, образующие неустойчивое химическое соединение, плавящееся с разложением (инконгруентно) |
|
| Твердая фаза - одна : твердый раствор А в В или В в А | В твердом состоянии - две кристаллические фазы: кристаллы А и В или кристаллы А (В) и химического соединения | В твердом состоянии может быть одна кристаллическая фаза - твердый раствор одного компонента в др., либо две кристаллические фазы - кристаллы А и В |
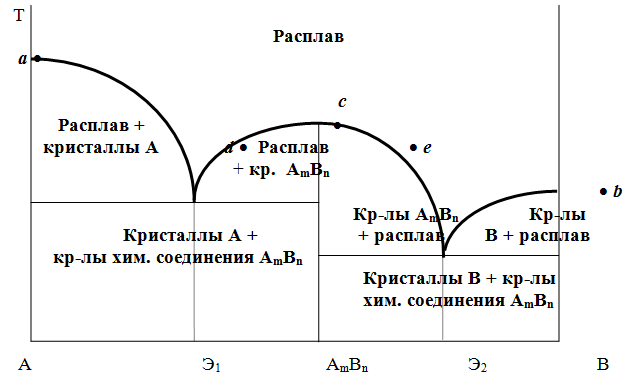
Диаграмма состояния системы, образующей химическое соединение, плавящееся конгруентно (без разложения).
Диаграмма представляет собой сочетание двух отдельных диаграмм двухкомпонентных систем : одна отвечает системе вещество А - химическое соединение AmBn, другая - системе химическое соединение - вещество В. Каждая диаграмма имеет свою эвтектическую точку. К каждой из этих диаграмм приложимо все, что было сказано относительно диаграммы системы с простой эвтектикой.
Число степеней свободы в т. с : С = 1 - 2 + 1 = 0 ; компонент один - химическое соединение.
При одной и той же Т кристаллическое химическое соединение может быть в равновесии с двумя различными расплавами (например, с расплавами d и е).
По характеру максимума, отвечающего температуре плавления химического соединения (т. с), можно судить об его прочности. Чем прочнее соединение, тем острее максимум. Частичное разложение соединения, происходящее при плавлении, понижает Тпл и сглаживает максимум (что имеет место в большинстве случаев; острый максимум довольно редок).
Если два вещества образуют несколько устойчивых химических соединений, то диаграмма состояния соответственно распадается на ряд диаграмм двухкомпонентных систем. Одна и та же система может давать химические соединения как очень устойчивые при плавлении, так и диссоциирующие.
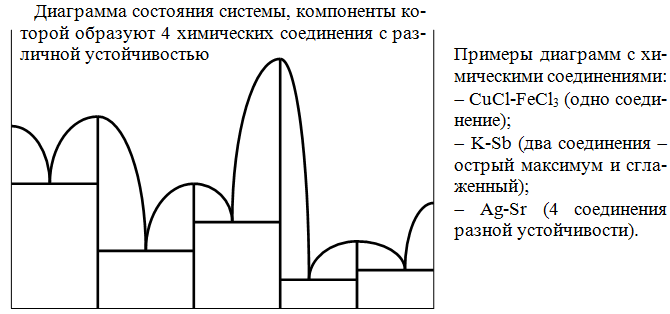
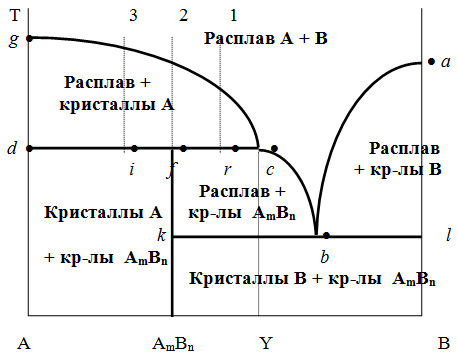
Диаграмма состояния системы, образующей химическое соединение, плавящееся инконгруентно (с разложением).
Инконгруентное плавление - такое, при котором составы исходной твердой фазы и получаемой жидкой не совпадают. Пример : система СaSiO3 + BaSiO3 ; соединение полностью разлагается ниже своей Тпл.
|
| Кривые на диаграмме : ab - начало кристаллизации из расплава вещества В; bc - начало кристаллизации химического соединения; cg - начало кристаллизации вещества А. Области на диаграмме (6 областей - см. подписи на рис.) |
Процессы выделения кристаллов в областях abl (кристаллы В), cdg (кристаллы А), bcfk (кристаллы химического соединения AmBn) аналогичны процессам, происходящим в системе с простой эвтектикой.
Рассмотрим фазовые превращения при условиях, которым отвечает линия cfd. Здесь возможны три случая :
1 - исходный расплав обогащен компонентом В по сравнению с химическим соединением;
2 - исходный расплав обогащен компонентом А;
3 - состав исходного расплава в точности отвечает химическому соединению.
При охлаждении каждого из этих трех расплавов сначала выделяются кристаллы А и при достижении фигуративных точек r, f или i система состоит из двух фаз : расплава, отвечающего т.c, и кристаллов А, отвечающих т.d. При дальнейшем отнятии теплоты происходит кристаллизация химического соединения, которое образуется в результате взаимодействия уже выпавших кристаллов А с расплавом состава Y.
На всей линии difrc : С = 2 - 3 + 1 = 0 ; во всех трех случаях в процессе кристаллизации система состоит из трех фаз.
Изменения, происходящие затем в системе при отнятии теплоты, зависят от состава исходного расплава.
1 - после того как все кристаллы А израсходуются на образование химического соединения, получится система, состоящая только из двух фаз : расплава состава с и кристаллов химического соединения. Для этой системы С = 2 - 2 + 1 = 1 ; дальнейшее отнятие теплоты приведет к понижению Т и выделению следующих количеств кристаллов химического соединения; состав расплава изменяется по кривой сb. В т.b (жидкая эвтектика) дальнейший ход кристаллизации аналогичен рассмотренному ранее.
2 - при кристаллизации химического соединения полностью израсходуется как расплав, так и кристаллы А, и система образует одну фазу - кристаллическое химическое соединение, состав которого не меняется при дальнейшем отнятии теплоты.
3 - некоторое количество кристаллов А остается неиспользованным после того, как весь расплав израсходован на образование химического соединения, и по окончании кристаллизации система состоит из двух фаз - кристаллов химического соединения и кристаллов А, которые не изменяются при дальнейшем охлаждении.
Т.с, отвечающая температуре и составу раствора, который может находиться в равновесии с двумя кристаллическими фазами, называется перитектической. Она отличается от эвтектической тем, что оба вида кристаллов, равновесных с расплавом, обогащены одним и тем же компонентом по сравнению с этим расплавом (в данном случае компонентом А). Перитектическую точку можно еще характеризовать тем, что она является нижней точкой кривой начала кристаллизации одной фазы (А) и верхней точкой кривой начала кристаллизации второй фазы (химическое соединение), тогда как эвтектическая точка является нижней точкой обеих кривых.
Т.о., особенностью инконгруентного плавления является то, что в равновесии с кристаллическим химическим соединением (т.f) находится жидкость другого состава (т.c) - в отличие от конгруентной точки плавления.
ТРЕХКОМПОНЕНТНЫЕ СИСТЕМЫ.
Для построения полной диаграммы состояния трёхкомпонентной системы нужна система координат из пяти взаимно перпендикулярных осей, по которым можно было бы откладывать Т, P, мольные объёмы различных фаз и мольные доли первого и второго компонентов. Осуществить подобную диаграмму невозможно. Проекция этой диаграммы на четырёхмерное пространство в осях : Т, P, мольные доли двух компонентов тоже не может быть построена. Лишь после дальнейшего упрощения, приняв, например, давление постоянным, получаем возможность построить трёхмерную диаграмму, отражающую зависимость состава и числа фаз в равновесных системах от исходного состава и от Т при постоянном P. Очень часто для ещё большего упрощения принимаются постоянными и P и Т ; строится двумерная диаграмма. Двумерные диаграммы отражают различные состояния системы и фазовые переходы, наблюдающиеся только при выбранных значениях P иТ.
При построении диаграммы состояния трёхкомпонентной системы состав её изображают на плоскости, а в направлении, перпендикулярном плоскости, откладывают Т (P принимается постоянным) или P (постоянной принимается Т).
Состав трёхкомпонентной системы удобно изображать, пользуясь треугольником Гиббса-Розебома. Вершины равностороннего треугольника отвечают содержанию в системе 100% каждого из компонентов А, В и С. Стороны треугольника позволяют описать составы двухкомпонентных систем А + В, В + С, С + А. Точки, лежащие внутри треугольника, описывают составы трёхкомпонентных систем. Метод определения состава, предложенный Гиббсом, основан на том, что сумма перпендикуляров, опущенных из любой точки внутри равностороннего треугольника на каждую из сторон, равна высоте треугольника. Если принять, что длина всей высоты треугольника отвечает 100 мольным (или весовым) процентам, то состав тройной системы можно выразить с помощью длин вышеупомянутых перпендикуляров. При этом содержанию данного компонента будет отвечать длина перпендикуляра, опущенного на сторону, противоположную соответствующей вершине треугольника. Так, например, точка р отвечает составу : 20% компонента А (отрезок ра), 30% компонента В (отрезок рв) и 50% компонента С (отрезок рс).
Длина перпендикуляров оценивается с помощью сетки, покрывающей треугольник.
Розебом предложил для определения состава системы использовать отрезки трёх прямых, параллельных сторонам треугольника и проходящих от данной точки до пересечения с каждой из сторон треугольника (эти отрезки нанесены на рис. пунктиром).
Линии, параллельные одной из сторон треугольника, представляют собой геометрические места точек, соответствующих ряду смесей с одинаковым содержанием одного из компонентов. Так, линия ху отвечает смесям, в которых содержание компонента В составляет 65%.
Линии, проведённые из вершин треугольника до пересечения с противолежащей стороной, являются геометрическими местами точек, соответствующих ряду систем, в которых отношение между содержанием двух компонентов остаётся постоянным. Так, например, линия Bz отвечает ряду смесей, в которых процентное содержание А и С относятся, как 7:3.
К треугольной диаграмме, так же как и к диаграмме бинарных систем, приложимо правило рычага.
Ограниченная взаимная растворимость трех жидкостей.
Жидкие трехкомпонентные системы могут состоять из жидких веществ, как дающих растворы любого состава, так и взаимно ограниченно растворимых. В последнем случае на диаграмме состояния появляется область расслаивания. Фигуративной точке системы, лежащей внутри этой области (т. о) отвечают фазовые фигуративные точки двух растворов, на которые распадается система (т. х и у).
Взаимная растворимость трех компонентов зависит от Т, и в некоторых случаях при соответствующей критической Т наступает взаимная неограниченная растворимость всех трех компонентов (надо смотреть объемную диаграмму).
34 Непосредственные умозаключения - лекция, которая пользуется популярностью у тех, кто читал эту лекцию.
Область ограниченной растворимости может иметь различные очертания.
На рис. приведена диаграмма состояния, соответствующая простейшей системе, в которой компоненты А и В, а также В и С неограниченно взаимно растворимы, а компоненты А и С взаимно ограниченно растворимы. Когда компоненты А и С практически нерастворимы друг в друге, точки Е и F смыкаются с точками А и В соответственно. Увеличению взаимной растворимости способствует прибавление третьего компонента - гомогенизатора.
Составы двух жидких фаз х и у, на которые распадается система состава о, могут быть определены только опытным путем. Это объясняется тем, что в данном случае невозможно графически найти направление нод, т.к. вся плоскость треугольника относится к одной и той же Т.
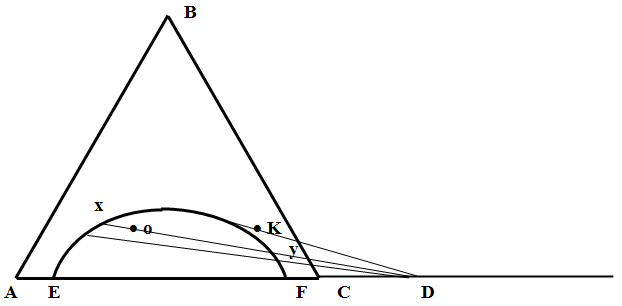
По эмпирическому правилу Тарасенкова продолжения всех нод на диаграммах подобного типа пересекаются в одной точке, лежащей на продолжении одной из сторон треугольника (той стороны, которая одновременно является коннодой сопряженных растворов из двух ограниченно растворимых жидкостей). Определив составы хотя бы одной пары сопряженных растворов (например, х и у), можно найти т. D и по ней построить систему нод для области расслаивания. Проведя из т. D касательную к кривой расслаивания, найдем т. К, отвечающую составу, при котором система становится гомогенной при данной Т. Правило Тарасенкова соблюдается далеко не для всех систем.
Точка К - критическая точка, где составы сопряженных растворов становятся тождественными. Точка К, как правило, расположена асимметрично. Это обусловлено тем, что растворимость компонента В в растворах Е и F различна (для системы, изображенной на рис., растворимость В в растворе, богатом А, больше, чем в растворе, богатом С).