Влияние температуры на химическое равновесие. Уравнение изобары (изохоры) процесса
Лекция 22
Влияние температуры на химическое равновесие. Уравнение изобары (изохоры) процесса. Зависимость изобарного потенциала реакции и константы равновесия от температуры. Тепловой закон Нернста, его приложение к химическим превращениям. Приближенные методы расчета химических равновесий.
ЗАВИСИМОСТЬ ХИМИЧЕСКОГО РАВНОВЕСИЯ ОТ ТЕМПЕРАТУРЫ.
С изменением Т положение равновесия химической реакции смещается. Поэтому константа равновесия является функцией Т.
В соответствии с принципом подвижного равновесия можно установить качественное правило смещения химического равновесия с изменением Т. При повышении температуры dТ смещение равновесия должно сопровождаться увеличением энтропии; т.к. (dТ)Р (¶S)Т > 0, то химическое равновесие при повышении Т должно сместиться в сторону эндотермической реакции, а при понижении Т – в том направлении, в котором протекает экзотермическая реакция.
Выражение для количественной зависимости химического равновесия от Т можно получить, исходя из двух уравнений :
– уравнения изотермы реакции Вант-Гоффа для изобарного потенциала химической реакции:
DG = – RT ln KP + RT å ni ln Pi (1)
Рекомендуемые материалы
(Pi – исходные парциальные давления участников реакции ; постоянны)
– уравнения максимальной работы Гиббса-Гельмгольца :
DG = DH + T  (2)
(2)
Подставим уравнение (1) в  :
:
 = – R ln KP – RT
= – R ln KP – RT  + R å ni ln Pi
+ R å ni ln Pi
DG = DH – RT ln KP – RT2  + RT å ni ln Pi
+ RT å ni ln Pi
___ _________ сокращаем , = (1) __________
 =
= 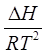
P = const :  =
= 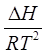 = –
= –  – уравнение изобары химической реакции Вант-Гоффа
– уравнение изобары химической реакции Вант-Гоффа
Аналогично из уравнений :
DF = – RT ln KC + RT å ni ln Ci и DF = DU + T 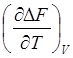
можно получить уравнение изохоры химической реакции Вант-Гоффа :
V = const :  =
=  = –
= – 
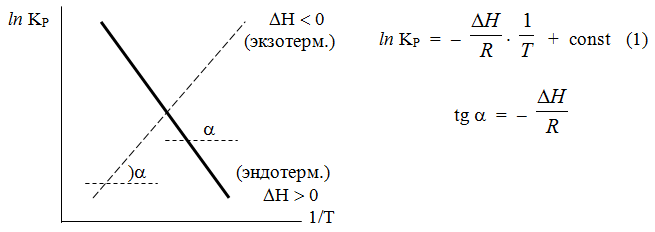
Эти уравнения в дифференциальной форме показывают зависимость константы равновесия в смеси идеальных газов от Т. Если реакция протекает в смеси реальных газов, то КР заменяется на Кf ; КС – на Ка , если реакция протекает в неидеальном растворе.
Эти уравнения позволяют предвидеть зависимость константы равновесия от Т : если DН > 0, то  > 0, т.е. КР растет с ростом Т.
> 0, т.е. КР растет с ростом Т.
Если интервал температур небольшой, то DH = const.
d ln KP = 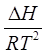 dT
dT
ln  =
= 
 =
=  ×
× 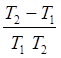
lg  =
=  ×
×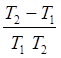
Если знаем DН и КР1 (КР2), то можем рассчитать КР2 (КР1), если Т1 и Т2 не слишком различаются.
В общем случае DН ¹ const, необходимо учесть зависимость DН от Т, которая дается уравнением Кирхгоффа :
DHT = DHo + 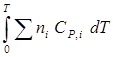
(DHo – постоянная интегрирования уравнения Кирхгоффа и не имеет физического значения теплоты реакции при Т = 0)
или DHT2 = DHТ1 + 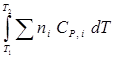
СР = a + bT +  или СР = a + bT + cT2 + dT3
или СР = a + bT + cT2 + dT3
DHT = DHo + aT + bT2 + cT3 + …
ò d ln KP = ò  dT = ò
dT = ò  dT + ò
dT + ò  dT + ò
dT + ò  dT + ò
dT + ò  dT + …
dT + …
ln KP = –  +
+  lnT +
lnT +  T +
T +  T2 + … + const
T2 + … + const
Чтобы найти const, нужно знать (экспериментально определить) КР для одной Т.
DGо = - RT ln KP
(DGо - стандартный изобарный потенциал реакции – если Рi = 1 – парциальные давления всех участников реакции в исходной смеси)
DG = DH – TDS , DGTo = DHTo – TDSTo
(индекс о означает, что величины стандартные; Т – любая)
- RT ln KP = DHTo – TDSTo при Т = const
ln KP = –  +
+  (2)
(2)
Сравнение уравнений (1) и (2) для ln KP показывает, что DН = DНо в уравнении изобары химической реакции; tga = – DHo/R ; const = DSo/R . Þ
 =
=  – уравнение изобары
– уравнение изобары
ТЕПЛОВОЙ ЗАКОН НЕРНСТА. НЕКОТОРЫЕ ПРИБЛИЖЕННЫЕ МЕТОДЫ РАСЧЕТА ХИМИЧЕСКИХ РАВНОВЕСИЙ.
Прямой и простой расчет изобарных потенциалов реакций и КР возможен, если известны абсолютные энтропии всех участников реакции. Для реакций, протекающих при Т = const :
DGTo = DHTo – TDSTo
DHTo – теплота реакции при Р = const
DSTo – изменение S при превращении чистых исходных веществ, взятых в стандартном состоянии при Р = 1 атм, в конечные вещества в том же состоянии :
DSo = åniSio
Если для данной Т известны теплота реакции DНо и энтропии Sio всех участников реакции, то расчет DGo – элементарная арифметическая операция.
Если известны CP = f(T), можно вычислить DНо при данной Т по уравнению Кирхгоффа и S каждого участника по уравнению :
ST =  +
+  +
+  +
+  +
+ 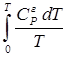
а затем найти DGo.
Т.о., изложенный метод расчета химических равновесий базируется на постулате Планка. Однако для обоснования метода расчета достаточно утверждение, что изменение энтропии для всех процессов (в том числе и химических реакций), происходящих при Т = 0 с участием только кристаллических чистых веществ, равно нулю. Действительно :
S = So + 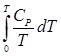
Изменение S при химической реакции составляет :
DS = DSo + 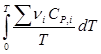
Приняв DSo = 0, получим :
DS = 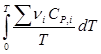 = åni
= åni  ,
,
т.е. возможность вычислить DS, используя те же табличные величины стандартных энтропий.
Уравнение DSo = 0 является выражением теплового закона Нернста, который был исторически первой формой третьего закона термодинамики, высказанной Нернстом в 1906 г.
Изложенный метод расчета химических равновесий называется методом абсолютных энтропий и является общим для реакций в любых системах. Он позволяет использовать эмпирические уравнения.
DGTo = DHTo – TDSTo
DHTo = DНо298 +  ; (DНо298)x = ån(DНоf, 298)конеч.в-в - ån(DНоf, 298)нач.в-в
; (DНо298)x = ån(DНоf, 298)конеч.в-в - ån(DНоf, 298)нач.в-в
DSTo = DSo298 + 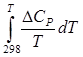
DGTo = DНо298 +  –TDSo298 – T
–TDSo298 – T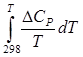 – уравнение для точного расчета изобарного потенциала реакции; надо знать : DSo298 и СР(Т). Расчет точного значения DGTo по этому уравнению при высоких Т часто невозможен из-за отсутствия соответствующих экспериментальных данных. В таких случаях возможно применение приближенных методов расчета изобарных потенциалов.
– уравнение для точного расчета изобарного потенциала реакции; надо знать : DSo298 и СР(Т). Расчет точного значения DGTo по этому уравнению при высоких Т часто невозможен из-за отсутствия соответствующих экспериментальных данных. В таких случаях возможно применение приближенных методов расчета изобарных потенциалов.
ПЕРВОЕ ПРИБЛИЖЕНИЕ УЛИХА : DСР = 0 – применяется, когда СР некоторых участников реакции совершенно неизвестны. Получаем :
DGTo = DHо298 – TDSо298
– в пределах Т не более 600 К дает удовлетворительные результаты.
ВТОРОЕ ПРИБЛИЖЕНИЕ УЛИХА : DСР = const – применяется, если числовые значения СР участников реакции известны при комнатной Т.
DGTo = DHо298 – TDSо298 + DСР(Т – 298) – ТDСР ln  =
=
= DHо298 – TDSо298 – DCPT  = DHо298 – TDSо298 – MoDCPT
= DHо298 – TDSо298 – MoDCPT
Значения Мо при различных Т сведены в таблицу.
МЕТОД ТЕМКИНА-ШВАРЦМАНА расчета DGo :
Люди также интересуются этой лекцией: 8. Английская литература эпохи возрождения.
DCP = D a + D bT + D cT2 + … + D nTn
DGTo = DHо298 – TDSо298 – T× (D aMo + D bM1 + D cM2 + … + D nMn)
Mo =  ; M1 =
; M1 = 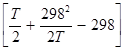
Mn =  +
+  –
– 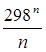
Выражение для Mn справедливо и для n = – 2. Коэффициенты Мо, М1 … уравнения зависят только от Т; они сведены в таблицу для разных Т.
Отсутствие значений DSо298 многих веществ (огромного большинства из них) приводит к необходимости пользоваться некоторыми приближенными закономерностями для их подсчета. Известно значительное число таких закономерностей, предложенных разными авторами, охватывающих большие или меньшие группы соединений и дающих результаты разной степени точности.






















