Химическое равновесие в газах при высоких давлениях
Лекция 21
Химическое равновесие в газах при высоких давлениях. Гомогенные химические равновесия в жидкой фазе. Гетерогенные химические равновесия.
ХИМИЧЕСКОЕ РАВНОВЕСИЕ В ГАЗАХ ПРИ ВЫСОКИХ ДАВЛЕНИЯХ.
При высоких Р газовые смеси не являются идеальными. В этом случае ЗДМ выражается уравнением :
Kf = 
Для вычисления Kf необходимо знать парциальные летучести fi компонентов смеси. Их можно вычислить с помощью приближенного правила :
fi = fio× Ni
fio – летучесть чистого газового компонента при той же Т и полном давлении смеси.
Рекомендуемые материалы
fio = gi × Pio
gi – коэффициент активности (коэффициент летучести газа); значения gi находят с помощью принципа соответственных состояний или другими способами.
Рассмотрим метод расчета равновесия при высоких Р на примере синтеза аммиака при t = 450оС и Р = 300 атм.
 N2 +
N2 +  H2 Û NH3
H2 Û NH3
При t = 450оС и Р = 1 атм КР (опытная) = 0,00649. Это значение сохраняется и для высоких Р, но для Kf .
Kf =  =
=  ×
× 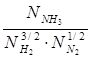
Подставляем в это уравнение fio = gi × Pio и учитываем, что Pio для каждого компонента равно полному давлению смеси Р :
Kf =  ×
×  ×
× 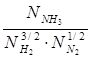
Выражая все мольные доли Ni через мольную долю N аммиака в равновесной смеси, получим (см. предыдущую лекцию):
Kf =  ×
×  ×
× 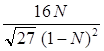
С помощью обобщенной диаграммы g = g (p, t), зная Ткр и Ркр для Н2, N2, NH3, находят gi и подставляют в вышеприведенное уравнение; вычисляют N. N вычисленное равно 0,352; N опытное равно 0,355. Если расчет будем вести по формуле для КР (как для идеальной газовой смеси), то N = 0,309.
Величина КР мало изменяется при Р < 50 атм, а затем быстро растет. Величина Kf постоянна до 300 атм, а затем растет, но в значительно меньшей степени, чем КР. Это связано с тем, что, во-первых, уравнение fio = gi × Pio , а во-вторых, принцип соответственных состояний применимы в данном случае лишь при Р < 500 атм.
ГОМОГЕННЫЕ ХИМИЧЕСКИЕ РАВНОВЕСИЯ В ЖИДКОЙ ФАЗЕ.
Состоянию равновесия реакций, протекающих в жидкой фазе, отвечает условие : ånimi = 0. Исходя из этого уравнения, можно получить выражения для констант равновесия реакций, протекающих в растворах.
mi = mio (T) + RT ln Ni - если компоненты - идеальные растворы
mi = mio (T) + RT ln ai - если компоненты - реальные растворы
Аналогично ранее рассмотренному выводу для КР можно получить :
Ка =  ; KN =
; KN = 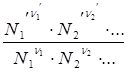
для реальных растворов для идеальных растворов
Если через N выражать константу равновесия в реальных растворах, то KN будет зависеть от N; по мере приближения этих растворов к идеальному состоянию lim KN = Ка.
В предельно разбавленных растворах а ~ N и KN = const. Константу равновесия этих растворов можно выражать через молярность; т.к. c ~ N в предельно разбавленных растворах, то КС = const, но числовые значения КС и KN различны.
Примером реакции в растворе, следующей закону действия масс для идеальных растворов во всем интервале концентраций (KN = const), является реакция этерификации :
С2Н5ОН + СН3СООН Û СН3СООС2Н5 + Н2О
(х – у) (1 – у) у у
Общее число молей в ходе реакции не меняется; KN можно выразить через числа молей компонентов. Если в исходной смеси на 1 моль кислоты взять х молей спирта и получить у молей эфира, то :
KN = 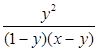
Закону действия масс для идеальных растворов следует также реакция :
С5Н10 + СН3СООН Û СН3СООС5Н11,
которая протекает с изменением числа молей. Вследствие этого разбавление реакционной смеси индифферентным растворителем смещает в данном случае равновесие.
Многие реакции, протекающие в газовой фазе, могут происходить и в жидких растворителях. Однако значения констант равновесия одной и той же реакции, выраженные через одни и те же величины, оказываются в этих случаях различными. Такое различие показывает большое влияние растворителя на положение равновесия. Это влияние может быть очень сильно выражено : константы равновесия могут различаться в десятки раз.
Для вычисления констант равновесия реакций в реальных растворах нужно пользоваться уравнением для Ка. Выход продуктов реакции даже в том случае, когда величина Ка известна, может быть рассчитан только при условии, что известны коэффициенты активности всех компонентов реакции. Для их определения необходимы сложные и кропотливые исследования, включающие аналитическое определение состава равновесных растворов. Т.о., предсказание равновесных выходов в реальных растворах в общем случае практически невозможно. Оно осуществимо лишь для отдельных классов растворов, где известные закономерности позволяют учесть зависимость коэффициентов активности от концентрации (регулярные растворы, разбавленные электролиты).
ГЕТЕРОГЕННЫЕ ХИМИЧЕСКИЕ РАВНОВЕСИЯ.
Гетерогенными химическими равновесиями называются равновесные состояния для реакций, участники которых находятся в нескольких фазах. Примеры – равновесия реакций :
FeO (т) + CO = Fe (т) + CO2 (2 твердые и 1 газообразная фаза)
NH4Cl (т) = NH3 (г) + HCl (г) (1 твердая и 1 газообразная фаза)
Fe (ж) + H2S = FeS (р-р в Fe) + H2 (1 жидкая и 1 газообразная)
Условие химического равновесия ånimi = 0 сохраняет свое значение и для гетерогенного химического равновесия. Исходя из него, найдем выражение для ЗДМ. Допустим, что в реакции участвуют компоненты Аi газовой смеси с парциальными давлениями Pi (летучестями fi ) и компоненты Bk растворов (одного или нескольких жидких или твердых) с мольными долями Nk (активностями ak) :
n1А1 + n2А2 + … + r1В1 + r2В2 + … = n1¢А1¢ + n2¢А2¢ + … + r1¢В1¢ + r2¢В2¢ + …
разобьем сумму химических потенциалов на две суммы – для газообразных участников (индекс i ) и для компонентов жидких и твердых растворов (индекс k ):
 +
+  = 0
= 0
mi = Gi¢(T) + RT ln fi – для газов
mk = mko (T,P) + RT ln ak – для жидких и твердых растворов
 +
+  + RT
+ RT  + RT
+ RT  = 0
= 0
ln  + ln
+ ln  = –
= – 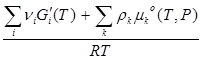
ln  = ln Kf a = –
= ln Kf a = – 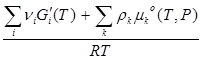 = ln f (T,P)
= ln f (T,P)
Kf a =  = f (T,P) » f (T)
= f (T,P) » f (T)
Это уравнение – наиболее общее выражение ЗДМ для химических реакций, протекающих между веществами, находящимися в разных фазовых состояниях.
Если газовая смесь есть идеальный раствор идеальных газов, где fi = Pi , а конденсированные фазы представляют собой также идеальные растворы, в которых ak = Nk , то :
Kf a = KPN = 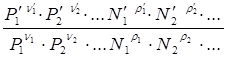
Очень часто твердые, а иногда и жидкие фазы, участвующие в реакции, являются практически чистыми индивидуальными соединениями, активность и химический потенциал которых зависят только от Т. При Т = const ak = const, Nk = 1 и эти величины могут быть включены в константу равновесия. Если так обстоит дело для всех конденсированных фаз, участвующих в реакции, то уравнения ЗДМ включают только летучести (Pi ) газообразных участников реакции.
Так, для реакции FeO (т) + H2 = Fe (т) + H2O (г) при высоких Т :
КР = 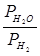
"1.6. Классификаторы" - тут тоже много полезного для Вас.
Для реакции СаСО3 (т) = СаО (т) + СО2 КР = 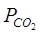
Гетерогенная реакция получения генераторного газа
С + СО2 = 2СО
имеет важнейшее техническое значение. Равновесие этой реакции определяет состав газов в процессах горения при недостатке О2. В металлургических процессах эта реакция определяет ход восстановления металлических окислов в различных температурных зонах металлургических печей.
КР =  =
= 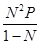
(N – мольная доля СО в равновесной смеси). Равновесие этой реакции зависит от Т и Р. При Р = 1 атм и Т > 1200оС газовая фаза состоит почти нацело из СО, а при Т < 700оС является почти чистой СО2. Т.о., СО при комнатной Т термодинамически неустойчива и существует только вследствие ничтожной скорости реакции 2СО = С + СО2 при этих Т. Повышение Р смещает равновесие реакции влево (в соответствии с общим правилом смещения равновесия).






















