Абсорбция серного ангидрида. Абсорбционное отделение и его аппаратура. Схема двухстадийного окисления и абсорбции
Лекция №7
Абсорбция серного ангидрида. Абсорбционное отделение и его аппаратура. Схема двухстадийного окисления и абсорбции.
Нитрозный способ получения серной кислоты, принципиальная схема.
Абсорбция серного ангидрида. Абсорбционное отделение. Двухступенчатая абсорбция.
nSO3 + H2O→ H2SO4 +(n -1) SO3
n > 1-олеум
n = 1- моногидрат (100% H2SO4)
Рекомендуемые материалы
n < 1- разбавленные растворы H2SO4
Стандартом предусматривается содержание в продукционном олеуме не менее 18,5% SO3 (своб.)
1 ) при растворении в концентрированной H2SO4
m SO3 +n H2SO4 *k H2O → (n+m)H2SO4 *(k+m)H2O +Q
2) при растворении олеума в олеумном абсорбере
m SO3 +n H2SO4 *kSO3 → nH2SO4 (k+m) SO3 +Q
Степень поглощения SO3 зависит от t, p, c
Скорость процесса Q = k F ∆P
Q- количество абсорбируемого SO3, кг/ч
К- коэффициент абсорбции ,кг/(м2.ч. мм. рт. ст.)
F- поверхность насадки ,м2
∆р- движущая сила абсорбции К= Ко*w0,8
Ко – коэффициент зависящий от Т и С серной кислоты
w - фиктивная скорость газа в абсорбере
чем ниже температура, тем выше Ко
Чем больше F, тем выше скорость.
∆Р={( Р1ﺍ - Р2״)-( Р2ﺍ - Р1ﺍﺍ)} / 2.3lg {(Р1ﺍ - Р2״)/ (Р2ﺍ - Р1״)}
Где Р1ﺍ и Р2ﺍ - парциальное давление SO3 в газе до и после абсорбера (Н/м2)
Р1״ и Р2״ – равновесное давление SO3 над олеумом на входе его в абсорбер и выходе из него.
Абсорбция концентрированными растворами серной кислоты проводится при t =60ºС и концентрация 98,3- 98,6% H2SO4 при орошении в моногидратном абсорбере.
При этом достигается степень поглощения η=0,995 -0,999
В олеумном абсорбере происходит орошение олеумом концентрацией 20% SO3 своб. или 85,3% (общ), t(олеума)=60-70ºС.
Выход олеума – доля продукта получаемого в виде олеума. Выход олеума тем больше, чем меньше паров воды и больше SO3 содержится в газе.Как в скрубберах с насадкой – башнях орошаемых серной кислотой, так и аппаратах барботажного типа, где газ проходит через слой кислоты, серная кислота поглощает из газовой смеси только SO3, остальная часть газа пройдя абсорберы удаляется в атмосферу.
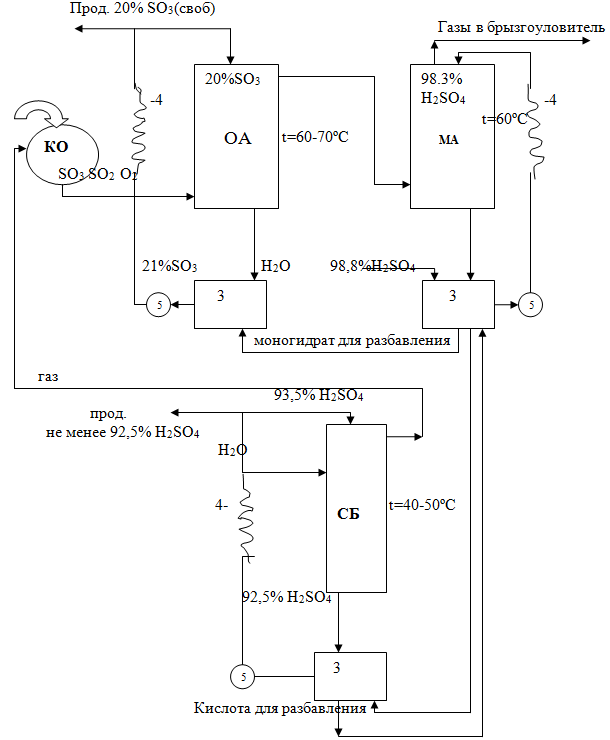
1-олеумный абсорбер
2- моногидратный абсорбер
3- сборник кислоты
4- холодильники
5- насосы
6- сушильная башня
КО- контактное отделение
Основной показатель работы абсорбционного отделения (полнота абсорбции SO3).
Перед производством H2SO4 стоят следующие проблемы:
- обезвреживаемые отходящих газов от SO2, SO3 применяется брызгоуловители, бисульфитные башни.
- повышение степени использования сырья
- увеличение энергетического коэффициента полезного действия.
Двойная абсорбция – двойное контактирование.
Принципиальная схема ДК – ДА
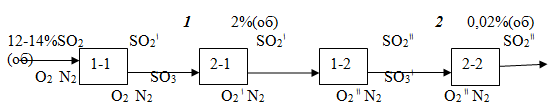
1- 1 – окисление газа SO2
2- 1 – первая степень абсорбции SO3
1- 2 - вторая степень контактирования
2- 2-вторая степень абсорбции SO3
1 степень Х1= 0,9- 0,95
2 степень Х2 = 0,995 – 0,997
В сернокислотной промышленности применяют разнообразные холодильники кислоты: погружные, оросительные, спиральные, трубчатые, воздушные и другие.
Кислоты охлаждаемые в холодильнике вызывают коррозию, поэтому холодильники большинство изготавливаются из антегмита или свинца, холодильники охлаждающие олеум из углеродистой стали, холодильники сушильных башен, кислот и моногидрата из серого чугуна или кислотостойких сталей марок Х18Н10Т Х17Н13М2Т
Нитрозный метод получения H2SO4
Сущность нитрозного метода состоит в том, что обжиговый газ после очистки от пыли обрабатывают серной кислотой, в которой растворены окислы азота (нитроза )
SO2+ N2O3 +H2O → H2SO4 +2NO
NO + O2 → NO2
Процесс производства серной кислоты состоит из следующих стадий:
1. получение сернистого ангидрита
2. поглощение SO2 нитрозой
3. окисление SO2 нитрозой
4. освобождение нитрозы от окислов азота (денитрация)
5. окисление выделившейся из нитрозы окиси азота кислородом в газовой фазе
6. поглощение окислов азота серной кислотой
Свойства нитрозы. Нитрозой называют растворы окислов азоты N2O3 в водных растворах серной кислоты
2 H2SO4 + N2O3 =2HNSO5 +H2O +Q
H2SO4 + 2NO2 = HNSO5 +HNO3 +Q
Нитрозилсерная кислота представляет собой белые бесцветные микроскопические кристаллы.
В водных растворах H2SO4,HNSO5 гидролизуется:
HNSO5 + H2O ↔ H2SO4 +HNO2
При концентрации 98% H2SO4 – 1,1% гидролиза
При концентрации 57% H2SO4 -100% гидролиз
Принципиальная схема получения серной кислоты башенным способом.
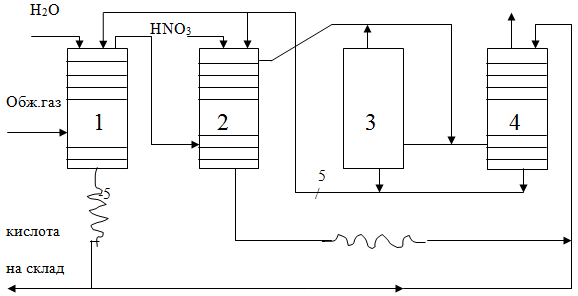
1- денитрационная башня
2- продукционная башня
3- окислительная башня
4- абсорбционная башня
5- холодильник кислоты
Первая башня предназначена для выделения окислов азота из кислоты орошающей башню (денитрация) одновременно с денитрацией кислоты в башне 1 сернистый ангидрид частично абсорбируется серной кислотой и окисляется окислами азота.
Первая башня состоит из трех зон :
А)в нижней зоне происходит упаривание H2SO4 с выделением паров воды в газовую фазу.
В) в средней зоне окислы азота выделяются из нитрозы в следствии наибольшего её разбавления
Г) в верхней зоне конденсируются поступающие снизу пары воды и следовательно происходит разбавление нитрозы и частичное окисление растворяющегося в ней SO2 .
В первой башне из газа улавливаются остатки пыли, поглощают As2O3, SeO2, конденсируются пары серной кислоты , образуется сернокислотный туман.
Вторая башня – происходит абсорбция сернистого ангидрида из обжигового газа серной кислотой и окисление SO2 нитрозой (70-80%) продукционная кислота.
В башне 3 окись азота окисляется кислородом содержащимся в газе. Из окислительной башни газ поступает в башню 4, где окислы азота поглощаются орошающий её серной кислотой, эту башню называют абсорбционной.
При производстве башенной кислоты неизбежны потери окислов азота с отходящими газами, с продукционной кислотой. Для восполнения этих потерь в башню 1 и 2 подается HNO3
Окисление SO2 нитрозой.
Схема реакций образования H2SO4 в нитрозном процессе :
1)поглощение газа жидкостью (нитрозой)
SO2(r) → SO2 (p)
O2 (r ) → O2 (p)
2)Реакции в жидкой фазе
SO2 +H2O → H2SO3
HNSO5 +H2O → H2SO4 +HNO2
H2SO3 +HNO2 → H2SO4 +2NO +H2O
NO + 1/2 O2→ NO2
NO + NO2 +H2О→ 2HNO2
3) Выделение окиси азота из жидкой фазы
2HNSO5 + H2O = 2H2SO4 +(NO +NO2)
NO(p )→ NO(r )
Окисление окислов азота в газовой фазе
2NO + O2 → 2 NO2
4)Удаление окислов азота из нитрозы.
Люди также интересуются этой лекцией: 14 Скорость точки в полярных координатах.
Из кислоты орошающей башню 1 окислы азота должны быть удалены полностью для уменьшения потерь окислов азота, и получение продукции высокого качества.
С увеличением содержания SO2 в газе скорость денитрации повышается в следствии возрастания скорости окисления SO2 и образуется NO плохо растворимой в кислоте.
Наиболее интенсивно процесс денитрации серной кислоты в башне 1 протекает в средней зоне, где происходит наибольшее разбавление H2SO4.
Контрольные вопросы:
- Абсорбция серного ангидрида.
- Абсорбционное отделение и его аппаратура.
- Схема двухстадийного окисления и абсорбции.
- Нитрозный способ получения серной кислоты, принципиальная схема.




















