Блок преобразователя
Блок преобразователя
Блок преобразователя предназначен для преобразования электрического сопротивления чувствительного элемента, функционально связанного с солесодержанием контролируемой воды, в форму, доступную для непосредственного восприятия (в перемещение указателя показывающего измерительного прибора) и для выдачи сигнала постоянного напряжения на потенциометр КСП2 или на измерительный преобразователь Ш-78 (0-10мВ).
Блок преобразователя конструктивно представляет собой стальную панель, на которой, как на щите, устанавливается преобразователь и микроамперметр.
Основные части преобразователя: корпус, выполненный из листовой стали; шасси с передней панелью и печатная плата, на которой расположена основная часть измерительной схемы.
На передней панели расположена индикаторная лампа, кнопки модульных переключателей и держатель предохранителя.
Основным элементом измерительной схемы является делитель напряжения, одна ветвь которого составляет сопротивление чувствительного элемента, значение которого зависит от УЭП контролируемой воды, другую - терморезисторы, размещенные в чувствительном элементе “А” или “Б”.
При измерении УЭП в диапазоне 0-0,1 и 0-1 мСм/см в цепь делителя включаются терморезисторы Rt3 и Rt4.
Делитель напряжения питается от стабилизированного источника питания. Напряжение питания делителя распределяется соответственно сопротивлениям резисторов, составляющих делитель.
Выходное напряжение делителя, функционально связанное с измеряемой УЭП контролируемой воды, измеряется показывающим прибором, шкала которого отградуирована в единицах УЭП (мСм/см).
Рекомендуемые материалы
Схема принципиальная электрическая кондуктометра показана в рис. 38.
Блок преобразователя имеет также выход на измерительный преобразователь Ш-78 или на потенциометр КСП2.
Контроль работы блока преобразователя производится (нажатием кнопки “КОНТРОЛЬ”) включением в цепь делителя напряжения сопротивлений резисторов R6, R7 и R17, имитирующих сопротивление чувствительного элемента и терморезисторов.
Необходимый уровень выходного сигнала по напряжению 0-10 мВ регулируется резистором R5 и R4. Резисторы R9, R10, R12, R13, R15, R16 предназначены для подстройки параметров чувствительных элементов “А” и “Б” соответственно.
Подстройка производится при наладке блока после замены чувствительного элемента.
При нажатии кнопки В2, В3 и В4 (“РАБОТА”) в цепь делителя напряжения включаются чувствительные элементы, предназначенные для преобразования солесодержания контролируемой воды в УЭП в диапазонах 0-0,1; 0-1 или соответственно. 8.1 Приборы для измерения величины рН
Как известно, вследствии слабой диссоциации части молекул в воде всегда присутствуют положительно заряженные ионы водорода (Н+) и отрицательно заряженные ионы гидроксила (ОН-).
Уравнение диссоциации воды можно записать следующим образом:
 |
Н2О Û Н+ + ОН- (24)
Чистая вода является нейтральным соединением, обладающим равнозначными кислотными и щелочными свойствами.
Уравнение диссоциации кислот:
Hcl Û H+ + Cl-
H2SO4 Û 2H+ + SO (25)
(25)
H2NO3 Û 2H+ + NO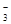
Уравнение диссоциации щелочей:
KOH Û K+ + OH- (26)
NaOH Û Na+ + OH-
Если посмотреть на приведенные уравнения, то можно сделать вывод, что в кислотных растворах в результате диссоциации будет больше положительно заряженных ионов водорода, а в щелочных растворах больше отрицательно заряженных ионов гидроксильной группы ОН-. Измеряя количество ионов Н+ или гидроксила ОН- можно судить, с какой средой мы имеем дело - кислотной или щелочной.
Для удобства вычислений принято активную концентрацию водородных ионов выражать через десятичный логарифм, взятый с обратным знаком, и обозначить ее символом рН:
 |
рН = -lgaн+ , (27)
где:
aн+ - показатель степени активности ионов водорода.
Десятичный логарифм - это показатель степени, в которую нужно возвести данное основание, чтобы получить данное число. Так lg10 = 1; lg100 = 2; lg1000 = 3 и т.д.
Однако значение рН одной и той же анализируемой среды изменяется при изменении ее температуры.
Так, если при температуре 22 оС рН нейтральной среды составляет 7рН, то при температуре 100 оС это значение рН снизится до 6,12, а при температуре 0 оС возрастет до 7,97.
Для определения рН наиболее пригодным является стеклянный электрод, (рис. 43) электродная функция которого (изменение потенциала электрода при изменении активности потенциалообразующих ионов) зависит от активной концентрации ионов водорода в анализируемой среде.
Стеклянный электрод - особый тип ионоактивного электрода, в котором электродная реакция является реакцией обмена между твердой фазой - стеклом и анализируемым раствором:
 |
Н+ Û Н (28)
(28)
В электродной реакции, в данном случае, не участвуют электроны. Но переход иона водорода из одной фазы в другую эквивалентен перемещению единичного заряда, поэтому уравнение потенциала стеклянного электрода имеет вид:
 |
eст = eо + 2,3 lg
lg (29)
(29)
Таким образом, потенциал стеклянного электрода является функцией рН анализируемого раствора как в кислой, так и в щелочной области.
Чувствительная часть стеклянного электрода изготавливается в виде стеклянной мембраны (шарика).
Рис. 43 Стеклянный электрод.
Определение потенциала стеклянного электрода производится измерением разности потенциалов между двумя сторонами мембраны, с одной стороны которой находится анализируемый раствор, а с другой - раствор с неизменной рН.
При работе со стеклянными электродами надо учитывать, что наружная и внутренняя поверхности измерительной мембраны обладают несколько отличными свойствами вследствии различия в условиях их изготовления. В результате этих различий одинаковые растворы, помещенные с обеих сторон мембраны, вызывают появление различных потенциалов по отношению к одинаковым вспомогательным электродам. Разность между этими потенциалами, обусловленная асимметрией двух сторон стеклянной мембраны, называется потенциалом асимметрии стеклянного электрода. Значение этого потенциала различное у разных электродов в зависимости от состава стекла, толщины мембраны, температуры. Обычно потенциал асимметрии составляет несколько милливольт.
При изменении температуры анализируемого раствора потенциал стеклянного электрода изменяется. Температурный коэффициент стеклянного электрода, т.е. изменение электродного потенциала при изменении температуры на 1оС, может составлять приблизительно 2 мВ.
Для измерения величины рН применяют электродные системы избирательного действия, ЭДС которых зависит от активности ионов водорода в анализируемом растворе. Практически получили распространение электродные системы, состоящие из стеклянного индикаторного электрода и каломельного электрода сравнения.
Электродная система для измерения величины рН (рис. 44) состоит из следующих элементов:
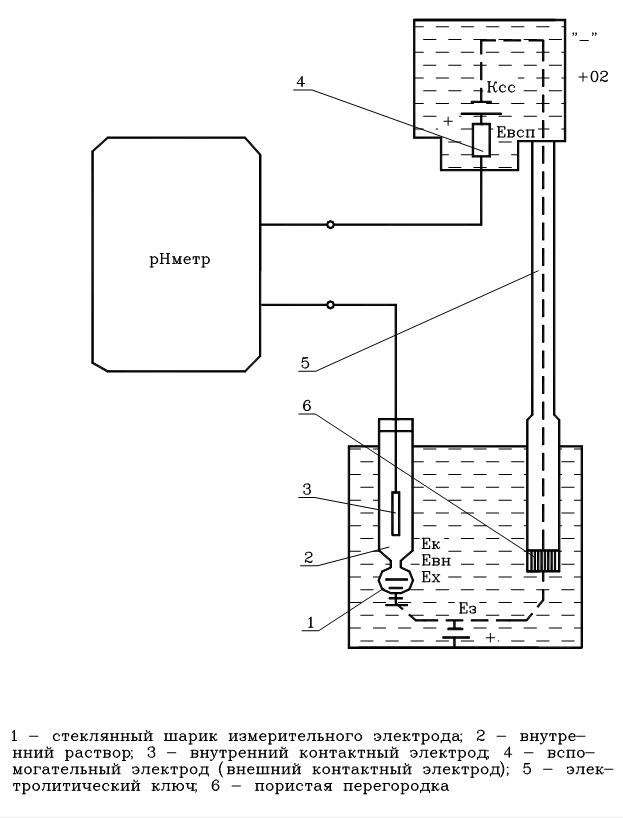
Рис. 44. Электродная система для измерения величины рН.
Активность водородных ионов в растворе выражается ЭДС электродной системы Ех в соответствии с уравнением:
 |
Ех =  lnaн+ (30)
lnaн+ (30)
C учетом влияния температуры раствора после преобразований уравнение имеет вид:
 |
Ех = [58,16 + 0,1984 (Тр - 293)] рН , (31)
где: Тр - температура раствора.
Реально электродная система для измерения Ех представляет собой электрическую цепь, состоящую из нескольких самостоятельных элементов, каждый из которых влияет на суммарную ЭДС Эта цепь в простейшем виде может быть заменена следующим образом:
| Ag | AgCl; HCl | Стеклянная мембрана | Анализируемый раствор | Kcl; Hg2Cl2 | Hg |
| Ек | Евн | Ех | Ед | Евсп |
 |
т.е. Е = Ек + Евн + Ех + Ед + Евсп , (32)
где:
Информация в лекции "10 Глистные заболевания" поможет Вам.
Ех - ЭДС, возникающая на наружной поверхности шарика стеклянного электрода, определяемая величиной рН раствора и его температурой, мВ;
Евн - ЭДС, возникающая на внутренней поверхности стеклянного электрода, мВ
Ек - ЭДС внутреннего контактного электрода, осуществляющего электрический контакт с раствором, заполняющим внутреннюю часть стеклянного электрода и определяемая величиной рН внутреннего раствора, мВ
Евсп - ЭДС внешнего контактного (вспомогательного) электрода, осуществляющего электрический контакт с анализируемым раствором, мВ
Ед - диффузионный потенциал на границе между анализируемым раствором и электродом сравнения, мВ.
Поскольку Ек, Евн, Евсп не зависят от состава анализируемого раствора и меняются только при изменении температуры, а величина Ед не превышает 1-2 мВ и может не учитываться можно сделать вывод, что суммарная (общая) ЭДС находится в функциональной зависимости от ЭДС, возникающей на поверхности шарика стеклянного электрода, определяемая величину рН раствора и его температуры.





















