Кинетика реакций углеводородов в гомогенных и гетерогенных системах
15. Кинетика реакций углеводородов в гомогенных и гетерогенных системах
Химическая кинетика — наука о механизме и скоростях химических реакций. Знание закономерностей химической кинетики протекания реакций позволяет в термодинамически разрешенной области проводить расчеты реальных концентраций и выходов продуктов реакций, составлять материальные и тепловые балансы процессов и аппаратов, определять размеры реакционных аппаратов и т.д.
Данные по механизму и кинетике химических реакций имеют не только чисто теоретическое, но и большое практическое значение. Познание механизма реакций заключается в установлении энергетически выгодных реакционных маршрутов, структуры образующихся в отдельных стадиях промежуточных веществ (активных комплексов, частиц и др.) в зависимости от типа и строения реагирующих молекул и способа активации реакций. В свою очередь, механизм реакций представляет основу для установления кинетических закономерностей протекания реакций во времени в зависимости от параметров химического процесса.
Определение термодинамической вероятности реакции дает лишь качественную характеристику процесса; для полной характеристики процесса надо знать и количественную сторону – скорость, с какой данная термодинамически возможная, реакция будет протекать.
При проектировании, математическом моделировании, научных исследованиях и решении проблем интенсификации и оптимизации химико-технологических процессов принято пользоваться кинетическими закономерностями химических реакций. Химическая кинетика – раздел науки, посвященный изучению скорости реакции. Скорость химической реакции определяется изменением концентрации реагирующего вещества за бесконечно малый отрезок времени. Скорость химической реакции пропорциональна концентрациям исходных веществ в каждый данный отрезок времени
Не следует противопоставлять химическую кинетику и химическую термодинамику. На основе термодинамических закономерностей проектировщик, инженер или исследователь устанавливает в целом наиболее благоприятную, с точки зрения выхода целевого продукта, область протекания химических реакций. Химическая же кинетика позволяет в термодинамически разрешенной области рассчитать концентрации (не равновесные, а кинетические) продуктов реакций, материальный баланс, геометрические размеры реакционных аппаратов и оптимизировать технологические параметры процесса.
Данные по механизму и кинетике химических реакций имеют большое практическое значение. Познание механизма реакций заключается в установлении энергетически выгодных реакционных маршрутов, структуры образующихся в отдельных стадиях промежуточных веществ (активных комплексов, частиц и др.) в зависимости от типа и строения реагирующих молекул и способа активации реакций. В свою очередь, механизм реакций является основой для установления кинетических закономерностей протекания реакций во времени в зависимости от параметров химического процесса.
Многие из химических реакций обратимы, т.е. в зависимости от условий идут в одну или обратную сторону и результаты их зависят от кинетики и направления реакций.
Среди реакций углеводородов к обратимым относят:
Рекомендуемые материалы
1. Образование простейших углеводородов из элементов и разложение углеводородов;
2. Гидрирование олефинов ↔ дегидрирование парафинов;
3. Гидрирование ароматики ↔ дегидрогенизация шестичленных нафтенов;
4. Конденсация ароматических углеводородов;
5. Изомеризация.
К необратимым реакциям относят: термический и каталитический крекинг, коксование, полимеризация.
Для обратимых реакций любому значению внешних условий (температура и давление) отвечает некоторое состояние равновесия системы, характеризующееся определенным соотношением количеств исходных веществ и продуктов реакции. Это состояние равновесия оценивается константой равновесия.
Химические реакции, протекающие в промышленных химико-технологических процессах, в том числе в процессах нефтепереработки, весьма разнообразны. Их классифицируют по следующим признакам:
• термодинамическим показателям обратимые и необратимые, эндо- и экзотермические;
• способу активации реагирующих веществ - термические, каталитические, фотохимические, радиационно-химические, биохимические, плазменно-химические, сонолитические (т.е. осуществляемые под воздействием ультразвука) и др.;
- фазовому состоянию реагирующих веществ – гомо- и гетерофазные;
- фазовому состоянию реакционной системы (т.е. с учетом реакционной поверхности в топохимических и каталитических процессах) гомогенные и гетерогенные;
- тепловому режиму реактора – изотермические и неизотермические;
- гидродинамическому режиму реакционного аппарата - на реакции, осуществляемые в реакторах следующих типов:
- идеального вытеснения (проточные и проточно-импульсные);
- идеального смешения (с псевдоожиженным слоем; проточно-циркуляционные с большой кратностью циркуляции; с мешалкой или барботажным перемешиванием);
• кинетическому признаку:
- простые, сложные (параллельные, последовательные, консекутивные);
- реакции, осуществляемые в кинетической и диффузионной областях реагирования;
• компонентному составу исходного сырья:
- реакции химических превращений индивидуальных химических веществ;
- реакции химических превращений многокомпонентных непрерывных смесей химических веществ (например, углеводородов нефтяного сырья).
-моно-, би- или тримолекулярные. Наиболее распространены моно- и бимолекулярные реакции.
Мономолекулярными или реакциями первого порядка называют реакции, в которых каждая молекула исходного сырья реагирует независимо от других. Число таких реакций немного, к ним относят, например, реакции изомеризации молекул, реакции распада в процессах крекинга. Скорость протекания мономолекулярных реакций не зависит от концентрации или давления. В бимолекулярных реакциях принимают участие две молекулы исходного вещества (одинаковые или разные), которые должны столкнуться. Скорость протекания бимолекулярных реакций в жидкой фазе зависит от разбавления; в паровой – от давления.
Сложность реакций. Принято подразделять реакции на простые и сложные либо по числу элементарных стадий (актов) химического превращения, либо по числу независимых реакций. Наиболее приемлемой и строгой следует считать классификацию реакций на сложность по числу независимых реакций. Так, к простым следует отнести реакции с числом независимых реакций, равным единице, а к сложным - реакции, число независимых реакций в которых более единицы. Простые реакции, протекающие в одну стадию, можно рассматривать как элементарные реакции. При такой классификации реакцию, например, дегидрирования циклогексана с образованием бензола можно считать простой, но не элементарной.
Для процесса получения водорода паровой конверсией метана можно написать следующие три реакции:
1.СН4 + Н2О = СО + ЗН2;
2. СО + Н2О = СО2 + Н2;
3. СН4 + 2Н2О = СО2 + 4Н2.
Однако третья реакция является комбинацией первой и второй. Следовательно, для кинетического описания (моделирования) этой сложной реакции достаточны любые две независимые реакции из трех. В целом сложную реакцию можно представить как совокупность простых реакций.
Концентрация и степень превращения. Пользуются различной мерой концентрации веществ: мольно-объемной, массово-объемной, мольной, массовой и объемной долями. Для сложных газофазных реакций, протекающих с изменением объема, наиболее удобной мерой концентрации является мольная доля и парциальное давление. Мольная доля вещества Аi (Сi) есть отношение числа молей Аi -го вещества к общему числу молей реакционной системы.
В случае идеальных газовых смесей реагирующих веществ величина мольной и объемной долей совпадает.
Парциальное давление Аi-го вещества (рi) связано с мольной долей и давлением системы (П) следующим образом:
Рi=ПСi.
Если химическая реакция протекает при атмосферном давлении, то величина мольной доли и парциального давления совпадает.
Понятие степени превращения в химической кинетике применяется для оценки полноты протекания реакции. Встречаются термины: полнота протекания реакции, степень расходования или образования веществ, глубина конверсии сырья, глубина процесса и т.д.
Применительно к сложным реакциям следует различать понятия степени превращения вещества в суммарной сложной реакции и степени превращения отдельных простых реакций.
В процессах нефтепереработки в химических превращениях нефтяного сырья участвует исключительно большое число углеводородов, которые к тому же не всегда могут быть идентифицированы. Разумеется, для таких процессов составить уравнения химических реакций и определить кинетические их параметры по всем индивидуальным простым реакциям практически невозможно.
В кинетических исследованиях процессов нефтепереработки часто за индивидуальное реагирующее вещество принимают отдельные нефтяные фракции, например, бензин, газ, кокс и т.д., или отдельные химические компоненты, например, парафиновые, нафтеновые, ароматические углеводороды бензинов и продуктов каталитического риформинга. Так, в процессах термолиза тяжелых нефтяных остатков в качестве индивидуальных веществ сырья и продуктов часто принимают масла, смолы, асфальтены, карбеиы и карбоиды.
К недостаткам такого метода следует отнести то, что обычно за непревращенное сырье принимают фракцию продукта реакции, идентичную исходному сырью по температурным пределам выкипания, что не совсем полностью соответствует действительности.
Скорость реакции - важнейшее понятие химической кинетики. Под скоростью реакции подразумевают скорость реагирования (расходования или образования Аi-го вещества в простой и сложной реакции.
Количественно скорость реагирования Ai-го вещества в сложной гомогенной и гетерогенной реакции выражается как количество вещества Аi, расходуемого или образующегося в результате химических взаимодействий в единицу времени в единице объема реактора (объема или поверхности катализатора или твердого вещества).
Применительно к сложным химическим реакциям, осуществляемым в проточных реакторах идеального вытеснения справедливо следующее уравнение скорости реакции: Wi = dxi/dτ , и для проточно-циркуляционного или аппарата с псевдоожиженным слоем: Wi = xi/τ.
Если входящую в уравнение скорости переменную τ рассматривать как продолжительность реагирования, то оно становится применимым для описания кинетических закономерностей реакций, осуществляемых в статических условиях или периодических реакторах.
Кинетическое уравнение связывает скорость реакции с параметрами, от которых она зависит. Наиболее важными из этих параметров являются температура, давление, концентрация и, в случае каталитических реакций, - активность катализатора:
Wi =f(Ci,T,P).
В основе кинетики сложных реакций лежит принцип независимости различных простых реакций, протекающих в одной системе. Из этого принципа следует, что кинетические параметры скоростей простых реакций не зависят от одновременного протекания других реакций. Исходя из этого принципа, для сложной реакции принято составлять систему уравнений скоростей для всех независимых простых реакций.
Для химической реакции, осуществляемой при постоянных температуре и давлении, ее скорость является функцией только концентрации реагирующих веществ.
Зависимость скорости элементарной реакции от концентрации реагирующих веществ выражает, как известно, закон действующих масс. В соответствии с этим законом, скорость химической реакции пропорциональна концентрациям реагирующих веществ в степенях, равных их стехиометрическим коэффициентам.
Для каталитических реакций константа скорости реакции при данной температуре является количественным критерием активности катализатора.
В большинстве случаев даже у сравнительно простых реакций показатели степеней в кинетических уравнениях не совпадают со значениями стехиометрических коэффициентов. Это обусловлено тем, что простая реакция является совокупностью элементарных стадий (актов), и стехиометрическое уравнение этой реакции составлено без учета истинного механизма ее протекания. В таких случаях экспериментально определяют численное значение показателя степени так называемого порядка реакции - по каждому реагирующему веществу. Помимо частного порядка в практике нередко оперируют понятием суммарного порядка реакции, определяемого часто как сумма частных порядков, Таким образом, порядок реакции является чисто эмпирической (экспериментальной) величиной в уравнении связывающим скорость неэлементарной реакции и концентрацию веществ.
Число молекул, одновременно вступающих в реакцию, называется молекулярностью реакции. Если стехиометрическое уравнение правильно отражает истинный механизм реакции, то порядок и молекулярность совпадают. В таких случаях реакция первого порядка является мономолекулярной, а второго порядка – бимолекулярной и т.д.
При изучении кинетики процессов часто применяют формальную кинетику, которая описывает процесс без глубокого изучения механизма реакций. Она базируется на формальном применении закона действующих масс для описания скорости не только элементарных, но и для сложных реакций. Тем не менее, формальные кинетические уравнения, благодаря простоте, находят широкое применение в инженерных расчетах и кинетических исследованиях,
Формальное кинетическое уравнение включает в левой части выражение скорости реакции в дифференциальном или алгебраическом виде в зависимости от типа реактора, а в правой части функцию зависимости скорости реакции от концентрации реагентов. Кинетические закономерности сложных реакций описываются, как правило, системой из дифференциальных или алгебраических уравнений для каждой из независимых реакций.
Полученные данные по кинетике термических деструктивных процессов таковы.
1. Способность алканов к распаду по середине цепи быстро возрастает по мере увеличения молекулярной массы углеводорода, и эта реакция (распад молекулы по середине цепи) преобладает при крекинге алканов.
2. Непредельные углеводороды устойчивее алканов. Превращение алкенов в алканы при этом возможно, но протекает, видимо, с малой скоростью.
3. Замещенные бензолы с длинными боковыми цепями легко подвергаются крекингу, отщепляя обломки боковых цепей в виде алкенов и алканов.
4. Дегидрирование цикланов с образованием ароматических углеводородов в условиях обычного крекинга (без катализатора, в отсутствие высокого парциального давления водорода и при высокой температуре) идет практически необратимо. Это значит, что в таких условиях гидрирование ароматических углеводородов выделяющимся при крекинге водородом невозможно.
5. За счет выделяющегося водорода возможно гидрирование образующихся при крекинге непредельных углеводородов.
6. Возможна конденсация ароматических углеводородов или друг с другом или с непредельными.
В табл. 4 приведены кинетические и графические зависимости концентраций С{ от времени для некоторых необратимых простых и сложных реакций, осуществляемых в реакторах интегрального тина.
Таблица 4 - Кинетические уравнения некоторых необратимых реакций, проводимых в реакторах интегрального типа
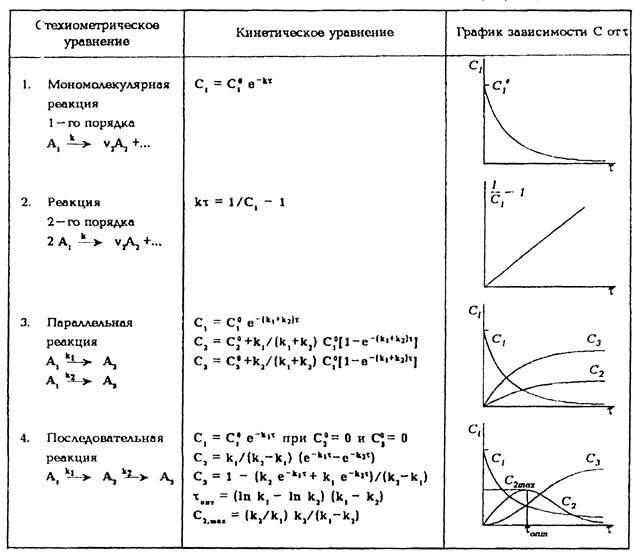
Кинетическое уравнение устанавливает зависимость скорости реакции от параметров, наиболее важные из которых: концентрация, температура, давление и активность катализатора (в случае каталитических реакций).
В основе кинетики сложных реакций лежит принцип независимости различных простых реакций, протекающих в одной системе. Из этого принципа следует, что кинетические параметры скоростей простых реакций не зависят от одновременного протекания других реакций. Исходя из этого принципа, для сложной реакции принято составлять систему уравнений скоростей для независимых простых реакций.
Для химической реакции, осуществляемой при постоянных температуре и давлении, ее скорость является функцией только концентрации реагирующих веществ.
В соответствии с законом действующих масс скорость химической реакции пропорциональна концентрациям реагирующих веществ в степенях, равных их стехиометрическим коэффициентам.
Для каталитических реакций величина константы скорости реакции при данной температуре является количественным критерием активности катализатора.
Если на какой-либо связи в молекуле сосредоточится энергия, равная или больше прочности связи, то эта связь разрывается. Распад связи, в принципе, может идти с переходом электронов двухэлектронной связи на орбитали разных атомов или одного из атомов. В первом случае (гомолитический распад) образуется два радикала или бирадикал.
"42 Платежная система First Virtual" - тут тоже много полезного для Вас.
Во втором случае (гетеролитический распад) образуется два разноименно заряженных иона.
Энергия активации таких реакций равна их тепловому эффекту. Затраты теплоты на распад углеводородной молекулы на ионы намного больше, чем энергия гомолитического разрыва связей.
Энергия активации термического разложения углеводородных молекул на ионы настолько велика, что такой распад в газовой фазе при обычных условиях не происходит.
Предэкспоненциальный множитель константы скорости реакции распада углеводородных молекул на радикалы в большинстве случаев составляет 1015—1017 с-1. В первом приближении предэкспоненты в значениях констант скорости распада углеводородной молекулы по различным связям одинаковы, следовательно, с наибольшей скоростью молекула распадается на радикалы по наименее прочной связи.
Продукты реакции могут участвовать в стадиях как продолжения, так и инициирования и обрыва цепей. В результате кинетика термического разложения исходного углеводорода может сильно изменяться с увеличением глубины реакции.
В зависимости от конкретного механизма реакции продукты ее могут ускорять стадии инициирования и обрыва цепей и вызывать новые реакции продолжения цепи. Поэтому с ростом глубины реакции могут и самоускоряться, и самотормозиться.






















