диссертация (1105558), страница 25
Текст из файла (страница 25)
После десорбции концентрата расторитель отгоняли на ротороном испарителе, остаток перерастворяли в 1 мл смеси ацетонитрила и воды (30/70 об.%), близкой по составу к подвижной фазе для хроматографического определения.
Установлено, что все НДА-производные гидразинов стабильны в ацетонитриле при комнатной температуре в течение суток.
Таблица 26. Извлечение НДА-гидразинов с сорбентов для твердофазной экстракции
(n = 3, P = 0,95)
| Картридж | Извлечение, % | ||
| Ги-НДА | ММГ-НДА | НДМГ-НДА | |
| Strata SDB-L | 94±7 | 99±10 | 98±5 |
| Strata-X | 102±5 | <35 | 98±6 |
| Diapak | 80±10 | <25 | 95±6 |
| Strata-C18 | 76±9 | <10 | 101±7 |
Сочетание сорбционного концентрирования с ВЭЖХ разделением позволило добиться высокой чувствительности определения замещенных гидразинов на уровне нескольких нг/л. Метрологические характеристики подхода представлены в таблице 27.
Стоит отметить, что одновременное on-line сорбционно-хроматографическое определение гидразинов в данном случае невозможно из-за сильных различий в структурах производных и, как следствие, в природе и механизмах их удерживания в фазе сорбента. Установлено, что для количественной десорбции НДМГ-НДА необходимо большое количество органического растворителя – ацетонитрила – в подвижной фазе. Соблюдение этих условий делает невозможным разделение и детектирование в концентрате слабоудерживаемых протонированных производных гидразина и ММГ. К тому же, on-line концентрирование не позволяет повысить чувствительность определения НДМГ из-за регистрации на хроматограмме большого количества пиков посторонних компонентов, затрудняющих при λпогл.=290 нм детектирование следовых количеств НДА-производного диметигидразина, и в этом случае велика вероятность ошибочной интерпретации пика на хроматограмме.
Таблица 27. Метрологические характеристики сорбционно-хроматографического определения гидразинов с НДА Вид градуировочной зависимости y=ax
| Определяемый компонент | Диапазон линейности, нг/л | a | r | Cmin, нг/л | sr |
| Гидразин | 2-100 | 25±3 | 0.9997 | 2 | 0.04 |
| ММГ | 2-100 | 46±3 | 0.9993 | 2 | 0.06 |
| НДМГ | 50-1000 | 56±4 | 0.9995 | 50 | 0.07 |
4.5.4. Анализ реальных объектов
Для проверки правильности разработанного подхода провели анализ объектов окружающей среды и синтетических образцов, полученных путем введения добавок гидразинов в природную воду или почву.
Реакционное ВЭЖХ определение гидразинов. Определение гидразинов с помощью 2,3-нафталиндиальдегида даже без концентрирования позволяет достичь более низких пределов обнаружения по сравнению с прямым определением методом ионной хроматографии (табл. 25). К тому же, реагент НДА демонстрирует уникальную селективность к гидразинам, что снижает вероятность ошибочной интерпретации хроматографического пика определяемого компонента на фоне сложного состава матрицы природных объектов по сравнению с той же ионной хроматографией. Поэтому такой способ наиболее чувствителен из всех существующих, а также экспрессен и прост в исполнении.
В связи с этим разработанный нами подход нашел применение для контроля содержания гидразина в воде водоемов, расположенных вблизи мест выбросов атомных электростанций и других предприятий, использующих гидразин для антикоррозионной обработки оборудования. Санитарно-гигиенические требования в отношении этого токсиканта строги и не допускают его содержания свыше 0.3 мкг/л в водоемах рыбо-хозяйственного назначения.
Разработанный нами подход недавно внедрен на Кольской АЭС для контроля содержания гидразина в воде озера Имандра. Хроматограммы одного из образцов озерной воды и этой же пробы с добавкой гидразина представлены на рис. 62, 63. По результатам анализа, концентрация гидразина в озерной воде составляет менее 0.1 мкг/л, что отвечает требованиям по контролю качества вод рыбо-хозяйственного назначения.

Ги-НДА
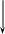
Рис. 62. Хроматограмма пробы воды озера Имандра, после дериватизации с НДА. Колонка Zorbax Eclipse XBD-C8, 4.6×150 мм. Условия градиентного элюирования описаны в «Технике эксперимента». Флуориметрическое детектирование.

Ги-НДА
Рис. 63. Хроматограмма пробы воды озера Имандра, с добавкой 0.5 мкг/л гидразина, после дериватизации с НДА. Колонка Zorbax Eclipse XBD-C8, 4.6×150 мм. Условия градиентного элюирования описаны в «Технике эксперимента». Флуориметрическое детектирование.
Разработанный подход также использовали для анализа отгонов почв Загорского полигона, загрязненного диметилгидразином в 2005 году. Результаты ВЭЖХ-определения НДМГ в виде НДА-производного сравнили с данными независимого метода – ионной хроматографии с амперометрическим детектированием. Условия ионохроматографического определения приведены в разделе «Техника эксперимента». Полученные данные хорошо согласуются с результатами независимого метода определения и представлены в таблице 28.
Таблица 28. Результаты проверки подхода независимым методом – ионной хроматографией с амперометрическим детектированием (n = 5, P = 0.95)
| Ионная хроматография, мкг/л | Реакционная ВЭЖХ, мкг/л | |
| Почва № 93 | 60 ± 5 | 61 ± 5 |
| Почва № 100ЭУ 1-30-1 | 18 ± 4 | 15 ± 2 |
Другие примеры проверки правильности подхода приведены в таблице 29 для речной, озерной воды, воды из скважин.
Таблица 29. Результаты проверки методом «введено-найдено» (n = 3, P = 0.95)
| Введено, мкг/л | Найдено, мкг/л | Проба | |
| Гидразин | 0.5 1.0 20 200 | 0.46 ± 0.08 0.9 ± 0.2 20 ± 4 210 ± 30 | Озерная вода Вода из скважины Вода из скважины Речная вода |
| ММГ | 0.5 1.0 20 200 | 0.53 ± 0.09 1.1 ± 0.3 18 ± 4 190 ± 30 | Озерная вода Вода из скважины Вода из скважины Речная вода |
| НДМГ | 5.0 25 200 5000 | 4.8 ± 0.5 26 ± 3 210 ± 30 4900 ± 200 | Вода из скважины Скважина, село Верхнее Валуево Вода из скважины Озерная вода |
Реакционное сорбционно-хроматографическое определение гидразинов. Сочетание сорбционного концентрирования с ВЭЖХ разделением позволяет определять гидразины на уровне нескольких нг/л в модельных растворах. Для проверки применимости разработанного подхода к анализу объектов окружающей среды провели ряд анализов синтетических образцов природной воды с добавкой следовых количеств гидразинов.
Результаты проверки правильности реакционного сорбционно-хроматографического способа определения гидразинов, представленные в таблице 30, свидетельствуют о применимости такого подхода к анализу объектов окружающей среды. Хроматограмма образца воды из скважины с добавкой гидразинов представлена на рис. 64.
Таблица 30. Результаты анализа природных объектов с добавкой гидразинов
(n = 5, P = 0.95)
| Введено, нг/л | Найдено, нг/л | Проба | |
| Гидразин | 20 50 | 18 ± 4 46 ± 6 | Вода из скважины Речная вода |
| ММГ | 20 50 | 21 ± 4 53 ± 7 | Вода из скважины Речная вода |
| НДМГ | 200 60 20 нг | 180 ± 30 62 ± 7 19 ± 2 нг | Вода из скважины Речная вода Почвенный отгон |

Рис. 64. Сорбционно-хроматографическое определение гидразинов в образце природной воды с добавкой 20 нг/л Ги, 20нг/л ММГ, 200 нг/л НДМГ. Колонка Zorbax Eclipse XBD-C8, 4.6×150 мм. Условия градиентного элюирования описаны в «Технике эксперимента». Спектрофотометрическое (ДМД) и флуориметрическое (ФЛД) детектирование.
Также проведен сорбционно-хроматографический анализ почвенного отгона с добавкой 20 нг НДМГ (рис. 65). Пробоподготовка почвы при этом должна включать стадию щелочной дистилляции, описанную в разделе «Техника эксперимента», для получения почвенного отгона и дальнейшей его дериватизации.

Рис. 65. Хроматограмма почвенного отгона с добавкой 20 нг НДМГ после щелочной дистилляции, дериватизации с НДА и сорбционного концентрировния. Колонка Zorbax Eclipse XBD-C8. Спектрофотометрическое детектирование. Условия градиентного элюирования описаны в «Технике эксперимента».
* * *
Таким образом, показано, что 2,3-нафталиндиальдегид является эффективным и модификатором для экспрессного и высокочувствительного хроматографического определения гидразинов. Он реагирует с гидразинами при комнатной температуре быстро и селективно, поэтому обладает преимуществами по сравнению с другими дериватизующими реагентами. Разработанный подход прост в исполнении, экспрессен, селективен и очень чувствителен: позволяет детектировать следовые количества гидразинов в объектах окружающей среды. Предложенный способ делает возможным контроль качества вод хозяйственно-бытового назначения по содержанию НДМГ на новом установленном ориентировочно-допустимом уровне 0,06 мкг/л. Достигнутые пределы обнаружения являются на данный момент самыми низкими среди известных методик определения гидразинов.
4.6. Дансил хлорид как модификатор для определения гидразинов методом ВЭЖХ
4.6.1. Выбор условий образования производных гидразинов
Литературных данных по дериватизации гидразинов дансил хлоридом практически нет. Известно только, что он образует флуоресцирующий продукт с НДМГ [ ].
Дериватизация аминосоединений с дансил хлоридом протекает при высоких рН (около 9), и главным требованием для протекания реакции является существование амоносоединения в нейтральной форме. Для реакции с гидразинами фоновый раствор должен иметь рН в интервале 7 – 9.5, так как при дальнейшем повышении щёлочности среды растёт вероятность протекания конкурирующей образованию производных реакции – гидролиза органического реагента. В ходе работы были зарегистрированы флуоресцирующие продукты для гидразина, ММГ и НДМГ и установлено, что образующиеся в щелочной среде производные интенсивно излучают в области 500 нм. Оптимальными условиями детектирования производных являются длины волн λвозб.= 360 нм, λэм..= 500 нм, согласно спектрам, приведенным на рис. 66. Максимальная интенсивность флуоресценции наблюдается при проведении реакции при рН 9.5.
Интенсивность излучения дансильных производных так же как и в случае диальдегидов зависит от рН среды. Для продукта реакции с монометилгидразином эта зависимость выражена слабо (рис. 68), в то время как интенсивность флуоресценции дансильных производных гидразина и 1,1-диметилгидразина (рис. 67 – 69) уменьшается при понижении рН раствора.

б
















