Методы достижения низких температур
2. Методы достижения низких температур
2.1. ПРОЦЕССЫ, СОПРОВОЖДАЮЩИЕСЯ ПОНИЖЕНИЕМ
ТЕМПЕРАТУРЫ В АДИАБАТНЫХ УСЛОВИЯХ
Для непрерывного искусственного охлаждения реализуют разнообразные циклы криогенных установок. Любой цикл включает несколько процессов и, по крайней мере, один из них должен сопровождаться эффектом понижения температуры в адиабатных условиях или поглощения теплоты в изотермических условиях . Кроме этого, для организации циклов необходимы другие процессы: сжатия газов и паров; охлаждения сжатого рабочего тела и передачи теплоты сжатия в окружающую среду или какому-либо приемнику теплоты; передачи теплоты от охлаждаемого тела к рабочему телу в цикл; процессы конденсации, рекуперации холода и др. В результате процессов рекуперативного (или регенеративного) теплообмена обеспечивается достижение заданной низкой температуры.
Для любого цикла криогенной установки, непрерывно вырабатывающей холод, является принципиальным наличие в цикле процесса или совокупности процессов, обеспечивающих получение холода. Такие процессы назовем холодопроизводящими. Для низкотемпературных циклов с потоком рабочего тела холодопроизводящими процессами являются процессы внешнего взаимодействия (или энергетического разделения), в результате которых энтальпия потока рабочего тела (или его части) уменьшается. Без холодопроизводящих процессов невозможно осуществить непрерывное получение холода. Для одноразового охлаждения достаточно использование любых процессов (эффектов), сопровождающихся необходимым понижением температуры и реализуемых с запасами рабочих веществ .
Важно отметить, что процессы, сопровождающиеся понижением температуры, могут не быть холодопроизводящими процессами в циклах установок. Уменьшение энтальпии потока рабочего тела в цикле обеспечивают созданием условий для совершения потоком работы и передачи ее во внешнюю среду либо условий для передачи теплоты (в общем случае, энергии) от потока или его части внешним телам. При этом часть энергии рабочего тела передается в окружающую среду и его энтальпия (или энтальпия его части) уменьшается. К таким процессам относятся: процессы сжатия с одновременным или последующим охлаждением рабочего тела (в определенной области параметров состояния); процессы расширения газов с совершением внешней работы; волновые процессы расширения; процессы охлаждения дополнительными внешними источниками холода; процессы откачки паров; динамические процессы температурного расслоения, при которых происходит энергетическое разделение потока, и др. Именно эти процессы являются холодопроизводящими и обеспечивают генерацию холода в циклах. Холодопроизводительность цикла равна суммарному изменению энтальпии во всех холодопроизводящих процессах.
Ответственность холодопроизводящих процессов за генерацию холода не умаляет значения других процессов цикла, в частности, сопровождающихся в адиабатных условиях эффектом понижения температуры. Без них организация цикла также невозможна. Многие из этих процессов являются одновременно и холодопроизводящими, другие (например, процессы дросселирования, растворения), не являясь холодопроизводящими, обеспечивают необходимое изменение температуры рабочего тела.
2.2. ИЗМЕНЕНИЕ ОСНОВНЫХ ТЕРМОДИНАМИЧЕСКИХ ВЕЛИЧИН ПРИ СЖАТИИ РЕАЛЬНОГО ГАЗА
Сжатие газа — необходимый и важнейший процесс холодильного цикла при использовании газообразных рабочих тел. Процессы сжатия реализуются в компрессорных машинах и могут протекать по-разному в машинах различных типов, характеризоваться разной степенью необратимости. Газ можно охлаждать одновременно со сжатием или сразу после компрессора в концевых холодильниках.
Принципиально важно сравнить состояния сжатого и несжатого газа при одинаковой температуре (рис.2.1.).
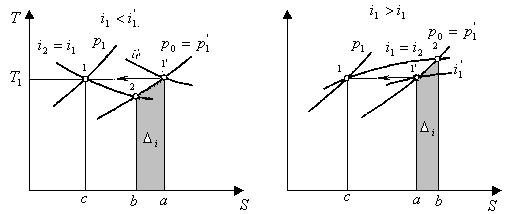 |
Рис. 2.1. Сравнение энтальпий сжатого i1, и несжатого i1' реального газа при одинаковой температуре
Внутренняя энергия и энтальпия идеального газа не зависят от давления и при одинаковой температуре в состояниях 1' и 1 одинаковы . Внутренняя энергия реального газа в сжатом состоянии при одинаковой температуре всегда меньше. Физически это объясняется тем, что при сближении молекул потенциальная составляющая внутренней энергии уменьшается.
Рекомендуемые материалы
Если внутренняя энергия реального газа при изотермическом сжатии всегда уменьшается, то характер изменения энтальпии в разных областях состояний не одинаков:
i1 — i1' = ( u1 — u1' ) + p1v1 (1 - z1' / z1) (2.1)
Разность u1 — u1' в выражении (2.1) всегда отрицательна, а знак второго слагаемого определяется значениями коэффициентов сжимаемости z. В области состояний, где
z1 £ z1' , энтальпия газа, как и внутренняя энергия, уменьшается при изотермическом сжатии. В области состояний, где z1 > z1' , второе слагаемое в выражении (2.1) положительно и знак Di определяется соотношением абсолютных значений слагаемых, т. е. в этой области состояний энтальпия реального газа при изотермическом сжатии может и увеличиваться, и уменьшаться.
Если энтальпия сжатого газа уменьшается , то: Di = i1 – i1' равна площади 1'ab2; теплота изотермического сжатия q сж — площади 1'ас1, работа изотермического сжатия в открытой системе l cж.о - площади 1'2ac1; q сж > l cж. o.
Если энтальпия сжатого газа увеличивается , то Di = i1 – i1' равна площади 1'2ba;
qсж — площади 1'ас1; l cж. о — площади 1'2bc1; qсж < l cж. о.
Это позволяет считать, что в области состояний, где энтальпия уменьшается при изотермическом сжатии, компрессор в совокупности со своей системой охлаждения обеспечивает создание холодопроизводительности в цикле, которая может быть реализована при простом адиабатном расширении газа без совершения внешней работы (например, при дросселировании). В этом случае холодопроизводительность равна разности энтальпий в состояниях 1' и 1.
2.3. ДРОССЕЛИРОВАНИЕ
Адиабатное расширение газа в открытой системе в условиях стационарного течения без совершения внешней работы и приращения скорости на контрольной поверхности называется дросселированием. Следует подчеркнуть, что стационарность течения предполагает в первую очередь постоянство давлений до и после дросселирования, а условие отсутствия приращения скорости течения на контрольной поверхности не исключает возможности ее местного увеличения (или уменьшения) внутри системы, например, в самом дроссельном устройстве.
Для практического осуществления этого процесса на пути газа устанавливают какое-либо гидравлическое сопротивление: дроссельный вентиль, заслонку, калиброванное отверстие и пр.
Дж. Джоуль и У. Томсон исследовали этот процесс следующим образом . По медной трубке медленно протекал установившийся поток газа (начальная температура T1), проходя через пробку, защищенную экранами. В опытах фиксировали изменения температуры при изменении перепада давлений Dр = p1 — р2.
Рассмотрим элементарный объем медленно текущего потока газа в двух сечениях, расположенных по обе стороны от пробки и достаточно удаленных от нее, где движение можно считать стационарным. Если скорости газа в рассматриваемых сечениях одинаковы, то для процесса дросселирования при l = 0 и q = 0 получим
i2=i1=const или u1 + p1v1= u2+ p2v2 = const. (2.2)
Так как никаких предположений о свойствах газов не делали, то полученный результат справедлив как для идеального, так и для реального газа: при дросселировании энтальпия газа не изменяется. Для идеального газа изменение внутренней энергии и энтальпии в любом процессе определяется выражениями du = cv dT и di = cp dT , откуда следует: если di = 0, то dT и du также равны нулю.
Для реального газа из уравнения (2.2) не следует постоянство температуры и внутренней энергии при дросселировании. При расширении реального газа увеличиваются расстояния между молекулами и совершается работа против молекулярных сил притяжения. Кроме того, в потоке реального газа работа гидродинамических сил каждой единицы массы на входе и выходе из контрольной системы, равная произведению pv, различна из-за разной сжимаемости. Эти работы предопределяют изменение внутренней энергии и температуры, поэтому в общем случае для реального газа при дросселировании
di = 0 (i = const); dT ¹о; du ¹о . (2.3)
Таким образом, температура реального газа при дросселировании может как понижаться, так и повышаться.
Процесс дросселирования необратим. Для идеального газа он необратим полностью, так как не сопровождается эффектами, которые могли бы способствовать возвращению в исходное состояние. Приращение энтропии максимально и равно убыли энтропии при изотермическом сжатии идеального газа. Процесс дросселирования реального газа частично обратим, так как сопровождается изменением температуры; при этом создается «тепловой резервуар» с температурой более высокой или более низкой и существует возможность использования перепада температур для получения работы (эту работу можно использовать для частичного возвращения газа в исходное состояние). Приращение энтропии при дросселировании реального газа не равно изменению энтропии при его изотермическом сжатии.
Определим изменение температуры реального газа при дросселировании
(¶Т /¶ р)i = ai = (1/Ср) [Т (¶v/¶Т)р - v] (2.4)
Величина (¶Т/¶р)i = ai — дифференциальный эффект Джоуля—Томсона, определяющий изменение температуры при бесконечно малом падении давления в процессе дросселирования.
Практически при дросселировании всегда имеется конечная разность давлений, поэтому для такого процесса


 (2.5)
(2.5)


Это выражение определяет так называемый интегральный эффект Джоуля—Томсона (изменение температуры при конечной разности давлений). Интегральный эффект дросселирования определяют обычно по таблицам или диаграммам (рис. 2.2).
 Рис.2.2. Процесс дросселирования в диаграмме Т—s
Рис.2.2. Процесс дросселирования в диаграмме Т—s
Знак эффекта дросселирования может быть различным.
Если DТ/Dp = (T2 — T1)/(p2 — p1) > 0, то Т2 < T1 (охлаждение), поскольку всегда p2<p1;
если DТ/Dр < 0, то Т2 > T1, что соответствует нагреванию.
Изменение знака дроссельного эффекта называют инверсией. В точке инверсии (¶T/¶p)i=0. Кривая, на которой (¶T/¶p)i=0 ,называется кривой инверсии.
Кривая инверсии разграничивает области положительного (охлаждение) и отрицательного (нагревание) дроссель-эффекта.
На рис. 2.3. приведены кривые инверсии для некоторых газов. Область под кривой инверсии соответствует положительному дроссельному эффекту.
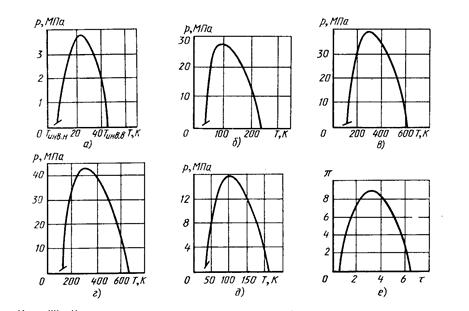
Рис. 2.3. Кривые инверсии для некоторых газов
а - гелия; б - неона; в - азота; г - воздуха; д - водорода; е - газа ван дер Ваальса
(в приведенных координатах)
Для каждого вещества существует максимальная температура инверсии Тинв.в, выше которой при любых давлениях дроссель-эффект отрицателен. Эта температура называется верхней температурой инверсии. Существует и так называемая нижняя температура инверсии Тинв.н в области жидкости.
В координатах Т — s кривая инверсии проходит через экстремальные значения изоэнтальпии (i = const) и асимптотически приближается к Тинв.в. как к температуре инверсии малых давлений. Температуры инверсии для разных газов различны.
Для некоторых газов (воздух, азот, кислород) верхняя температура инверсии выше средней температуры окружающей среды, для других (гелий, неон, водород) - ниже. Для охлаждения газа при дросселировании необходимо, прежде всего, понизить его температуру до значения ниже верхней температуры инверсии Тинв.в Если это условие выполнено, то возникает вопрос: до какого давления p1 следует сжать газ, чтобы достичь максимального интегрального эффекта DT при известной начальной температуре T0 (где То — обычно температура окружающей среды или температура предварительного охлаждения). Продифференцировав выражение для интегрального дроссель-эффекта по
р и приравняв нулю полученное выражение, найдем
(¶Т / ¶р)i. = 0. (2.6)
Это выражение является условием того, что искомая точка находится на кривой инверсии, а искомое давление равно давлению инверсии при данной температуре. Однако, в циклах с дросселированием практически (экономически) целесообразное давление сжатия может быть меньше давлений точки инверсии, например, в случае сжатия воздуха (при Т = 300 К ограничиваются давлением p » 20 МПа вместо 39 МПа). В гелиевых и водородных циклах с дросселированием оптимальные давления сжатия близки к давлениям инверсии.
При небольших давлениях значение ai, для данного газа зависит практически только от температуры. В области газообразных состояний при снижении температуры дифференциальный эффект дросселирования возрастает.
При увеличении плотности газа ai начинает зависеть от давления. Экспериментально установлено, что ai уменьшается при увеличении давления, а зависимость ai от р близка к линейной. Влияние давления на ai практически может сказываться только при сравнительно высоких давлениях .
Из изложенного ясно, что для увеличения интегрального эффекта начальную температуру процесса дросселирования следует понижать. Однако, надо четко понимать, что в низкотемпературных циклах с дросселированием холодопроизводительность теоретического цикла без потерь холода не зависит от температуры начала дросселирования (процесс дросселирования в цикле не является холодопроизводящим). Увеличение интегрального эффекта дросселирования при снижении температуры открывает лишь принципиальную возможность увеличения холодопроизводительности. Практически для этого необходимо так называемое предварительное охлаждение. Роль предварительного охлаждения сводится к созданию теплового резервуара с температурой Т'о, более низкой, чем температура окружающей среды T0. При этом в области положительного дроссель-эффекта увеличивается разность энтальпии сжатого и несжатого газов при одинаковой температуре, что и обусловливает увеличение холодопроизводительности в цикле. Эту разность энтальпии, часто используемую при инженерных расчетах, обозначают в общем случае DiT и называют изотермическим эффектом дросселирования. Значение DiT находят по таблицам или тепловым диаграммам как разность энтальпий сжатого и несжатого газов при данной температуре.
Термины «тепловой» или «изотермический эффект дросселирования» можно объяснить следующим образом. Если сравнить два состояния, соответствующие точкам 1 и 2 , то разность энтальпии i1' – i2, определяет количество теплоты, которую можно отнять у тела, находящегося при температуре окружающей среды, используя эффект снижения температуры при дросселировании. С другой стороны, DiT равна изменению энтальпии при изотермическом сжатии или расширении газа. Для того, чтобы в условиях стационарного течения расширить газ без совершения внешней работы и изменения температуры, т. е. изотермически, необходимо было бы подвести количество теплоты, равное DiT0. При положительном дроссель эффекте DiT определяет вклад компрессора в холодо-производительность цикла.
2.4. ПРОЦЕСС U = CONST
Если процесс расширения газа осуществить при тех же условиях, что и процесс дросселирования (без теплообмена с окружающими телами и без совершения внешней работы ), но в отличие от дросселирования расширять газ в закрытой системе, т. е. не в условиях стационарного течения, а в устройстве с жесткими стенками, то полная внутренняя энергия газа в такой системе будет постоянна. Это процесс расширения u= const; какого-либо характерного названия он не имеет. Схема реализации процесса u = const воспроизводит схему опыта Джоуля—Гей-Люссака (рис. 2.4).
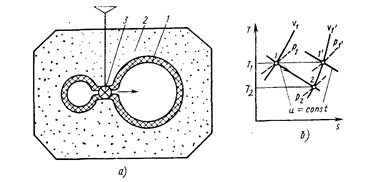
Рис.2.4. Схема реализации процесса u = const (а) и его изображение в диаграмме T—S (б)
Исследуемая система 1 состоит из двух сосудов с жесткими стенками. Сосуды контактируют один с другим и изолированы от окружающей среды слоем изоляции 2. Начальные давления газа в сосудах различные, а температуры газа одинаковые; начальное стационарное состояние с температурой T1. При помощи вентиля 3 можно выравнивать давления газа в сосудах. При выпуске газа из одного сосуда давление и температура в нем снижаются; в это время в другом сосуде при втекании в него газа давление и температура повышаются. После выравнивания давлений в течение некоторого времени происходит выравнивание температур газа, пока система не придет в стационарное состояние с температурой Т2. Изменение температуры газа в процессе u = const можно определить из уравнения
au = ( ¶T/ ¶p )u=- (¶u / ¶р)T / ( ¶u / ¶T )p (2.7)
Для идеального газа ( ¶u / ¶v )T= (¶u / ¶р)T = 0, поэтому и dT = 0 в процессе u = const. Этот результат, установленный в опытах Джоуля—Гей-Люссака при расширении газов в области малых давлений еще в 1807 г., явился доказательством фундаментального положения о том, что внутренняя энергия идеального газа есть функция только температуры и не зависит от давления (плотности).
Однако, если этот опыт провести при расширении сильно сжатых газов, то температура не будет постоянной, а снизится: T2 < T1. Таким образом, в процессе u = const для любого реального газа au — всегда положительная величина, т. е. температура снижается.
Процесс u = const не имеет столь большого практического значения, как процесс дросселирования i = const, однако, приведенные соображения позволяют глубже понять сущность процессов внешне адиабатного расширения газа без совершения внешней работы в условиях открытых и закрытых систем.
2.5. РАВНОВЕСНОЕ АДИАБАТНОЕ РАСШИРЕНИЕ ГАЗА
Процесс расширения газа в адиабатных условиях, т. е. при отсутствии внешнего теплообмена, может протекать без изменения энтропии только при отсутствии, каких бы то ни было внутренних процессов трения. В связи с этим для удовлетворения условия
s = const необходимо всю энергию сжатого газа преобразовать во внешнюю работу без потерь. Очевидно, что при этом уменьшение внутренней энергии газа максимально (по сравнению с другими процессами расширения при одинаковых начальных параметрах и степени расширения); поэтому такой процесс сопровождается наибольшим снижением температуры. Работа, совершаемая газом в этом процессе, должна быть обязательно полностью передана изолированному от газа устройству. Работа, совершаемая газом, и тождественно равные ей тепловые эффекты для закрытой и открытой систем в процессе s = const, различаются :
lз = qз = u1 –u2s ; (2.8)
lo =qo = i1 – i2s . (2.9)
Последнее выражение справедливо при одинаковых скоростях газового потока на входе и выходе. Так как реальные процессы течения и расширения газа не могут происходить без трения, то в адиабатных условиях процесс s = const в действительности осуществить невозможно. Его рассматривают как идеальное приближение для реальных процессов, поэтому его анализ имеет существенное значение.
Изменение температуры в изоэнтропном процессе в открытой и закрытой системах одинаковое и определяется выражением
as=(¶T/¶P)s=(T/cp)(¶v/¶T)P (2.10)
После ряда преобразований получим
as = ai + v/cp (2.11)
Из полученных соотношений можно установить следующее.
1. Значения as положительны практически в любой области состояний рабочего тела, физически допускающих расширение.
2. С повышением температуры as возрастает; при этом соответственно увеличивается и работа расширения.
3. С увеличением давления, т. е. уменьшением удельных объемов и увеличением плотности рабочего тела, as уменьшается. Таким образом, в процессе расширения
s = const as — переменная величина.
4. Вблизи критических состояний и в области состояний кипящей жидкости значения as и ai наиболее близки. Соотношение между as и ai зависят от параметров и рода газов и их смесей . Например, для метана в области температур около 293К и давлений около 6 МПа отношение ai/ as » 1,2/2,3 = 0,5215; для воздуха в области этих же температур и давлений ai/as = 0,22/1,2 = 0,1835. Чем больше отношение ai/ as , тем, в общем случае, менее выгодно применение детандеров.
Значение as для реального газа может быть больше и меньше, чем для идеального, в зависимости от знака ai.
Охлаждение реальных газов при адиабатном расширении в машине можно выразить суммой двух эффектов, обусловленных действием межмолекулярных сил aм и внешней работой aрdv:
as = aм +a pdv . (2.12)
Доля эффекта охлаждения за счет внутренних сил aм по сравнению с общим эффектом охлаждения as зависит от давления и температуры. При р® 0 отношение aм/as ® 0, следовательно, внутренние силы не производят действия, так как молекулы удалены одна от другой. На рис. 2.5 приведены зависимости отношения aм/as от давления для воздуха при разных температурах.
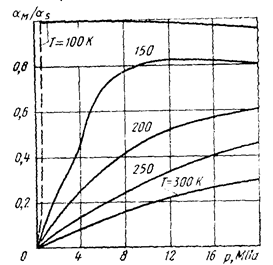
Рис. 2.5. Зависимость отношения aм/as от давления и температуры для воздуха
На практике процессы расширения газов с совершением внешней работы осуществляют в различных расширительных машинах, которые называют также детандерами. В детандерах энергия сжатого газа преобразуется в работу и процесс в той или иной мере приближается к изоэнтропному. Работа передается или на тормозное устройство, или какой-либо внешней среде, которую обязательно изолируют от расширяющегося газа. Существует много конструктивных разновидностей детандерных машин, однако их можно подразделить на класс объемных и класс лопаточных (газодинамических) машин. Рабочие процессы в машинах этих двух классов существенно различаются. Поясним лишь основные принципы, не затрагивая анализ рабочих процессов.
Адиабатное расширение газа с совершением внешней работы в объемных машинах. В объемных машинах энергия газа преобразуется в работу непосредственно за счет сил давления газа. Наиболее характерный пример — поршневой детандер. Силы давления газа действуют на поршень, и энергия газа через механизм движения передается на тормозное устройство. Силы давления газа с точностью до бесконечно малой величины уравновешены силами сопротивления тормоза, и теоретически процесс расширения является равновесным. Работа детандера носит циклический характер. В течение каждого цикла повторяется определенная совокупность процессов в рабочем объеме машины, т. е. в пространстве между стенками цилиндра и поршнем. Эта последовательность включает процессы: впуска , наполнения, внутреннего расширения , выхлопа, выталкивания и обратного сжатия. Газ поступает в машину через клапан впуска и выходит через клапан выпуска. Участок хода поршня, на котором клапан впуска открыт, часто называют отсечкой наполнения .
«Мертвый» объем (объем рабочего пространства при крайнем нижнем положении поршня) всегда реально существует, а для некоторых типов машин является необходимым, например, для бесклапанного детандера. Известны разнообразные типы детандеров с различными теоретическими индикаторными диаграммами.
Для детандеров классического типа с клапанами впуска и выпуска адиабатный КПД hs = 0,7 ... 0.9.
Адиабатное расширение газа с совершением внешней работы в лопаточных машинах (турбодетандерах). В поршневом детандере энергия газа преобразуется в работу за счет действия на поршень сил давления газа. Очевидно, что такую же по величине внешнюю работу газ может совершить, если энергию сжатого газа преобразовать в энергию потока и использовать последнюю для получения работы. Конечно, при этом подразумевают, что степень расширения и начальные параметры газа одинаковые. Рабочий процесс в турбодетандере принципиально отличается от рабочего процесса в поршневом детандере, однако, все интегральные соотношения энергетического баланса полностью справедливы при условии равенства скоростей газа на входе и выходе из машины.
Необходимо отметить, что преобразование энергии сжатого газа в энергию потока и последующее ее использование для получения внешней работы можно реализовать различными путями. Например, можно сначала полностью расширить газ в неподвижном сопловом аппарате, а затем направить движущийся с большой скоростью поток газа на лопатки турбины и заставить вращаться лопаточный диск. В этом случае принято называть турбодетандер активным. Можно полностью расширить газ непосредственно в межлопаточном пространстве колеса без какого-либо предварительного расширения в сопловом аппарате. В этом случае турбодетандер называют реактивным.
Однако, экономически наиболее выгодно сочетание этих двух путей.
Практически так и поступают . Газ при давлении p1 подают в сопловой направляющий аппарат, где он расширяется до промежуточного давления p' и затем с большой скоростью поступает в межлопаточные каналы турбины, где происходит его дальнейшее расширение до давления p2. Направление движения газа в сопловом аппарате и колесе турбодетандера может быть радиальным, осевым или радиально-осевым.
Эффективность работы турбодетандеров, как и поршневых детандеров, оценивают изоэнтропным КПД hs. Для большей части турбодетандеров hs = 0,65 ... 0,85.
2.6. ВЫХЛОП ИЛИ СВОБОДНЫЙ ВЫПУСК ГАЗА ИЗ БАЛЛОНА.
ПРОЦЕСС ВПУСКА
Рассмотрим процесс внешне адиабатного расширения газа при выпуске его из какой-либо емкости (баллона, цилиндра и пр.). Такой процесс часто называют выхлопом или свободным выпуском газа. Этот процесс — один из самых распространенных. Особенно часто его используют в низкотемпературных машинах как один из рабочих процессов циклов этих машин. Схема организации процесса выхлопа весьма проста. Баллон со сжатым газом имеет выпускной клапан, после открытия которого газ быстро вытекает из баллона и направляется в трубопровод .
Процесс выхлопа является нестационарным и неравновесным адиабатным процессом расширения газа с совершением внешней работы. Теплообмен газа со стенками исключен по условию, и неравновесность обусловлена тем, что при изменении объема силы давления газа на контрольной поверхности системы не уравновешены силами противодавления. Начальные параметры газа в баллоне Тн и pH. Баллон герметично закрыт клапаном-задвижкой. После освобождения задвижка начинает двигаться без трения в выпускной трубе. Газ оказывает на задвижку давление, которое постепенно падает. С другой стороны, на задвижку действует постоянная сила противодавления, так как газ вытекает в область постоянного давления pk . Когда давление в баллоне достигнет рk , задвижка остановится. Через некоторое время после окончания процесса в результате диффузии и смешения во всех частях системы установится равновесная температура Tk , которую можно определить из выражения
TH / Tk = k / [ 1+ (pk /pH) (k – 1)]. (2.13)
Снижение температуры газа при одинаковых TH , pH , pk в неравновесном адиабатном процессе меньше, чем в изоэнтропном процессе. Следует обратить внимание на то, что при DP= (pH - pk ) ® dp соблюдаются условия квазиравновесия. В этом случае дифференциальные эффекты процесса выхлопа aB и изоэнтропного процесса практически одинаковы:
aB = (dT / dp)B = aSH = const. ( 2.14 )
Исходя из уравнение (2.14), нетрудно построить линии aB = aSH = const для процессов выхлопа в координатах Т — s при заданных TH и pH (рис. 2.6.).
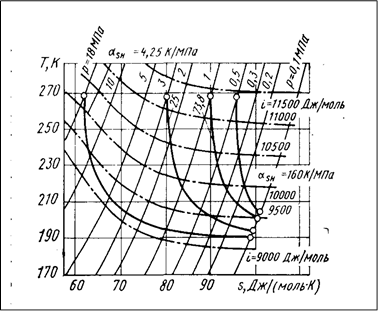
Рис. 2.6. Линии процесса выхлопа в диаграмме T-s для воздуха
Из рисунка видно, в частности, что при использовании процесса выхлопа в качестве холодопроизводящего процесса нерациональны большие степени расширения в одной ступени. Чем меньше степень расширения, тем выше эффективность процесса выхлопа.
Если процесс выхлопа рассматривать во времени, то неизбежно приходится учитывать «температурное расслоение», или возникновение температурного градиента в потоке выходящего из баллона газа.
Впервые процесс выхлопа был использован Л. Кальете в 1877 г. для ожижения кислорода и других газов. Затем он применен Э. Ольшевским и С. Вроблевским для получения ожиженных газов. В 1932 г. Ф. Симон успешно использовал этот процесс
для ожижения гелия. В 1959 г. У. Гиффорд и Мак-Магон построили оригинальный криогенератор, в котором циклически повторялся процесс выхлопа. Процесс свободного выпуска газа использован и в так называемой пульсационной трубе. Процесс выхлопа является одним из важнейших рабочих процессов поршневых детандеров.
В заключение отметим, что обратным процессу выхлопа по физическому смыслу является процесс впуска газа в какую-либо емкость. В этом случае происходит неравновесное адиабатное сжатие газа, предварительно находившегося в баллоне. Если сжимаемый газ, находившийся в баллоне, остается изолированным от входящих порций свежего газа, то можно записать, что
Tk / TH = [ 1 + (k - 1) (pk / pH )] / k. (2.15)
При впуске газа с температурой TBx температуру Tk в баллоне после заполнения определяют с учетом смешения газа сжимаемого и вновь поступающего. Выполнив соответствующие вычисления, получим
Tk = (k TBx TH pk / pH) / [TH (pk / pH – 1) + k TBx. ] . (2.16)
Рассматривая процесс впуска во времени, необходимо также учитывать возникновение температурного градиента в потоке впускаемого газа. Температура в баллоне максимальна вдали от впускного клапана в зоне сжатия газа, находившегося перед впуском. Датчики температуры могут фиксировать кратковременно местное повышение температуры. Наиболее низкие температуры в струях газа вблизи от входного окна или клапана. При интенсивном смешении температурный градиент исчезает, и в баллоне устанавливается температура, теоретически определяемая уравнением (2.16). Неравномерное поле температур в сосуде, в который входит газ, можно в определенной конструкции стабилизировать во времени и, используя повышение температуры сжимаемого газа для передачи его энергии в окружающую среду, получить охлаждающее устройство. Это показано У. Гиффордом и Р. Лонгсвортом, осуществившими подобные процессы в пульсационной трубе .
2.7. ПРОЦЕССЫ В АДИАБАТНОЙ СИСТЕМЕ С ПЕРЕМЕННОЙ МАCСОЙ
Для многих криогенных систем, особенно в низкотемпературных газовых машинах, рабочие процессы в отдельных частях (полостях) протекают при переменной массе рабочего тела Вследствие быстротечности эти процессы можно рассматривать как адиабатные. Рассмотрим кратко основные закономерности изменения параметров газа в открытой адиабатной системе при переменном количестве рабочего тела.
Любую термодинамическую систему с переменным количеством рабочего тела можно проанализировать и описать с использованием методов классической термодинамики. Однако, способы решения задач для систем с переменной массой могут быть разными.
Иногда для решения задачи удобно выбрать подсистемы или дополнительные системы с постоянной массой и рассмотреть их взаимодействие. В других случаях проще непосредственно исследовать систему с переменной массой рабочего тела.
На рис. 2.7. приведена схема адиабатной открытой системы, контрольная поверхность которой совпадает с границами рабочего объема. В сечении а - а в систему втекает поток
с температурой Та . При движении поршня параметры системы меняются. Уравнение, связывающее текущие параметры газа в системе, имеет вид
dp / p = [(Ta –T) dv /v – Ta dT / T] / (T/ k – Ta) . (2.17)
В зависимости от условия задачи температура Та может быть переменной или постоянной. Последнее выражение является общим. Из него можно получить известные частные решения. Например, если температура газа Та в сечении а—а остается все время равной текущей температуре газа Т (что возможно в двух случаях: когда газ в систему не поступает или когда газ уходит из системы), то выражение (2.17) дает известное уравнение равновесной адиабаты Пуассона
dp / p =[ k / (k – 1) ] dT / T . (2.18)
Если температура Та не равна температуре газа в системе, то происходит необратимое смешение. Уравнение (2.18 ) остается справедливым, если теплота смешения равна нулю.
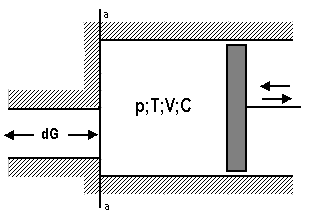 |
Рис.2.7. Схема простейшей открытой адиабатной системы с переменным количеством рабочего тела.
Например, для процесса впуска газа в какой-либо объем dV = 0 и Та = TBX = const. Тогда из уравнения , получим
dp / p = [ 1/T - 1/(T-kTBX)] dT (2.19)
Это дифференциальное уравнение процесса впуска. Проинтегрировав его в пределах от pH до рк, получим выражение, полностью совпадающее с уравнением (2.16).
Другой типичный процесс с переменной массой — процесс наполнения при постоянном давлении (dp = 0) и Та = TBx = const. В этом случае из уравнения (2.17) найдем
dV/V = dT/T — dT/(T — TBX). (2.20)
Это дифференциальное уравнение процесса наполнения при р = const.
Проинтегрировав выражение (2.20) в пределах от VH до Vk, получим
Tk = TBX Vk / (Vk – VH + VH TBX / TH). (2.21)
Таким образом, показано, что уравнение (2.17), действительно, является общим. Его можно применять и для необратимых процессов. Из уравнения (2.17) следует также, что в процессе выхлопа ( Та = Т ) температура газа, остающегося в баллоне, изменяется по адиабате Пуассона.
2.8. РАСШИРЕНИЕ ГАЗА В АДИАБАТНОЙ ВИХРЕВОЙ ТРУБЕ РАНКА—ХИЛША
В 1931г. Ж.Ранк обнаружил эффект температурного разделения газового потока при его вихревом течении. Схема устройства для реализации эффекта Ранка дана на рис. 2.8.
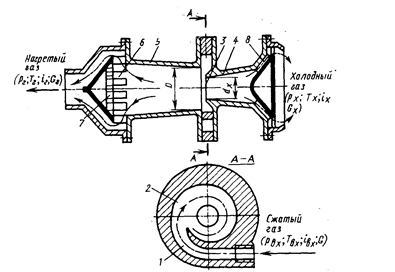
Рис.2.8. Схема адиабатной вихревой трубы
Сжатый газ через тангенциальное сопло 1 подается в улитку 2, где устанавливается интенсивное круговое течение. При этом возникает неравномерное температурное поле. Слои газа, находящиеся вблизи оси, оказываются более холодными, чем входящий газ, а периферийные слои закрученного потока нагреваются. Часть газа m в виде холодного потока отводится через диафрагму 3, насадок 4 и щелевой диффузор 8, а другая часть
(1 — m) в виде нагретого потока — через насадок 5 и лопаточный диффузор 6 с сеткой 7. Такая схема вихревой трубы близка к оптимальной. Более простые конструкции выполняют без диффузоров. Работу вихревой трубы можно регулировать дроссельной заслонкой на теплом потоке.
Если часть газа m оказалась после расширения более холодной, а другая часть (1 — m) — более горячей, значит, часть энергии первого потока ( m ) передана второму потоку; поэтому вихревую трубу иногда называют энергетическим разделителем потока. Весьма сложный характер механизма течения газа в вихревой трубе здесь не обсуждаем. Заметим только, что, как установлено экспериментальными исследованиями, осевая скорость периферийных слоев закрученного потока направлена в сторону горячего конца трубы. На расстоянии около 0,35D от оси осевая скорость близка нулю. На меньших радиусах появляется постепенно нарастающая осевая скорость, направленная в сторону холодного конца трубы. Около оси осевая скорость снова уменьшается. Угловая скорость центральных масс газа, начиная от оси до определенного радиуса, практически постоянна; эта область называется вынужденным вихрем. В периферийной области закрученного потока угловая скорость уменьшается с увеличением радиуса; эта область называется свободным вихрем.
Простейшее объяснение эффекта температурного разделения сводится к следующему. Частицы газа, движущиеся к центру, стремятся сохранить угловой момент, и должны были бы вращаться с нарастающей угловой скоростью по мере приближения к оси. Однако, этому препятствует вязкость среды. В результате центральные слои вращаются с практически одинаковой скоростью, и частицы газа, движущиеся к центру, вынуждены отдавать часть своей кинетической энергии другим слоям газового вихря, охлаждаясь при этом. Периферийные слои вращающегося газа, получая эту энергию, нагреваются, так как она в конечном итоге превращается в теплоту. Это объяснение весьма приближенное и не учитывает многих реальных явлений, возникающих в вихревой трубе.
Уравнение закона сохранения энергии для адиабатной вихревой трубы имеет вид
G iвх = Gxix + Gгiг или i вx = m iх + (1 - m ) iг , (2.22)
m= Gx / G ; 1 - m = Gг / G; Gx+ Gг = G, (2.23)
где Gx и Gг— количества соответственно холодного и горячего газа.
Удельная холодопроизводительность вихревой трубы
q B = m (i вx - i х ) = (1-m) (i г - i вх ). (2.24)
Снижение температуры холодного потока DТх даже в лучших конструкциях вихревых труб достигает только 50—55% разности температур в изоэнтропном процессе. Отношение DТх / DTs часто называют температурной эффективностью вихревой трубы. Если, кроме того, учесть, что холодный поток составляет всего 25— 35 %, то становится очевидной низкая эффективность вихревой трубы как генератора холода. Однако, ее конструктивная простота в некоторых случаях играет определяющую роль, особенно, когда экономические соображения не являются решающими.
На рис. 2.9. приведены типичные характеристики вихревой трубы.
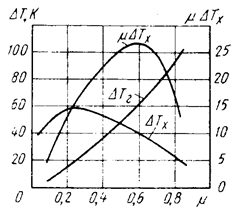
Рис. 2.9. Типичные характеристики адиабатной вихревой трубы Pвх » 0.6 МПа;
Тдх = 303 К; Px = 0,101 МПа; рабочее тело — воздух)
Наибольшее изменение температуры холодного потока DТх наблюдается при m » 0,25. Удельная холодопроизводительность, характеризуемая произведением mDTx максимальна при m» 0,6. На характеристики вихревой трубы влияют не только термодинамические параметры газа, но в большей степени и геометрические размеры, в частности, диаметр, диафрагмы, длина насадка для отвода горячего и холодного потоков и его геометрия, размеры сопла. Поскольку давление нагретого потока газа всегда больше давления холодного потока, то часто выходящий горячий поток (1-m) используют для эжекции обратного потока m. В этом случае удается повысить эффективность трубы и увеличить значение m , при котором достигается наибольшее изменение температуры холодного потока, примерно до 0,35 (вместо 0,25).
2.9. ПРОЦЕССЫ ВОЛНОВОГО РАСШИРЕНИЯ ГАЗА
При анализе процесса дросселирования, реализуемого в безмашинном расширительном устройстве, указано, что в дроссельном вентиле происходит процесс истечения с преобразованием энергии сжатого газа в кинетическую энергию потока.
Для увеличения температурного эффекта расширения без существенного усложнения самого расширительного устройства необходимо найти способы преобразования кинетической энергии потока в другие формы и отвода ее части без использования сложных машин — детандеров, обычно применяемых для этих целей.
Одним из практических путей является осуществление так называемого процесса волнового расширения: расширения в условиях установившегося течения с генерацией волновой (акустической) энергии и отводом части этой энергии в преобразованном виде от расширяющегося газа.
Исследования, проведенные в МВТУ им. Н. Э. Баумана совместно с НПО «Криогенмаш», «Гелиймаш», ВНИИХОЛОДМАШ и Акустическим институтом АН СССР, определили некоторые возможные способы реализации волновых процессов расширения применительно к криогенным и холодильным системам. Разработанные расширительные устройства названы волновыми криогенераторами (ВКГ), а сам метод получил название газодинамического безмашинного метода получения холода.
Для возбуждения волновых автоколебательных режимов можно использовать скачки уплотнений, возникающие, например, в недорасширенных струях при истечении газа через сужающееся сопло. За пределами сопла наблюдаются сверхзвуковые скорости течения газа.
На рис. 2.10 показана структура кольцевой недорасширенной струи. При втекании такой струи в какую-либо замкнутую полость скачок уплотнения при определенных условиях начинает осциллировать, генерируя волновой процесс (эффект Гартмана). Преобразование энергии колебаний среды в другие формы энергии и отвод ее от расширяющегося газа можно осуществлять различными методами. Например, в волновых криогенераторах с резонансными трубками сильно нагревается закрытый конец трубки (эффект Шпренгера), и выделяющаяся теплота может быть отведена.
В другом типе волнового криогенератора использованы короткий резонатор-излучатель и эллипсоидный концентратор. В левом фокусе эллипсоида расположен резонатор-излучатель, а в правом — при фокусировании волн нагревается приемник колебаний, теплота от которого также может быть отведена.
Возможны и другие конструкции, в том числе с прямым преобразованием волновой энергии в электрическую.
Исследования рабочего процесса в ВКГ с резонансной трубкой показали существование двух периодически повторяющихся стадий процесса: входа газа в резонансную трубку и выхода из нее навстречу потоку из сопла. Таким образом, в резонансной трубке устанавливается автоколебательный процесс. Наличие центрального стержня способствует стабилизации этого процесса.
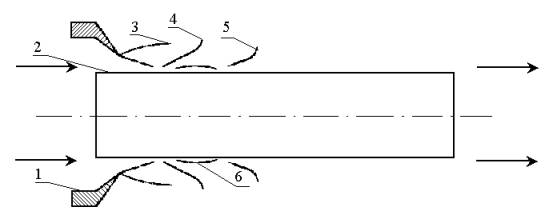 |
Рис. 2.10. Схема кольцевой сверхзвуковой недорасширенной струи:
1— сужающееся сопло; 2 — стержень; 3— граница струи в зоне первой ячейки (<бочки»);
4 и 5 — первый и второй скачки уплотнений; 6 — граница отрыва пограничного слоя
Возникающие и отраженные от дна трубки волны сжатия и разрежения, взаимодействуя между собой, образуют на некотором расстоянии от открытого конца трубки ударную волну конечной амплитуды. Прохождение по трубке прямой и отраженной от дна ударных волн проявляется в интенсивных колебаниях давления, росте энтропии и выделении теплоты. Режимы с максимальной амплитудой колебания давления характеризуются наибольшими устойчивостью и тепловыделениями. Амплитуда А колебаний газа на основной резонансной частоте примерно на 8—15 дБ выше, чем на других частотах. Так как плотность энергии в волновом процессе в первом приближении пропорциональна квадрату амплитуды колебаний, то, следовательно, на основной резонансной частоте переносится около 80—90 % всей энергии.
Существенно, что при понижении температуры на входе амплитуда колебаний давления газа не уменьшается. Это является необходимой предпосылкой для сохранения эффекта охлаждения газа при низких температурах.
Распределение температур по длине резонансной трубки зависит от целого ряда конструктивных факторов и температуры газа на входе. Конструктивными усовершенствованиями можно повысить максимальную температуру в трубке для воздуха до 800 К, для гелия до 1000 К.
Уменьшение энтальпии газа при расширении в волновом криогенераторе определяет его холодопроизводительность:
iвx — iвых = q , (2.25)
где q — количество отведенной теплоты.
Теплоотвод можно осуществлять отбором части горячего газа с теплой стороны трубки. В этом случае ВКГ работает как своеобразный энергетический разделитель потока, сходный по производимому эффекту с вихревой трубой.
В общем случае изменение температуры газа при расширении в ВКГ
DT = Tвх – Твых = DТw ± DТi. (2.26)
где DТw - понижение температуры газа в результате отвода части волновой энергии ;
DТi – интегральный дроссель – эффект. Отсюда
DТ / DТi = DТw / DТi ± 1 (2.27)
Это отношение обычно равно 3—4, т. е. разность температур до и после расширения в 3—4 раза и более превышает интегральный дроссель-эффект.
Эффективность ВКГ можно оценивать также адиабатным КПД, т. е. как для «волнового» детандера:
hад » q / Dis , (2.28)
где Dis — разность энтальпии при изоэнтропном расширении.
При достигнутой степени совершенства ВКГ средние значения hад = 0,12 ... 0,18, а на отдельных режимах hад = 0,2 ... 0,25 (для наиболее совершенных конструкций). Несомненное преимущество ВКГ как безмашинных генераторов холода — простота, надежность, устойчивость работы в широкой области параметров для различных газообразных рабочих тел. Осуществить эффективный рабочий процесс ВКГ в области состояний насыщения, пока не удалось. Это ограничивает их применение. При использовании ВКГ в циклах гелиевых установок теплота от ВКГ передается на предварительную ступень охлаждения.
2.10. ОТКАЧКА ПАРОВ КИПЯЩЕЙ ЖИДКОСТИ
Процесс в жидкости при уменьшении давления над ее зеркалом в изолированном сосуде напоминает процесс кипения. Через слой жидкости поднимаются пузырьки пара, который откачивается вакуумным насосом. Однако, при откачке могут существовать режимы только поверхностного испарения. Например, при откачке паров He после перехода через l-точку видимый процесс кипения прекращается. Режимы поверхностного испарения наблюдаются также при глубоком вакуумировании азота и кислорода. Во всех случаях испаряющийся пар отнимает энергию у жидкости и внутренних стенок сосуда, вследствие чего температура остающейся жидкости и стенок снижается (рис. 2.11).
Скорость изменения температуры жидкости в сосуде определённой геометрии определяется в основном интенсивностью откачки её паров, т.е. производительностью вакуумного насоса. Разные криогенные жидкости имеют различные зависимости давления насыщенных паров и теплоёмкости жидкости от температуры, поэтому при использовании одинаковых насосов темп охлаждения, при прочих одинаковых условиях, разный. Прекращение охлаждения происходит при понижении давления до такой величины, при которой уменьшение энергии компенсируется внешним теплопритоком. По этой причине для 4He с помощью даже самых мощных вакуумных насосов не удаётся получить температуру ниже 0,5 К.
Пусть r — скрытая теплота испарения жидкости; m — масса жидкости в сосуде; mн – начальная масса жидкости; mст - масса внутренних стенок; сж и cст — теплоемкость жидкости и материала стенок; Qc — теплоприток через изоляцию.
В первом приближении снижение температуры жидкости при откачке ее доли Dm:
DТ» (rср Dmпр – qc.пр )[(1 - Dm пр) сж ср + 0,5 Dmпр сж.ср + mст .пр с ср.ст]-1 , (2.29)
где Dmпр и qc.пр - приведенные к mн величины.
На практике часто применяют этот метод для получения недогретых (ранее называемых переохлажденными) жидкостей. В реальных условиях возникают дополнительные потери, главным образом из-за неравновесности и недоиспользования скрытой теплоты испарившейся жидкости. Уходящий пар не находится в равновесии со всей массой остающейся жидкости, в которой существуют температурные градиенты. Наиболее интенсивно охлаждаются слои жидкости вблизи ее зеркала. Разность температур жидкости в режимах кипения обычно не превышает 2 К, а в режимах поверхностного испарения (кроме Не) может достигать 5 К. Дополнительные потери зависят от режимов откачки, многих конструктивных факторов, наличия смесителей и др.
 Рис. 2.11. Схемы: а — откачки паров криогенной жидкости; б — рефрижератора замкнутого цикла с адсорбционным насосом для откачки газов; ВН — вакуумный насос; 1- испаритель; 2 — конденсатор; 3 — адсорбционный насос; q, qk , qадс и qдес- теплота соответственно подводимая, конденсации, адсорбции и десорбции
Рис. 2.11. Схемы: а — откачки паров криогенной жидкости; б — рефрижератора замкнутого цикла с адсорбционным насосом для откачки газов; ВН — вакуумный насос; 1- испаритель; 2 — конденсатор; 3 — адсорбционный насос; q, qk , qадс и qдес- теплота соответственно подводимая, конденсации, адсорбции и десорбции
Действительные значения DТ меньше рассчитанных по формуле (2.29), которую можно уточнить, введя в числитель в общем виде дополнительные потери qдоп.
Откачку паров жидкостей можно выполнять различными устройствами, в том числе и криогенными вакуумными насосами. На рис. 2.11 показана принципиальная схема криорефрижератора с адсорбционным насосом. В процессе адсорбции происходит откачка паров, и теплота испарения жидкости используется для охлаждения. В процессе десорбции одновременно происходит процесс конденсации рабочего вещества в конденсаторе, и этим процессом цикл замыкается.
2.11. ПРОЦЕССЫ ОХЛАЖДЕНИЯ С ИСПОЛЬЗОВАНИЕМ РАБОЧЕЙ СРЕДЫ В ТВЕРДОМ СОСТОЯНИИ
Наиболее распространенный тип термодинамической системы, применяемой в криогенной технике, термомеханическая система с рабочей средой в газообразном или
жидком состоянии. Рассмотренные выше классические процессы построены на использовании именно такой термомеханической системы. Однако, в ряде случаев целесообразно применение твердых тел для охлаждения; при этом вместо механической работы проявляются такие типы взаимодействия, как магнитные и электрические.
Существует ряд термодинамических процессов, пригодных для получения низких температур и основанных на использовании рабочей среды в твердом состоянии. Некоторые из них (адиабатное размагничивание и термоэлектрическое охлаждение) нашли широкое применение, другие используют редко, но они перспективны и, возможно, получат распространение в будущем. Рассмотрим ряд процессов получения низких температур с использованием твердых тел в качестве рабочей среды.
Адиабатное размагничивание. Для снижения температуры тела необходимо тем или иным способом предварительно уменьшить энтропию. Наиболее распространенный термомеханический способ уменьшения s изменением давления неэффективен при температурах, близких к 1 К, так как в этой области неупорядоченность (энтропия) слабо зависит от параметров р и v. Для охлаждения вблизи 1 К необходима иная физическая система, энтропия которой могла бы существенно изменяться при изменении параметра состояния X.
В 1926 г. В. Джиок и П. Дебай независимо друг от друга предложили использовать в качестве такой системы парамагнетики. Однако, еще в 1905 г. П. Ланжевен показал, что изменение намагниченности парамагнитного вещества должно сопровождаться обратимыми изменениями температуры. Парамагнитное вещество можно рассматривать как систему, состоящую из элементарных магнитных диполей, обладающих магнитным моментом, но очень слабо взаимодействующих между собой. Вплоть до гелиевых температур диполи расположены хаотически, что обусловлено их тепловым движением и слабым взаимодействием. Однако, их можно ориентировать (перевести в упорядоченное состояние) наложением внешнего магнитного поля. Причем сделать это можно только, если энергия колебаний решетки мала и не влияет на магнитную систему. Появляется возможность уменьшить энтропию системы при помощи внешнего магнитного поля, напряженность которого Н можно рассматривать в качестве параметра состояния X. Таким образом получаем принципиальную возможность использовать эту систему для охлаждения.
Рассмотрим некоторые соотношения термодинамики применительно к термомагнитной системе, для которой энтропия является функцией температуры и напряженности поля s =f (Т, Н). В общем случае выражение для элементарной работы в термодинамике запишем так: dL = Х dY, где Х — обобщенная сила; Y — обобщенная координата. В термомеханической системе работа связана с изменением объема, т. е. Х = р, а Y = v. В магнитной системе работа состоит в поляризации диполей при наложении внешнего магнитного поля напряженностью Н; при этом меняется намагниченность материала H. Очевидно, что Х = Н и Y = М, следовательно, dL= -HdM. Знак минус показывает, что при увеличении намагниченности работа производится над магнетиком. В этом случае первое начало термодинамики можно записать в форме du= dq + HdM (изменение объема магнитного вещества при этом не учитываем). С учетом второго начала запишем
du = Tds + HdM. (2.30)
Очевидно, что таким же образом можно ввести магнитную энтальпию е = u — НМ.
Определим изменение температуры при использовании магнитной системы для охлаждения. Рассмотрим наиболее эффективный обратимый процесс охлаждения — изоэнтропное размагничивание. Используем соотношение s = f (Т, Н) для процесса
s = const:
ds = {¶s/¶Т)н dT + (¶s / ¶Н)т ¶Н = О (2.31)
или
(¶Т/¶Н)s = — (¶s / ¶Н)т / (¶s / ¶Т)н. (2.32)
Для процесса Н = const из соотношения Tds = cH dT получим
(¶s / ¶Т)н = cн / Т, (2.33)
где cн - теплоемкость парамагнитного вещества при постоянной напряженности поля Н.
Используя уравнение Максвелла для магнитной системы
(¶s / ¶Н)т = (¶М / ¶Т)н , (2.34)
получим формулу для магнитокалорического коэффициента
aм = (¶Т/¶Н)s = — (Т / сн) (¶М / ¶Т)н. (2.35)
Это уравнение по структуре сходно с аналогичным уравнением для процесса s = const в термомеханической системе. Оно характеризует дифференциальный эффект процесса охлаждения. В принципе любое магнитное вещество (парамагнетик или ферромагнетик) можно использовать для охлаждения, если эффект достаточно велик.
Принцип магнитного охлаждения удобно проиллюстрировать с помощью диаграммы Т — s для парамагнитного вещества (рис. 2.12. ) (H0, ..., Н4) — линии постоянной напряженности).
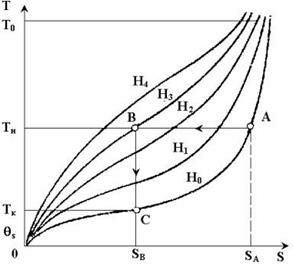 |
Рис. 2.12. Процесс магнитного охлаждения в диаграмме T—s
Магнитное охлаждение состоит из двух этапов: процесса А-В изотермического намагничивания от Н0 = 0 до Н3 при постоянной начальной температуре Tн и процесса В-С изоэнтропного размагничивания, в результате которого напряженность поля уменьшается от Hз до Н0 = 0 при sb = const и температура снижается до Tк. При изотермическом намагничивании парамагнитного вещества (процесс А-В) магнитные диполи ориентируются параллельно полю, энтропия от sa уменьшается до sв, процесс сопровождается отдачей теплоты q= Тн (sА — sв) в окружающую среду. Аналогом этого процесса для термомеханической системы является изотермическое сжатие газа. При адиабатном размагничивании В-С температура падает до Tк при постоянной энтропии. Аналог этого процесса — расширение газа в детандере.
Метод адиабатного размагничивания применяют для получения низких температур, чаще всего в интервале от 1 до 0,001 К. Верхняя граница применимости метода определяется температурой То, выше которой тепловые колебания очень интенсивны, и система не может быть упорядочена воздействием внешнего магнитного поля. Нижняя граница определяется температурой, при которой энергия взаимодействия частиц становится сравнимой с их тепловой энергией. При этом достигается упорядоченное состояние самопроизвольно без наложения внешнего магнитного поля.
На рис. 2.13. показаны этапы процесса адиабатного размагничивания.
.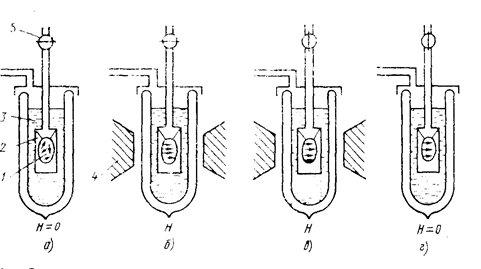
Рис. 2.13. Схема процесса адиабатного размагничивания:
а — охлаждение; б — намагничивание; в — откачка теплообменного газа; г — размагничивание; 1 — образец; 2 — контейнер; 3 — жидкий гелий; 4 — магнит; 5 — вентиль
Образец 1 парамагнитного вещества помещен в контейнер 2, находящийся в ванне с жидким гелием 3. Вначале происходит охлаждение образца; при этом контейнер заполняется газообразным гелием, способствующим переносу теплоты между жидкостью и парамагнетиком; жидкий гелий в ванне вакуумируется обычно до температуры Тн » 1 К. Затем образец намагничивается при Тн =const; теплота намагничивания передается жидкому гелию. Далее откачивается теплообменный газ из контейнера 2 для создания адиабатных условий. После этого магнитное поле снимается (Н = 0), образец размагничивается и температура падает до Тк.
Для определения конечного изменения температуры из формулы (2.35) необходимо использовать уравнение состояния парамагнитного вещества f (Т, Н, М) = 0. Для определения изменения температуры при размагничивании необходимо также знать зависимость магнитной теплоемкости cH от температуры и напряженности поля.
В качестве парамагнитных веществ применяют парамагнитные соли типа железоаммониевых, хромокалиевых, хромометиламмониевых квасцов; сульфаты (медно-калиевый, кобальтоаммониевый, гадолиния) и др. Каждая парамагнитная соль имеет ограниченный интервал температур, в котором ее применение наиболее эффективно. Границы этого интервала зависят от температуры, при которой магнитная теплоемкость максимальна, а также определяются соотношением между энергией взаимодействия магнитных ионов и их тепловой энергией. Наиболее распространенные соли хорошо изучены, для них известны весьма полные данные по энтропии, энтальпии и теплоемкости.
Дальнейшая разработка метода адиабатного размагничивания связана, в частности, с применением двухступенчатого процесса. Идея метода заключается в использовании двух последовательно соединенных образцов различных парамагнитных солей. Низкая температура, достигнутая при размагничивании первого образца, является начальной температурой для второго образца, при размагничивании которого достигается минимальная температура.
Возможность получения еще более низких температур открывается в случае использования явления парамагнетизма, обусловленного ядерными спинами. Магнитные свойства ядер (в отличие от магнетизма, обусловленного электронными спинами) выражены значительно слабее. Магнитный момент у ядер примерно в 1000 раз меньше, чем у электронов. По этой причине подобные материалы можно использовать для охлаждения только при начальных температурах порядка 0,01 К, так как при более высоких Т посторонние воздействия нарушают ориентацию ядерных магнитных моментов.
Процесс реализуют по схеме, аналогичной двухступенчатому размагничиванию. На верхней ступени обычный парамагнитный материал обеспечивает уровень порядка 0,01 К — исходный для ядерного размагничивания. Впервые процесс осуществлен Н. Кюрти в 1956 г.; в качестве рабочей среды была применена медь. Температура, достигнутая при использовании метода ядерного размагничивания, составляет несколько микрокельвин, однако, следует учитывать, что речь идет не о температуре всего образца, а лишь о температуре системы ядерных спинов.
Материал в целом может быть охлажден этим методом до температуры порядка 10-4К.
Магнитные криогенные машины. Дальнейшее развитие метода адиабатного размагничивания привело к созданию магнитных машин непрерывного действия, позволяющих устранить существенный недостаток этих систем — одноразовость процесса. Первая такая машина создана Даунтом (рис. 2.14. ).
В криостате с жидким гелием (Тн » 1 К) расположен вакуумный контейнер 6, внутри которого находится парамагнитное вещество 1 (железоаммониевые квасцы) и охлаждаемый объект 2. Два тепловых ключа 3 и 4 обеспечивают тепловой контакт между объектами 1 и 2, а также с гелиевой ванной. Магнитное поле создается магнитом 5; малые магниты 7 управляют тепловыми ключами.
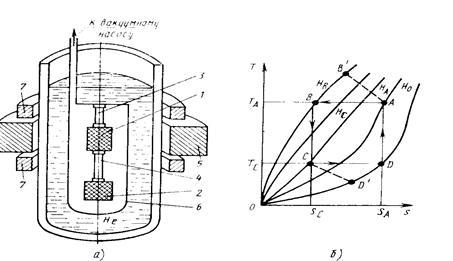
Рис. 2.14. Магнитная криогенная машина:
а — схема; б — цикл в T—s-диаграмме
Последовательность процессов в машине: 1) изотермическое намагничивание (линия АВ); ключ 3 открыт, 4 закрыт; напряженность поля увеличивается от НА до Нв (ТА = const.); выделяется и отводится к гелию теплота QA == Tа (sa —Sc); 2) адиабатное размагничивание (линия ВС); оба ключа закрыты — система адиабатна; напряженность поля уменьшается до Нс', температура снижается до Те; 3) изотермическое размагничивание (линия CD); ключ 3 закрыт, 4 открыт; процесс изотермичен вследствие поглощения теплоты от объекта 2 и передачи ее рабочему веществу 1; напряженность поля падает до Н0 при Tc = const; поглощенная теплота Qc = Те (sa—So); 4) адиабатное намагничивание (линия DA) при закрытых ключах 3 и 4; система возвращается в исходное положение. Из диаграммы Т — s видно, что машина работает по циклу Карно; КПД hс = Тс / (Та — Тc).
Важный элемент этой машины — сверхпроводящие тепловые ключи. Как отмечено ранее, теплопроводности в нормальном и сверхпроводящем состояниях резко отличаются . Очевидно, что вводом материала в сверхпроводящее состояние и выводом из него можно делать его то хорошим проводником теплоты, то теплоизолятором. Для управления ключами (перевода из сверхпроводящего состояния в нормальное и наоборот) предназначены магниты 7.
Машина Даунта малоэффективна; в интервале 0,2—1 К ее КПД составляет 20 % при холодопроизводительности »7 мВт. В то же время эта машина явилась прототипом современных магнитных систем непрерывного действия.
Установлено, что ряд материалов на основе редкоземельных металлов имеет высокий магнитокалорический (МК) коэффициент aM в довольно широком диапазоне температур — вплоть до нормальной. Экспериментальные данные, полученные в МВТУ им. Н. Э. Баумана и МГУ свидетельствуют о большом магнитокалорическом эффекте при температуре перехода антиферромагнетизм — парамагнетизм для ряда материалов: 232 К для тербия, 178 К для диспрозия, 132 К для гольмия, 85 К для эрбия, 58 К для туллия.
Материалы, применяемые для магнитного охлаждения, помимо высоких значений магнитокалорического эффекта, должны иметь малую фононную (решеточную) теплоемкость, которая поглощает тепловой эффект размагничивания, а также высокую теплопроводность.
В настоящее время наибольшее практическое применение получил гадолиниево-галлиевый гранат Gd2Ga5O12 (GGG). Этот материал наиболее эффективен в области температур 1,5—4,5 К, хотя его можно использовать и до 20 К.
С использованием GGG были созданы образцы эффективно работающих магнитных машин, функционирующих по циклу Карно и позволяющих снижать температуру от 4,2 до 1,8 К. Переход от 4,2 к до 1,8 К имеет важное практическое значение и, в частности, позволяет существенно улучшить характеристики сверхпроводящих магнитов, обеспечить работу высокочувствительных приемников инфракрасного излучения и др. Приближенная расчетная диаграмма Т—s для GGG дана на рис. 2.15, где энтропия отнесена к газовой постоянной R.
На рис. 2.15. представлена конструктивная схема поршневой магнитной машины двойного действия, созданной Лаказом и др. Шток 5 с магнитными элементами 2 из GGG перемещается возвратно-поступательно в изолированном корпусе 3; опоры 4—из алюминиевого порошкового сплава. По обе стороны от штока находятся сверхпроводящие магниты 1. Наружная полость омывается жидким гелием Не I при Т = 4,2 К; охлаждаемый объем 6 заполнен He II при температуре 1,8—2,1 К. В этой машине теоретически осуществляется цикл Карно ABCD для магнитной системы. Процесс АВ намагничивания при постоянной температуре TA = 4,2 К происходит при введении штока с GGG в поле верхнего магнита 1. При этом теплота намагничивания QA отводится к жидкому Не, который кипит при 4,2 К и обеспечивает изотермичность намагничивания. Процесс ВС — размагничивание в адиабатных условиях (Sc = const.) от Tа до Тс — происходит при опускании штока 5 (быстрое перемещение без теплообмена). В конце этого процесса GGG попадает в ванну с Hell при ТА » 1,8 К и полностью размагничивается при Тс = const (процесс CD); при этом отводится теплота от Не11 и реализуется полезная холодопроизводительность Qc.
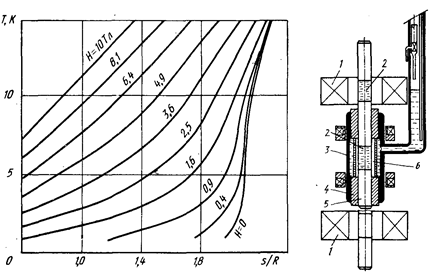
Рис. 2.15. Диаграмма Т—s для гадолиниево-галлиевого граната (GGG)
Рис. 2.16. Конструктивная схема поршневой магнитной криогенной машины
Замыкающий процесс намагничивания DA при Sa = const обеспечивается быстрым возвратом GGG в магнитное поле. Такой же цикл совершает и образец GGG, помещенный в нижней части штока. При осуществлении цикла Карно полезная холодопроизводительность
Qc = Tc (Sa - Sc). (2.36)
Теплота намагничивания, отводимая гелием
QA = TA (SA - Sc) (2.37)
Для реального цикла характерны потери, уменьшающие полезную холодопроизводительность Qc по сравнению с её теоретическим значением. Основной источник потерь связан с температурным градиентом, который возникает из-за наличия термического сопротивления между жидкостью и образцом. Имеются также потери теплоты на трение, в окружающую среду и другие. Идеальный цикл ABCD (см.рис.2.14) практически не реализуется, реальные процессы идут по линиям, близким к АВ' и CD'. Тем не менее, магнитная машина высокоэффективна. Так, при площади поверхности магнитного материала
F = 40 см2, диаметре штока 24 мм, частоте 0,6—1,0 Гц, максимальной индукции поля
4 Тл получены следующие характеристики: Qc = 2,35 Вт при Тc = 2,1 К (»l31 Вт/дм3);
Qc = 1,35 Вт при Тс = 1,8 К (75 Вт/дм3). Максимальный термодинамический КПД ht »65 % при 2,1 К и ht » 40 % при 1,8 К. Эти данные свидетельствуют о больших возможностях магнитных криогенных машин.
Термоэлектрическое охлаждение. Известен ряд термоэлектрических явлений, связанных с взаимным превращением тепловой и электрической энергии, — это эффекты Зеебека, Пельтье и Томсона. Метод термоэлектрического охлаждения основан на эффекте Пельтье(1834 г.). Этот эффект заключается в выделении (или поглощении) теплоты Q в месте контакта двух различных проводников, включенных в электрическую цепь, при прохождении через нее тока. Рабочий средой в такой электрической цепи из двух разнородных проводников является электронный газ, который переносит энергию от холодного контакта к теплому.
Кинетику термоэлектрических явлений объясняют на основе статистической теории электронного газа. При движении электронов в металлическом проводнике под действием разности потенциалов их средняя кинетическая энергия различна для разных материалов.
При переходе электронов из одного материала в другой этот избыток (или недостаток) энергии выделяется (или поглощается) в виде теплоты Q в зоне контакта. Термическая неравновесность проводника также приводит к диффузии электронов из теплой зоны в холодную, влияя на термоэлектрические явления. Если учесть еще и джоулеву теплоту, то полная картина явлений в проводнике с током оказывается достаточно сложной.
Эффект Пельтье у металлов мал, а у полупроводников он значительно выше, особенно в парах разнородных полупроводников дырочного (p) и электронного (n) типов. Схема термоэлемента, состоящего из двух последовательно соединенных полупроводниковых ветвей А и В, приведена на рис. 2.17. При прохождении тока в зоне с низкой температурой Тх поглощается теплота Qх, необходимая для образования пары электрон — дырка, которая движется в зону с высокой температурой Т0, где эта пара аннигилирует с выделением теплоты Qo. Количество теплоты Qx прямо пропорционально силе тока I и температуре
Тx холодного конца:
Qx = a I Tx, (2.38)
где a — коэффициент термоЭДС, зависящий от рода материала.
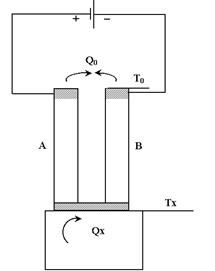 |
Рис. 2.17. Схема термоэлемента,состоящего из пары полупроводников
Полная термоЭДС пары проводников А и В определяется разностью абсолютных значений a для каждого проводника a = ( aA - aB ). Таким образом, теплота, поглощаемая на холодном конце, или холодопроизводительность элемента (при отсутствии потерь)
Qx. о = (aA - aB) I Tx (2.39)
Увеличение силы тока I приводит к росту Qx.о., но одновременно увеличиваются и потери за счет джоулевой теплоты Qj = 0,5 I2 R, где множитель 0,5 учитывает выделение половины теплоты в холодной зоне; R = r l / f — полное электрическое сопротивление, (r—удельное электрическое сопротивление).
Другой вид потерь обусловлен теплопроводностью ветвей термоэлемента:
Qт = К (Т0 — Тх), где К =S (l / l) f ( l— теплопроводность, l и f — длина и площадь поперечного сечения каждой ветви термоэлемента).
Уравнение теплового баланса для контакта, находящегося в холодной зоне, при отсутствии теплопритока из окружающей среды имеет вид
(aA - aB ) ITx = Qx + 0,5 I2 R + К (То - Tx), (2.40)
где Qx — полезный эффект охлаждения.
Минимально возможная температура Tx может быть достигнута при Qx = 0; тогда
из (2.40) соответствующая разность температур
То - Тx = [ (aA - aB) I Tx - 0,5 I 2 R ] / K (2.41)
Оптимальную силу тока Iopt, соответствующую наибольшей разности температур
(То- Тх)мах, можно определить из (2.41), используя условие максимума
¶ (То — Тх)/ ¶ I = 0. Тогда Iopt = (aA - aB) Tx / R . Подставив Iopt в (2.41), получим
(То - Тx)мах = (aA - aB)2 Tx2 / (2 R K) = 0.5 Z Tx2 , (2.42)
где Z = (aA - aB) 2/ (KR) — комплекс, определяющий физические свойства материалов термоэлементов.
С увеличением Z, отражающего тепловые, электрические и термоэлектрические
свойства, возрастает эффективность охлаждения. Для различных полупроводников
Z = (1,5 ... 4,0) 10-3 K-1 , причем Z зависит от температуры.
Одни из лучших материалов для термоэлементов — полупроводники из сплавов Bi -Te и Bi—Sb. Увеличение DT приводит к резкому уменьшению холодильного коэффициента
e = Qx / L. Работа L затрачивается на джоулеву теплоту и создание термоЭДС:
L = I2 R + ( aA - aB ) (T0 - Tx) I (2.43)
Коэффициент e резко уменьшается с понижением температуры за счет потерь от
джоулевой теплоты и теплопроводности. При DT = То — Тх » 50 ... 60 К e®0.
Увеличения эффективности и снижения температуры можно достичь применением многокаскадных схем. В каскадной термобатарее несколько элементов последовательно охлаждают один другой; в этом случае сравнительно легко обеспечивается охлаждение до 180—200 К при КПД ht = 1 ... 2 %. С помощью восьмикаскадной батареи достигнута температура Тх = 134 К. В такой батарее между ступенями должен быть обеспечен хороший тепловой контакт, но электрически их изолируют одну от другой; питание каждой ступени индивидуальное.
Преимущества термоэлектрического охлаждения — простота, отсутствие движущихся частей, высокая надежность. Однако, низкие термодинамические характеристики не позволяют, пока применять эти устройства для эффективной работы при температуре ниже 170 К. Для систем с малой холодопроизводительность, например, для охлаждения инфракрасных приемников излучения, эти устройства могут оказаться наиболее подходящими.
Десорбционное охлаждение. Процесс физической адсорбции можно использовать для создания систем охлаждения. Метод предложен и впервые осуществлен Ф. Симоном
(1928 г.). Рабочая среда находится в газообразном состоянии, а уменьшение энтропии происходит в результате проявления адсорбционных сил, возникающих между поверхностью твердого тела и адсорбируемым газом. Природа этих сил обусловлена ионным взаимодействием. В качестве адсорбентов обычно используют активированный уголь, цеолиты и другие поверхностно-активные материалы. Процесс адсорбции и обратный ему процесс — десорбция — сопровождаются тепловыми эффектами .
Захват молекул газа поверхностью твердого тела (адсорбция) приводит к выделению теплоты, эквивалентной изменению кинетической энергии молекул газа. Отрыв молекул от поверхности адсорбента (десорбция) требует затрат энергии и сопровождается поглощением теплоты. Десорбция, проведенная в адиабатных условиях, приводит к снижению температуры.
На рис. 2.18. приведена схема аппарата для реализации этого процесса охлаждения.
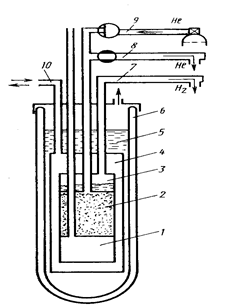
Рис. 2.18. Схема аппарата для десорбционного охлаждения
Аппарат состоит из сосуда Дьюара 6, в котором расположен вакуумный кожух 4. Внутри кожуха имеется сосуд 3, заполненный адсорбентом 2 (активированным углем). Охлаждаемая камера 1предназначена для экспериментальных целей. Сосуд Дьюара заполнен жидким водородом 5, а вакуумный кожух — теплообменным газом (гелием) для установления теплового контакта между жидкими водородом и адсорбентом. Охлажденный водородом адсорбент интенсивно поглощает газообразный гелий, поступающий по линии 9. Выделяющаяся теплота адсорбции поглощается жидким водородом; процесс изотермичен. Температура водорода является исходным уровнем процесса (То). Откачкой водорода из сосуда 3 вакуумным насосом по линии 7 можно обеспечить То до 10 К. Затем теплообменный газ удаляется вакуумированием по линии 10, адсорбент адиабатически изолируется, начинается десорбция гелия откачкой его вакуумным насосом через линию 8; в результате в изолированном сосуде 2 (с адсорбентом) температура падает до Tx » 4,0 К при Т0= 14 ... 10 К.
Если вместо водорода использовать жидкий воздух или кислород (То » 90 К), а вместо гелия — неон, то в интервале давлений 0,17—1,6 МПа можно достичь температуры
Тx » 68 К (DT = 22 К).
2.12. ПРОЦЕССЫ ОХЛАЖДЕНИЯ, ОСНОВАННЫЕ НА ИСПОЛЬЗОВАНИИ СВОЙСТВ 4He и 3He
Гелий широко используют в криогенных системах; он относится к основным рабочим веществам, применяемым при температурах ниже 80 К. Обычно гелий (его широко распространенный изотоп 4Не) применяют в системах, использующих процессы дросселирования и изоэнтропного расширения.
Однако, эти классические процессы непригодны для охлаждения при температурах ниже 1 К. Предельно достигаемая температура, получаемая вакуумированием паров 3Не, около 0,3 К. В то же время можно реализовать другие эффекты охлаждения для достижения сверхнизких температур, используя особые свойства гелия.
Оба стабильных изотопа гелия 4Не и 3Не единственные в природе квантовые жидкости, в которых квантовые эффекты проявляются в макроскопических масштабах и определяют особое поведение этих сред. Это обстоятельство и позволяет применять изотопы гелия для получения сверхнизких температур.
Охлаждение растворением 3Не в 4Не. В 1951 г. Г. Лондон обосновал метод получения сверхнизких температур, основанный на использовании теплового эффекта при растворении жидкого 3Не в 4He. Поглощение теплоты в процессе растворения возможно благодаря особым свойствам и характеру взаимодействия этих ожиженных изотопов. Гелий-4 имеет нулевой ядерный спин; его квантово-механическое описание подчиняется статистике Бозе—Эйнштейна. Гелий-3 имеет ядерный спин 1/2; поведение его следует статистике Ферми—Дирака. Этим объясняется различие свойств 3Не и 4He.
В рассматриваемой области температур (<1 К) жидкий 4He находится в сверхтекучем состоянии, имеет почти нулевую вязкость и энтропию, которая снижается пропорционально Т3. Очевидно, что эта жидкость является инертной в гидродинамическом и тепловом отношении. Другому изотопу 3Не такое поведение несвойственно; он не переходит в сверхтекучее состояние вплоть до 3 10-3 К, его энтропия существенно выше, чем у 4He. Теплоемкость 3Не также значительно больше теплоемкости 4He. При растворении 3Не в 4He атомы этих жидкостей не взаимодействуют между собой из-за инертности 4He , следовательно, переход 3Не в объем, заполненный 4He, где концентрация атомов 3Не мала, аналогичен процессу его расширения в пустоту, сопровождающемуся поглощением энергии. При этом в слабом растворе возникает как бы газообразная фаза из атомов 3Не, для которых 4He является лишь поддерживающей средой.
Таким образом, процесс растворения приводит к изменению (уменьшению) упорядоченности системы в результате перехода жидкость-газ; энтропия 3Не возрастает. Растворение сопровождается поглощением теплоты перехода из одной фазы (чистый 3Не ) в другую (слабый раствор 3Не ), как и при испарении обычной жидкости.
Растворение в адиабатных условиях приводит к охлаждению.
В настоящее время свойства 3Не и его слабого раствора в 4He достаточно хорошо изучены. Наиболее полная теория учитывает взаимодействие между частицами 3Не и базируется на модели слабо взаимодействующего газа, частицы которого подчиняются статистике Ферми—Дирака. В первом приближении для слабого раствора 3 He в 4 He изохорная теплоёмкость cv = ( 3/2 ) R ( идеальный газ) ; при температуре T < 0,4 К это значение изохорной теплоёмкости начинает линейно уменьшаться.
Чтобы понять теоретические основы процессов охлаждения, связанных с особенностью термодинамических свойств растворов стабильных изотопов гелия , необходимо рассмотреть свойства жидких смесей 3Не и 4He. Важное свойство раствора 3Не в 4He - естественный (спонтанный) процесс фазового расслоения (сепарации) . При Т < 0,86 К в растворе 3Не в 4He появляются две фазы, расположенные одна над другой. Верхняя фаза — почти чистый 3Не, нижняя — слабый раствор 3Не в 4He ( вследствие меньшей плотности жидкого 3Не по сравнению с жидким 4He ). Переход атомов 3Не из верхней фазы в нижнюю через границу раздела представляет собой как бы испарение жидкого 3Не в объем с 4He.
Выше кривой расслоения жидкая смесь находится либо в сверхтекучей , либо в нормальной фазе в зависимости от того, слева или справа от l - кривой находится рассматриваемая точка.
Экспериментально установлено, что растворимость 3Не в 4He конечная и минимальная
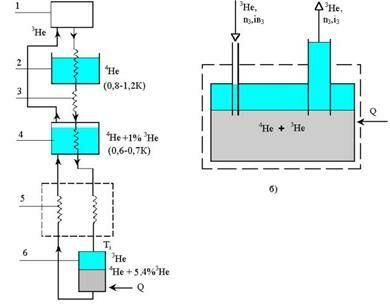 |
Рис. 2.19. Схема рефрижератора растворения (а) и смесительной ванны (б)
равновесная концентрация 3Не примерно равна 6,4 %. Первые удачные опыты по растворению 4He осуществлены в 1964 г., а первая эффективно работающая установка создана Б. Негановым, Н. Борисовым и Н. Либургом в 1965 г. Принципиальная схема рефрижератора, использующего эффект растворения, дана на рис. 2.19.
Почти чистый газообразный 3Не из вакуумного насоса 1 при р = 5 ... 6 кПа направляется в линию прямого потока. Газ последовательно охлаждается жидким гелием до Т = 4,2 К и конденсируется в ванне 2 с 4Не, кипящим при Т » 1,2 ... 0,8 К. Далее 3Не в жидкой фазе проходит капилляр (дроссель) 3, где его давление уменьшается (капилляр определяет расход 3Не) . После этого поток 3Не поступает в змеевик испарительной ванны 4 (Ти » 0,6 ... 0,7 К), где охлаждается, затем идет в теплообменник 5, в котором вновь охлаждается обратным потоком до температуры Тi, после чего поступает в смесительную ванну 6.
В смесительной ванне происходит расслоение фаз: почти чистый 3Не располагается в верхней части, а внизу концентрируется слабый раствор 3Не - 4He (»6,4 %3Не) Переход 3Не из верхней концентрированной фазы в раствор сопровождается ростом энтропии и, соответственно, поглощением теплоты; в адиабатных условиях это приводит к снижению температуры, а в изотермических — обеспечивает холодопроизводительность Q.
Из смесительной ванны обратный поток 3Не через теплообменник направляется в испарительную ванну. При этом 3Не в теплообменнике движется через почти стационарный столб 4He, охлаждая прямой поток, поступающий в смесительную ванну.
Температура в испарителе выше, чем в смесителе, и соответствующая равновесная концентрация 3Не составляет 1%, однако, давление паров 3Не (при температуре в испарителе 0,6 К) примерно в 1000 раз выше, чем у 4He; в результате из этой ванны испаряется почти чистый 3Не . Давление 3Не в испарителе около 10 Па обеспечивается откачкой вакуумным насосом. Таким образом осуществляется непрерывный замкнутый цикл рефрижератора. Температурный уровень в смесительной ванне обычно поддерживается в интервале 0,1—0,01 К. Минимально достигнутая температура в таких рефрижераторах составляет 0,002 К. Движение из смесительной ванны в испарительную (обратный поток в теплообменнике) обусловлено разностью осмотических давлений в этих двух ваннах.
Для определения холодопроизводительности Q надо знать разность энтальпии потока 3Не при входе в смесительную ванну i03(Тi.) и после процесса растворения i3 (m, t); тогда количество теплоты, поглощенной в процессе растворения,
Q = n3 [i3(м,т) – i03(Ti)], (2.44)
где n3 — расход циркулирующего 3Не
В рефрижераторах используют различные конструкции теплообменников: трубчатые противоточные аппараты , теплообменники, заполненные медным или серебряным порошком , и другие типы аппаратов, в частности, состоящие из трех — пяти отдельных ступеней.
На эффективность процесса влияют также осевая теплопроводность, теплоприток из окружающей среды, вязкостный нагрев при течении 3Не . Влияние потерь приводит к тому, что реальный эффект охлаждения при Т — 0,1K в 3—5 раз меньше теоретического. Холодопроизводительность таких рефрижераторов обычно составляет 0,2 мВт при Т = 0,1 К и снижается до 0,01 мВт при Т = 0,04 К. Минимально достигнутая температура 0,002 К.
Несомненно, что рефрижераторы растворения будут постоянно совершенствовать и широко применять в научных исследованиях. Непрерывность действия этих систем и относительно высокая холодопроизводительность обеспечивают их преимущество по сравнению с адиабатным размагничиванием. Есть основания полагать, что этот метод позволит применить сверхнизкие температуры и для технических целей.
Охлаждение адиабатной кристаллизацией (эффект Померанчука). В 1950 г.
И. Я. Померанчук предложил метод охлаждения, основанный на особых свойствах изотопа 3Не. Кривая плавления р = f (T), отражающая равновесие жидкой и твердой фаз для 'Не, имеет совершенно особый характер по сравнению с остальными веществами . При температуре 0,32 К и равновесном давлении 2,93 МПа кривая плавления 3Не имеет минимум. В этой точке энтропии твердой и жидкой фаз одинаковы. При дальнейшем снижении температуры ход изменения энтропии обеих фаз определяется особыми квантово-механическими свойствами 3Не . В обычных системах энтропия жидкости всегда больше энтропии кристалла, поскольку в кристалле упорядоченность выше. В 3Не при Т < 0,32 К энтропия твердой фазы, наоборот, больше энтропии жидкости, которая имеет более высокую упорядоченность. Вследствие этого переход жидкость—кристалл в результате сжатия при Т = const сопровождается скачком энтропии и поглощением теплоты Q. Кроме того, этот переход при адиабатных условиях (s= const) приводит к снижению температуры.
На рис. 2.20. дана диаграмма Т — s для 3Не при Т < 0.32К, где показан процесс охлаждения адиабатным сжатием.
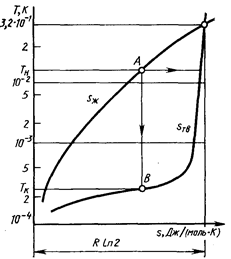
Рис. 2.20. Диаграмма Т—s 3Не для кривой плавления (Sж и Stb—энтропии жидкой и твердой фаз)
Полный процесс включает два этапа: а) предварительное ожижение ЗHe и начальное охлаждение его ниже 0,32 К, что обеспечивает состояние с более низкой энтропией, чем в твердой фазе при той же температуре (точка A); б) кристаллизация ЗHe изоэнтропным сжатием жидкости (процесс АВ), в результате которого температура падает на
DТ= Тн — Тк. Теплоту, поглощаемую при изотермическом сжатии, можно определить как теплоту фазового перехода Q= Т (Stb — Sж). Энтропия твердого 3Не при Т < 0,32 К
примерно постоянна (Stb » R In 2). Характер изменения энтропии жидкости при Т < 0,025 близок к линейному (Sж » 4,6 RT); тогда количество поглощенной теплоты
Q = T Ds = RT ( ln 2 - 4,6 Т). (2.45)
Очевидно, что холодопроизводительность здесь выше, чем у рефрижераторов растворения, где она падает пропорционально Т2. Изменение DT можно непосредственно определить по диаграмме Т — s. Потери в этом процессе связаны с выделением теплоты трения при сжатии; это определяет основные технические трудности при реализации метода. Рассмотренный метод получил практическое подтверждение и эффективен для получения сверхнизких температур в интервале 0,01—0,002 К.
2.13. РАЗЛИЧНЫЕ ПРОЦЕССЫ ОХЛАЖДЕНИЯ
Наряду с рассмотренными процессами возможны и другие, основанные на использовании различных сред и различных эффектов.
При использовании любого процесса охлаждения обязательным условием является наличие термодинамической системы, энтропию которой можно значительно изменить за счет изменения некоторого параметра состояния X:
s= f(T, X) . (2.46)
Так, для термомеханической системы Х — это давление р, для магнитной — напряженность поля Н, для рефрижератора растворения — концентрация раствора х (химический потенциал m), для термоэлектрической системы — плотность электронов (ферми-газа) в проводниках и др.
Изменение энтропии обеспечивает поглощение теплоты Q, т. е. холодопроизводительность. В общем случае для обратимого процесса dQ = Tds; для изотермического процесса (Т = const)
Q = TDs, (2.47)
где Ds = sh —sу ( sh— высокое значение энтропии, соответствующее неупорядоченному состоянию рабочей среды, sу — низкое значение энтропии, соответствующее упорядоченному состоянию).
Так, при испарении жидкости энтропия пара (sh) значительно больше энтропии жидкости
( sу ); то же относится к сжатому и расширенному газам. Существенно меняется Ds = f (DH) для парамагнетиков . В рефрижераторе растворения энтропия для раствора ЗHe существенно выше, чем для чистой жидкости. Энтропия для адсорбированного газа значительно меньше, чем для десорбированного.
Таким образом, возможна реализация процесса охлаждения в самых различных термодинамических системах, для которых существует возможность изменения энтропии (неупорядоченное — упорядоченное состояние микрочастиц) за счет воздействия на систему обобщенной силы X. Некоторые из систем такого рода, не нашедшие пока практического применения, кратко рассмотрены ниже.
Электрокалорический эффект охлаждения (ЭК). Этот процесс охлаждения во многом аналогичен рассмотренному ранее магнитокалорическому . Рабочей средой в ЭК- системе является класс диэлектриков со значительной зависимостью дипольного электрического момента Р от напряженности Е электрического поля, называемых сегнетоэлектриками. Диаграмма Т — s для такой системы соответствует рис. 2.12, где вместо напряженности Н магнитного поля фигурирует напряженность Е электрического поля. Рабочей средой на микро уровне являются электрические диполи (ионы), способные изменять ориентацию (энтропию) в зависимости от напряженности Е приложенного электрического поля, выполняющего в данном случае функции обобщенной силы X. В соответствии с первым началом термодинамики для диэлектрика
du = Tds+ EdP. (2.48)
Отсюда можно получить выражение для электрокалорического коэффициента в адиабатном процессе
aэ = (¶Т/¶Е)s = - (Т/се) (¶Р/¶Т)Е , (2.49)
где сЕ — теплоемкость при Е = const.
Процесс охлаждения в такой системе осуществляют изотермической поляризацией сегнетоэлектрика путем наложения поля напряженностью E с отводом теплоты. В итоге энтропия снижается, и последующее изоэнтропное уменьшение Е определяет падение температуры DT. Преимуществом метода является то, что создание электрического поля технически легко выполнимо; эффект может быть реализован в широком интервале температур от 0 до 300 К. Максимум эффекта находится вблизи точки Кюри; так, для КН2Р04 Ткюри = 122 К. Однако, DТ мало и не превышает 0,5—1 К при изменении Е в интервале 0—4 МВ/м. Предполагают, что в ряде случаев такие системы могут быть эффективны.
Термомагнитное охлаждение основано на эффекте Эттингсхаузена (1886г.) и реализуется следующим образом. Вдоль полюсов магнита помещают полупроводниковый стержень (брусок), к торцам которого подводят электрический ток. Взаимодействие электрического и магнитного полей приводит к возникновению в стержне разности температур вдоль вертикальной оси, перпендикулярной к направлению тока и магнитного поля. У нижней грани стержня образуются пары электрон — дырка с поглощением теплоты Qx, у верхней грани происходит рекомбинация пар с выделением теплоты Qo . Наилучший материал для такой системы висмут—сурьма (3 % Sb); эффект охлаждения DT составляет 10 К и более.
Намагничивание сверхпроводников. Переход металла из нормального в сверхпроводящее состояние сопровождается уменьшением энтропии, так как при этом упорядочивается электронная структура . Очевидно, что обратный процесс — снижение упорядоченности — приведет к поглощению теплоты. Такую систему можно использовать для охлаждения, реализуемого следующим образом. Образец предварительно охлаждают до температуры Tн, которая ниже температуры перехода в сверхпроводящее состояние Тc. После этого образец адиабатически изолируют и накладывают внешнее магнитное поле напряженностью Н, что приводит к его изоэнтропному переходу в нормальное состояние. Так как теплота поглощается от массы самого образца, то он охлаждается на DT = Тн — Тк.
Метод можно осуществлять только при Т < Тс, т. е. в интервале 0—20 К; однако, его эффективность мала, так как теплоемкость твердых тел при таких температурах очень низкая.
Механокалорический эффект. При обсуждении свойств жидкого Не II отмечено, что его поведение качественно хорошо объяснять с использованием «двухжидкостной» модели, предусматривающей существование нормальной и сверхтекучей компонент в жидкости. Поскольку сверхтекучая компонента не имеет вязкости, она проходит свободно через тонкий капилляр, соединяющий два объема с Не II. В то же время вязкая нормальная составляющая через капилляр не проходит и как бы отфильтровывается. В результате происходит разделение HeII на две жидкости — одна богата сверхтекучей составляющей, другая — нормальной.
Так как энтропия сверхтекучей компоненты равна нулю, то тонкий капилляр должен действовать как «энтропийный фильтр», не пропускающий вязкую нормальную составляющую. В результате происходит понижение температуры после фильтра, обусловленное тем, что энтропия сверхтекучей составляющей, прошедшей через фильтр, близка к нулю. Этот эффект впервые обнаружен П. Капицей и получил дальнейшее экспериментальное подтверждение.
Охлаждение смешением. Тепловой эффект смешения также можно использовать для охлаждения. Ранее такой метод рассмотрен применительно к растворам квантовых жидкостей 3Не — 4Не. Процесс смешения необратим, поэтому энтропия смеси обычно больше суммы энтропии отдельных компонентов. Так, при смешении компонентов идеального газа дополнительное возрастание энтропии (энтропия смешения)
DSсм = -R S ( xi ln xi), (2.50)
где xi— концентрация i-го компонента.
В данном случае концентрация является обобщенной силой, приводящей к изменению энтропии системы. Смешение в изотермических условиях приводит к поглощению теплоты, в адиабатных — к снижению температуры. В процессе смешения могут участвовать газы, жидкости, твердые тела. Классический пример охлаждения смешением — снижение температуры в смеси поваренной соли и воды (льда). Смешение соли со льдом и образование раствора, содержащего 21 % NaCI, приводит к снижению температуры от 273 до 252 К. Учитывая необратимость процесса смешения и необходимость последующего разделения смеси при возвращении компонентов в исходное состояние, трудно рассчитывать на высокую эффективность метода. В то же время в ряде случаев он может оказаться достаточно экономичным и целесообразным, например, для одноразового охлаждения. Расчетные оценки показывают, что при смешении газов с сильно отличающимися критическими параметрами получают наибольший эффект охлаждения. Так, для смеси метан—гелий при T = 200 К и р » 10 МПа снижение температуры DT= 50 К; КПД процесса достигает 50 %.
Деформация упругой среды. Упругая деформация (сжатие — растяжение) — обратимый процесс, который в принципе можно использовать для охлаждения. Основное уравнение термодинамики для упругого стержня можно представить так:
Tds = du—y dl, (2.51)
Обратите внимание на лекцию "12 Эстетика возрождения".
где y — сила, действующая на стержень; l — линейный размер.
Применив общие соотношения термодинамики к такой системе, можно вычислить ее энтропию, энергию и другие характеристики, а также конечное изменение температуры при адиабатной деформации
DT = -a Tср s/(cr), (2.52)
где a — температурный коэффициент линейного расширения материала стержня; Tcр — средняя температура; s — напряжение; с — теплоёмкость; r — плотность.
Так как T, с и r положительны, то знак DT определяется знаками s и a. Напряжение положительно при растяжении и отрицательно при сжатии. Обычно a > 0, и лишь для резины a < 0.
Это исключение касается и энтропии, которая обычно возрастает при изотермической деформации, а у резины уменьшается, так как ее длинные молекулярные цепи упорядочиваются при растяжении. Таким образом, металлические стержни при растяжении охлаждаются, резина нагревается. Этот эффект у металлов невелик. Так, для стали D T = 0,16 К при s = 200 МПа, для резины D T достигает 8 К.























