Атом водорода
Лекция 4 (13)
4. Атом водорода
План лекции :
Строение и линейчатые спектры водородоподобных системи
1. Модели Атома Томсона и Резерфорда.
1.Ядерная модель атома:
- прицельный параметр;
- формула Резерфорда;
- эффективное сечение;
Рекомендуемые материалы
- проверка формулы Резерфорда.
2.Постулаты Бора. Опыты Франка и Герца
3.Боровская модель атома водорода
4. Магнитный момент атома водорода
4.1. Модели Атома Томсона и Резерфорда.
Античные времена Представление об атомах как неделимых мельчайших частицах вещества («атомос» — неразложимый) возникло еще в античные времена (Демокрит, Эпикур, Лукреций).
К началу XVIII в. атомистическая теория приобретает все большую популярность, так как к этому времени в работах А.Лавуазье (французский химик), М.В.Ломоносова и Д.Дальтона была доказана реальность существования атомов. Однако в это время вопрос о внутреннем строении атомов даже не возникал, так как атомы по-прежнему считались неделимыми.
XIX в Большую роль в развитии атомистической теории сыграл Д.И. Менделеев, разработавший в 1869 г. Периодическую систему элементов, в которой впервые на научной основе был поставлен вопрос о единой природе атомов. Во второй половине XIX в. экспериментально было доказано, что электрон является одной из основных составных частей любого вещества. Эти выводы, а также экспериментальные данные привели к тому, что в начале XX в. серьезно встал вопрос о строении атома.
XX в.
Первая попытка создания на основе накопленных экспериментальных данных модели атома принадлежит Дж. Дж.Томсону (1903). Согласно этой модели, атом представляет собой непрерывно заряженный положительным зарядом шар радиусом порядка 10-10 м, внутри которого около своих положений равновесия колеблются электроны; суммарный отрицательный заряд электронов равен положительному заряду шара, поэтому атом в целом нейтрален. Через несколько лет было доказано, что представление о непрерывно распределенном внутри атома положительном заряде ошибочно.
В развитии представлений о строении атома велико значение опытов английского физика Э. Резерфорда (1871 -1937) по рассеянию α-частиц в веществе. Альфа-частицы возникают при радиоактивных превращениях; они являются положительно заряженными частицами с зарядом 2е и массой, примерно в 7300 раз большей массы электрона. Пучки α-частиц обладают высокой монохроматичностью [для данного превращения имеют практически одну и ту же скорость (порядка 107 м/с)]
Э. Резерфорд, исследуя прохождение α-частиц в веществе (через золотую фольгу толщиной примерно 1 мкм), показал, что основная их часть испытывает незначительные отклонения, но некоторые α-частицы (примерно одна из 20 000) резко отклоняются от первоначального направления (углы отклонения достигали даже 180°). Так как электроны не могут существенно изменить движение столь тяжелых и быстрых частиц, как α-частицы, то Резерфордом был сделан вывод, что значительное отклонение α -частиц обусловлено их взаимодействием с положительным зарядом большой массы. Однако значительное отклонение испытывают лишь немногие α-частицы; следовательно, лишь некоторые из них проходят вблизи данного положительного заряда. Это, в свою очередь, означает, что положительный заряд атома сосредоточен в объеме, очень малом по сравнению с объемом атома.
На основании своих исследований Резерфорд в 1911 г. предложил ядерную (планетарную) модель атома. Согласно этой модели, вокруг положительного ядра, имеющего заряд Ze (Z— порядковый номер элемента в системе Менделеева, е — элементарный заряд), размер 10-15—10-14 м и массу, практически равную массе атома, в области с линейными размерами порядка 10-10 м по замкнутым орбитам движутся электроны, образуя электронную оболочку атома. Так как атомы нейтральны, то заряд ядра равен суммарному заряду электронов, т.е. вокруг ядра должно вращаться Z электронов.
Для простоты предположим, что электрон движется вокруг ядра по круговой орбите радиусом r При этом кулоновская сила взаимодействия между ядром и электроном сообщает электрону нормальное ускорение. Уравнение, описывающее движение электрона в атоме по окружности под действием кулоновской силы:
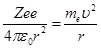
где е0 — электрическая постоянная;  — масса и скорость электрона на орбите радиусом r.
— масса и скорость электрона на орбите радиусом r.
Уравнение содержит два неизвестных: r и υ. Следовательно, существует бесчисленное множество значений радиуса и соответствующих ему значений скорости (а значит, и энергии), удовлетворяющих этому уравнению. Поэтому величины r, υ (следовательно, и Е) могут меняться непрерывно, т. е. может испускаться любая, а не вполне определенная порция энергии. Тогда спектры атомов должны быть сплошными. В действительности же опыт показывает, что атомы имеют линейчатый спектр.
Из выражения следует, что при  м скорость движения электронов
м скорость движения электронов  м/с, а ускорение
м/с, а ускорение  м/с2.
м/с2.
Согласно классической электродинамике, ускоренно движущиеся электроны должны излучать электромагнитные волны и вследствие этого непрерывно терять энергию. В результате электроны будут приближаться к ядру и в конце концов упадут на него. Таким образом, атом Резерфорда оказывается неустойчивой системой, что опять-таки противоречит действительности.
Попытки построить модель атома в рамках классической физики не привели к успеху:
· модель Томсона была опровергнута опытами Резерфорда,
· ядерная же модель оказалась неустойчивой электродинамически и противоречила опытным данным.
Преодоление возникших трудностей потребовало создания качественно новой — квантовой — теории атома.
4.1.Ядерная модель атома
· Любой атом состоит из положительно заряженного ядра и окружающей его электронной оболочки.
· Размеры ядра менее 10-12 см, размеры же самого атома, определяемые электронной оболочкой, порядка 10-8 см, т. е. в десятки тысяч раз больше размеров ядра.
· При этом практически вся масса атома сосредоточена в ядре.
Если все это так, то атом должен быть в высокой степени прозрачным для пронизывающих его частиц.
Экспериментальное доказательство изложенной модели атома было дано Резерфордом (1911) с помощью рассеяния α- частиц (ядер атомов 42Не) тонкой металлической фольгой.
Было обнаружено,
§ что подавляющее число α- частиц рассеивалось на небольшие углы (не больше ~ 3°).
§ вместе с тем наблюдались также отдельные α- частицы, рассеянные на большие утлы.
Относительно последних Резерфорд сделал вывод, что такие частицы появляются в результате единичного акта их взаимодействия с ядром атома.
Формула Резерфорда
Исходя из предположений, что взаимодействие указанных α-частиц с ядром является кулоновским, а заряд и масса ядра локализованы в очень малой области атома, Резерфорд разработал количественную теорию рассеяния α-частиц и вывел формулу для распределения рассеянных α-частиц в зависимости от угла отклонения θ.
В своих рассуждениях Резерфорд принимал во внимание рассеяние α-частиц только на ядрах, поскольку заметного отклонения α-частиц электронами не может быть из-за того, что масса электронов на четыре порядка меньше массы α-частиц.
Когда α-частица пролетает вблизи ядра,
· ее траектория представляет собой гиперболу,
· причем угол отклонения α-частицы — угол θ — равен углу между асимптотами гиперболы (рис.1).
Для угла θ было получено выражение (вывод в Иродове , см. приложение)
 , (4.1)
, (4.1)
 где q и q0 — заряды налетающей частицы и ядра,
где q и q0 — заряды налетающей частицы и ядра,
b — прицелъный параметр, т. е. расстояние от ядра до первоначального направления движения налетающей частицы, когда она находится вдали от ядра (см. рис. 4.1),
 — кинетическая энергия частицы вдали от ядра.
— кинетическая энергия частицы вдали от ядра.
Из формулы (4.1) видно, что чем меньше прицельный параметр b, тем больше угол отклонения θ.
Непосредственная проверка формулы (4.1) экспериментально невозможна, поскольку мы не можем измерить прицельный параметр b налетающей частицы. Однако, следуя Резерфорду, мы можем положить формулу (4.1) в основу для следующих расчетов.
Рассмотрим тонкий слой рассеивающего вещества,
· настолько тонкий (фольга), чтобы каждая налетающая частица пучка претерпевала лишь однократное отклонение.
· Для отклонения в интервале углов (θ, θ+dθ) прицельный параметр должен быть заключен в интервале (b, ,b+db).
· При этом значения dθ и db будут связаны определенным соотношением.
Чтобы найти его, перепишем сначала (4.1) в виде
 (4.2)
(4.2)
а затем возьмем дифференциал от этого выражения

 (4.3)
(4.3)
 Знак «минус» в этом выражении обусловлен тем, что знаки db и dθ взаимно противоположны.
Знак «минус» в этом выражении обусловлен тем, что знаки db и dθ взаимно противоположны.
В дальнейшем существенным будет лишь модуль величин db и dθ, поэтому знак минус в (4.3) мы не будем учитывать.
Пусть
· площадь поперечного сечения узкого пучка налетающих частиц равна S.
· Тогда число ядер рассеивающего тонкого слоя будет равно nS,
где n — число ядер (атомов) в расчете на единицу поверхности.
При этом относительное число частиц,
- имеющих прицельный параметр b в интервале (b,b+db) и, значит,
- рассеянных в интервале углов (θ,θ+dθ), будет равно (рис.4. 2)
 (4.4)
(4.4)
где dS — суммарная площадь колец в сечении S пучка,
dN — поток частиц, рассеянных в интервале углов (θ,θ+dθ),
N — поток падающих частиц в пучке.
Подставив в (4.4) выражения для b и db из (4.2) и (4.3), получим:
 (4.5)
(4.5)
Умножим числитель и знаменатель правой части этого равенства на sin(θ/2). Тогда
 (4.6)
(4.6)
где выражение 2π sinθ dθ — это телесный угол dΩ, в пределах которого заключены углы рассеяния (θ,θ+dθ). Поэтому (4.6) можно переписать так:
 (4.7),
(4.7),
где п— число ядер на единицу поверхности рассеивающего слоя (фольги).
Это и есть формула Резерфорда. Она определяет относительное число частиц, рассеянных в телесном угле dΩ под углом θ к первоначальному направлению их движения.
Если нас интересует относительное число ∆N/N частиц в конечном интервале углов от θ1 до θ2, то выражение (4.7) надо проинтегрировать, учитывая, что
dΩ=2π sinθ dθ.
При этом следует иметь в виду, что для малых углов рассеяния (приблизительно меньших 3°) формула Резерфорда не применима. Это связано с тем, что очень малым углам соответствуют большие значения прицельного параметра, выходящие за пределы атома, где сила уже не имеет кулоновского характера.
Формула Резерфорда позволяет:
§ По измеренному числу α –частиц рассеянных под некоторым углом θ, определить число элементарных положительных зарядов, содержащихся в ядре атомов данной рассеивающей фольги. Это число равно порядковому номеру элемента в периодической системе Менделеева.
§ позволила установить физический смысл порядкового номера в периодической системе Меделеева.
Эффективное сечение.
Формулу Резерфорда (4.7) можно представить в несколько ином виде, если ввести понятие дифференциального сечения dσ, равного площади кольца радиусом b и шириной db (см. рис.4. 2).
Имея прицельные параметры в интервале (b,b+db), налетающие частицы отклоняются ядрами согласно (4.1) на углы в интервале (θ,θ+dθ). Поскольку
 (4.8)
(4.8)
формулу (4.7) можно представить так:
 (4.9)
(4.9)
где дифференциальное эффективное сечение
 (4.10)
(4.10)
Таким образом, формула (4.9) означает, что относительное число частиц, рассеянных в интервале углов (θ,θ+dθ), равно произведению количества ядер на единицу поверхности фольги (n) на соответствующее дифференциальное сечение (4.10).
Проверка формулы Резерфорда. Формула (4.7) была подтверждена экспериментально.
§  В качестве налетающих частиц использовали α-частицы (их заряд q = 2e) от радиоактивного источника.
В качестве налетающих частиц использовали α-частицы (их заряд q = 2e) от радиоактивного источника.
§ Кинетическая энергия α-частиц была порядка нескольких МэВ.
§ Если зафиксировать телесный угол dΩ, в котором подсчитывают рассеянные α-частицы, и менять при этом угол θ (рис.4.3), то из формулы (4.7) следует, что
dN • sin4(θ/2) = const.
На опыте было
- проверено соблюдение именно этого условия. ,
- доказано, что формула (4.7) правильно описывает процесс рассеяния α-частиц.
Опыты, подтверждающие формулу Резерфорда , могут рассматриваться
§ как косвенное доказательство справедливости закона Кулона на весьма малых расстояниях (от 10-12 до 10-9 см)
§ свидетельствуют в пользу предположения, что масса атома практически сосредоточена в очень малой области – в ядре, размеры которого не превышают 10-12 см.
Результаты опытов по рассеянию  - частиц говорят в пользу ядерной (планетарной) модели атома, предложенной Резерфордом. Однако она оказалась в резком противоречии с законами классической электродинамики.
- частиц говорят в пользу ядерной (планетарной) модели атома, предложенной Резерфордом. Однако она оказалась в резком противоречии с законами классической электродинамики.
Применение классической электродинамики к ядерной модели атома привело к полному противоречию с экспериментальными фактами. Согласно классической теории, должны иметь место:
а) непрерывная потеря электроном энергии в виде излучения электромагнитных волн и неустойчивости атома.
б) существование только непрерывного спектра. Спектральных линий не должно быть.
В действительности оказывается, что:
а) атом является устойчивой системой;
б) атом излучает энергию лишь при определенных условиях;
в) излучение атома имеет линейчатый спектр, связанный со строением и свойствами его электронной оболочки.
4.3. Спектральные закономерности.
Исследования спектров излучения разреженных газов (спектров излучения отдельных атомов) показали, что каждому газу присущ определенный линейчатый спектр, состоящий из отдельных спектральных линий или групп близко расположенных линий. В соответствии с законом Кирхгофа спектры поглощения газов также имеют линейчатую структуру.
Наличие многих спектральных линий указывает на сложность внутреннего строения атома. Изучая линейчатый спектр атомарного водорода, Бальмер (швейцарский ученый,1825 – 1898) подобрал эмпирическую формулу, описывающую все известные в то время спектральные линии атома водорода в видимой области спектра, установил закономерность:
 , (4.11)
, (4.11)
 Где ω – циклическая частота, соответствующая каждой спектральной линии
Где ω – циклическая частота, соответствующая каждой спектральной линии  ,
,
R- постоянная Ридберга 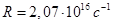
Формула (4.11) называют формулой Бальмера, а соответствующую серию спектральных линий – серия Бальмера.
Основные линии этой серии находятся в видимой части спектра.
В настоящее время известно большое число линий в спектре водорода , длины волн которых укладываются в формулу Бальмера. Если учесть большую точность спектроскопических измерений , то следует признать, что формула Бальмера принадлежит к числу наиболее точных закономерностей в физике.
Дальнейшие исследования спектра атомарного водорода показали, что имеется еще несколько серий.
§ В ультрафиолетовой части спектра – серия Лаймана:
 (4.12)
(4.12)
§ В инфракрасной части спектра – серия Пашена:
 , (4.13)
, (4.13)
а также серии Брэкета и Пфунда.
Все эти серии можно представить в виде обобщенной формулы Бальмера:

n0 =1 – серия Лаймана,
n0 =2 – серия Бальмера
n0 =3 – серия Пашена и т.д.
n= n0+1, При заданном n0 число n принимает все целочисленные значения с n0+1.
Максимальной длине волны серии Лаймана отвечает n=2 , это  . Соответствующую спектральную линию называют резонансной линией водорода.
. Соответствующую спектральную линию называют резонансной линией водорода.
С ростом n частота линий в каждой серии стремится к предельному значению  , которое называют границей серии. За границей серии спектр не обрывается, а становится сплошным. Т.е. линии серии сближаются, значение
, которое называют границей серии. За границей серии спектр не обрывается, а становится сплошным. Т.е. линии серии сближаются, значение  определяет границу серии. Это присуще не только атомам водорода, но и атомам других элементов.
определяет границу серии. Это присуще не только атомам водорода, но и атомам других элементов.
Пример: найдем спектральный интервал, в пределах которого расположены серии Бальмера атомарного водорода (в длинах волн).
Границы данного интервала – головная линия серии,  ,соответствующая n =3 в формуле(4.11)и граница серии,
,соответствующая n =3 в формуле(4.11)и граница серии,  (
( ).
).
Имея в виду, что частота связана с длиной волны , получим
, получим

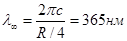
Приведенные выше сериальные формулы подобраны эмпирически и долгое время не имели теоретического обоснования, хотя и были подтверждены экспериментально с очень большой точностью.
4.2.Постулаты Бора. Опыты Франка и Герца
Первая попытка построить качественно новую – квантовую – теорию атома была впервые в 1913 г. датским физиком Нильсом Бором. Абсолютная неустойчивость планетарной модели Резерфорда и вместе с тем удивительная закономерность атомных спектров, и в частности их дискретность, привели Н. Бора к необходимости сформулировать (1913) два важнейших постулата квантовой физики. Он поставил перед собой цель связать в единое целое эмпирические закономерности линейчатых спектров, ядерную модель атома Резерфорда и квантовый характер излучения и поглощения света.
Постулаты Бора.
1. Первый постулат (постулат стационарных состояний): Атом может длительное время находиться только в определенных, так называемых стационарных состояниях, которые характеризуются дискретными значениями энергии E1, E2, Е3, ... В этих состояниях, вопреки классической электродинамике, атом не излучает.
Стационарным состояниям атома соответствуют стационарные орбиты, по которым движутся электроны.
Правило квантования орбит Бора: в стационарном состоянии атома электрон, двигаясь по круговой орбите, должен иметь дискретные квантованные значения момента импульса, удовлетворяющие условию:
 ,
,
Где  - масса электрона,
- масса электрона,
 - его скорость по n-ой орбите радиуса
- его скорость по n-ой орбите радиуса 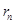
Целое число n равно числу длин волн де Бройля для электрона, укладывающихся на длине круговой орбиты. Учитывая формулу длины волны де Бройля можно найти отношение длины окружности к длине волны де Бройля:
 .
.
2. Второй постулат (правило частот): при переходе атома из стационарного состояния с большей энергией E2 в стационарное состояние с меньшей энергией E1 происходит излучение кванта света (фотона) с энергией ħω:
ħω =E2-E1. (4.11)
· При  происходит излучение фотона,
происходит излучение фотона,
· При  происходит поглощение фотона
происходит поглощение фотона
Такое же соотношение выполняется и в случае поглощения, когда падающий фотон переводит атом с низшего энергетического уровня E1 на более высокий E2, а сам исчезает.
Соотношение (4.11) называют правилом частот Бора.
Заметим, что переходы атома на более высокие энергетические уровни могут быть обусловлены и столкновением с другими атомами.
Таким образом, атом переходит из одного стационарного состояния в другое скачками (их называют квантовыми). Что происходит с атомом в процессе перехода — этот вопрос в теории Бора остается открытым.
Опыты Франка и Герца (1913) дали прямое доказательство дискретности атомных состояний изучая методом задерживающего потенциала столкновения электронов с атомами газов .
Идея опытов заключается в следующем.
§ При неупругих столкновениях электрона с атомом происходит передача энергии от электрона атому.
§ Если внутренняя энергия атома изменяется непрерывно, то атому может быть передана любая порция энергии.
§ Если же состояния атома дискретны, то его внутренняя энергия при столкновении с электроном должна изменяться также дискретно — на значения, равные разности внутренней энергии атома в стационарных состояниях.
Следовательно, при неупругом столкновении электрон может передать атому лишь определенные порции энергии. Измеряя их, можно определить значения внутренних энергий стационарных состояний атома.
 Это и предстояло проверить экспериментально с помощью установки, схема которой показана на рис.4. 4.
Это и предстояло проверить экспериментально с помощью установки, схема которой показана на рис.4. 4.
§ В баллоне с парами ртути под давлением порядка 1 мм.рт.ст. (~ 130 Па) имелись три электрода:
К — катод, С — сетка и А — анод.
§ Электроны, испускаемые горячим катодом вследствие термоэлектронной эмиссии, ускорялись разностью потенциалов U между катодом и сеткой. Величину U можно было плавно менять.
§ Между сеткой и анодом создавалось слабое тормозящее поле с разностью потенциалов около 0,5В. Таким образом, если какой-то электрон проходит сквозь сетку с энергией, меньшей 0,5 эВ, то он не долетит до анода. Только те электроны, энергия которых при прохождении сетки больше 0,5 эВ, попадут на анод, образуя анодный ток I, доступный измерению.
 В опытах (см. рис. 4.4) исследовалась зависимость анодного тока I (гальванометром G) от ускоряющего напряжения U (вольтметром V).
В опытах (см. рис. 4.4) исследовалась зависимость анодного тока I (гальванометром G) от ускоряющего напряжения U (вольтметром V).
Полученные результаты представлены на рис.4. 5.
§ Максимумы соответствуют значениям энергии
Е1 = 4,9 эВ, Е2 = 2Е1, Е3 = ЗЕ1 и т. д.
Такой вид кривой объясняется тем, что атомы действительно могут поглощать лишь дискретные порции энергии, равные 4,9 эВ.
§ При энергии электронов, меньшей 4,9 эВ, их столкновения с атомами ртути могут быть только упругими (без изменения внутренней энергии атомов), и электроны достигают сетки с энергией, достаточной для преодоления тормозящей разности потенциалов между сеткой и анодом. Когда же ускоряющее напряжение U становится равным 4,9 В, электроны начинают испытывать вблизи сетки неупругие столкновения, отдавая атомам ртути всю энергию, и уже не смогут преодолеть тормозящую разность потенциалов в пространстве за сеткой. Значит, на анод А могут попасть только те электроны, которые не испытали неупругого столкновения. Поэтому, начиная с ускоряющего напряжения 4,9 В, анодный ток I будет уменьшаться.
§ При дальнейшем росте ускоряющего напряжения достаточное число электронов после неупругого столкновения успевает приобрести энергию, необходимую для преодоления тормозящего поля за сеткой. Начинается новое возрастание силы тока I. Когда ускоряющее напряжение увеличится до 9,8 В, электроны после одного неупругого столкновения достигают сетки с энергией 4,9 эВ, достаточной для второго неупругого столкновения. При втором неупругом столкновении электроны теряют всю свою энергию и не достигают анода. Поэтому анодный ток I начинает опять уменьшаться (второй максимум на рис. 4.5).
§ Аналогично объясняются и последующие максимумы.
Из результатов опытов следует, что разница внутренних энергий основного состояния атома ртути и ближайшего возбужденного состояния равна 4,9 эВ, что и доказывает дискретность внутренней энергии атома.
Аналогичные опыты были проведены в дальнейшем с атомами других газов. И для них были получены характерные разности потенциалов, их называют резонансными потенциалами или первыми потенциалами возбуждения. Резонансный потенциал соответствует переходу атома с основного состояния в ближайшее возбужденное. Для обнаружения более высоких возбужденных состояний была использована более совершенная методика, однако принцип исследования оставался тем же.
Итак, все опыты такого рода приводят к заключению, что состояния атомов изменяются лишь дискретно.
Опыты Франка и Герца подтверждают также и второй постулат Бора — правило частот. Оказывается, что при достижении ускоряющего напряжения 4,9 В пары ртути начинают испускать ультрафиолетовое излучение с длиной волны 253,7 нм. Это излучение связано с переходом атомов ртути из первого возбужденного состояния в основное. Действительно, из условия (4.11) следует, что
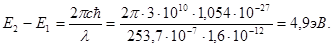
Этот результат хорошо согласуется с предыдущими измерениями.
4.3.Боровская модель атома водорода
Чтобы получить согласие с результатами наблюдений, Бор предположил, что электрон в атоме водорода движется только по тем круговым орбитам, для которых его момент импульса
M=nħ, n=1,2,3,…, (4.12)
где n — квантовое число.
С помощью этого правила квантования можно найти радиусы круговых стационарных орбит водородоподобных систем (Н, Не+, Li++...) и соответствующие им энергии.
Пусть
- заряд ядра водородоподобной системы равен Ze.
- Масса ядра значительно больше массы электрона, поэтому ядро при движении электрона можно считать неподвижным.
Следуя Бору, будем предполагать, что электрон движется вокруг ядра по окружности радиуса r.
Согласно 2-му закону Ньютона
 (4.13)
(4.13)
где m —масса электрона.
Отсюда кинетическая энергия электрона
 (4.14)
(4.14)
и полная энергия электрона в кулоновском поле ядра
 (4.15)
(4.15)
Согласно правилу квантования (4.12),  ,
,
откуда
 (4.16)
(4.16)
После подстановки (4.16) в (4.13) получим
выражение для радиуса n-й стационарной орбиты:
 (4.17)
(4.17)
Радиус первой стационарной орбиты электрона в атоме водорода (n=1, Z=1) равен
 см.
см.
Его называют боровским радиусом.
Энергия Еn, электрона на n-й стационарной орбите определяется формулой (4.15), в которой под r надо понимать (4.17).
И мы приходим к следующему выражению для Еn:
 . (4.18)
. (4.18)
Эта формула описывает уровни энергии стационарных состояний электрона в водородоподобной системе.
 Для атома водорода схема энергетических уровней, соответствующих (4.18), показана на рис.4. 6.
Для атома водорода схема энергетических уровней, соответствующих (4.18), показана на рис.4. 6.
§ При n→∞ уровни энергии сгущаются к своему предельному значению Е∞ = 0.
§ Состояние атома с наименьшей энергией (n = 1) называют основным. Для атома водорода основному состоянию соответствует энергия  = -13,53 эВ.
= -13,53 эВ.
Эта энергия (по модулю) является энергией связи электрона в основном состоянии: ( ). Именно такую энергию надо сообщить электрону в основном состоянии (n = 1), чтобы удалить его из атома водорода.
). Именно такую энергию надо сообщить электрону в основном состоянии (n = 1), чтобы удалить его из атома водорода.
По этой причине ее называют еще и энергией ионизации: Eион=Eсв=13,6эВ.
Это значение, полученное из боровской теории атома, находится в хорошем согласии с результатами эксперимента.
Энергия ионизации связана с потенциалом ионизации  :
:
 ,
,
таким образом,
 ,
,
Где Еn –энергия в некотором стационарном состоянии.
Спектральные серии водородоподобных систем.
Согласно второму постулату Бора (11), определяющему энергию фотонов при переходе системы из одного стационарного состояния в другое, и формуле (4.18) имеем:
 .
.
Частота фотона
 .
.
Таким образом, мы пришли к обобщенной формуле Бальмера ,
установив при этом, от каких величин зависит постоянная Ридберга:
 (4.19)
(4.19)
§ Подстановка в это выражение числовых значений т, е и ħ дает величину, хорошо согласующуюся с экспериментальным значением постоянной Ридберга
§ Индекс ∞ при R означает, что эта величина получена в предположении, что масса ядра весьма велика, и ядро при движении электрона неподвижно.
§ Учет конечности массы ядра приводит к тому, что массу т электрона следует заменить на приведенную массу µ системы электрон- ядро:
µ = тМ/(т + М), где М — масса ядра.
Тогда постоянная Ридберга 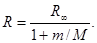
Как видим, постоянная Ридберга зависит и от массы ядра. Для атома водорода, ядром которого является протон, формула (4.19) дает значение, более точно совпадающее с экспериментальным.
Приведенная на рис.4. 6 система энергетических уровней помогает наглядно представить спектральные серии Лаймана, Бальмера и др. как группы переходов между соответствующими уровнями.
Эти переходы изображены на рисунке вертикальными стрелками.
Систему энергетических уровней атома принято называть и иначе — системой термов.
§ Терм Т — это величина, определяемая согласно (4.18) и (4.19) как
 ,
,
где R — постоянная Ридберга.
§ В отличие от энергии Еп, терм — величина положительная, и чем ниже уровень, тем больше его значение.
§ Терм имеет ту же размерность, что и частота ω, т.е. с-1.
§ Соответствующая частота фотона, испущенного при переходе атома из состояния с квантовым числом п1 в состояние с квантовым числом п2, определяется формулой
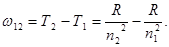
§ Формулы (4.18) и (4.19) позволяют записать выражение для энергии связи (энергии ионизации) водородоподобной системы в основном состоянии в более удобном виде:
 .
.
5.4. Магнитный момент атома водорода.
 Пусть электрон движется со скоростью
Пусть электрон движется со скоростью  по орбите радиусом r (рис.4. 7).
по орбите радиусом r (рис.4. 7).
Через площадку, пересекающую орбиту электрона, переносится ежесекундно заряд  ,
,
где е — заряд электрона,
 — число оборотов электрона вокруг ядра в секунду. Следовательно, движущийся по орбите электрон образует круговой ток
— число оборотов электрона вокруг ядра в секунду. Следовательно, движущийся по орбите электрон образует круговой ток  .
.
Поскольку заряд электрона отрицателен, направление движения электрона противоположно направлению тока.
Магнитный момент такого тока (в гауссовой системе) по определению равен
 , или
, или  .
.
Учитывая, что
 ,
,
перепишем предыдущее выражение в виде
 .
.
Остается учесть, что момент импульса электрона
М = rm ,
,
и мы получим:
 ,
,
где знак «минус» указывает, что направления обоих моментов, μ и М, взаимно противоположны.
Вектор  называют орбитальным моментом электрона.
называют орбитальным моментом электрона.
Он образует с направлением движения электрона правовинтовую систему (см. рис. 4.7).
Отношение магнитного момента частицы к ее механическому моменту называют гиромагнитным отношением.
Для электрона оно равно
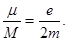
Воспользовавшись боровским правилом квантования момента импульса, получаем
 ,
,
где µБ — это так называемый магнетон Бора:
 .
.
Таким образом, при движении электрона по первой боровской орбите (п=1) его магнитный момент равен одному магнетону Бора.
В дальнейшем мы увидим, что это резко расходится с экспериментом, значит, полученный результат оказывается совершенно неверным. И тем не менее, мы привели формулы, связывающие магнитный момент с механическим, поскольку они послужат основой для получения правильных результатов .
Недостатки теории Бора.
Рекомендация для Вас - Признаки и особенности антикризисного управления.
C Теория Бора явилась крупным шагом в развитии теории атома, в понимании новых квантовых закономерностей, с которыми столкнулась физика при изучении явлений микромира.
C Эта теория отчетливо показала неприменимость законов классической физики для описания внутриатомных явлений.
C Теория Бора стимулировала постановку многих экспериментов, принесших важные результаты. Даже в тех многочисленных случаях, когда теория не могла дать количественное объяснение явлений, два постулата Бора служили руководящей нитью при классификации и количественной интерпретации этих явлений.
Однако двух постулатов Бора недостаточно для построения полной теории. Они должны быть дополнены правилами квантования. Эти правила, достаточно искусственно введенные Бором для одноэлектронного атома, радикально проблемы не решили. Их не удалось распространить даже на простейший после водорода атом гелия, содержащий два электрона. Кроме того, теория Бора позволила вычислить только частоты спектральных линий, но не их интенсивность.
Основной же, принципиальный недостаток теории Бора – это её непоследовательность: она не была ни последовательна классической, ни последовательно квантовой. Эта теория принимала существования стационарных состояний атома, что совершенно непонятно с точки зрения классической физики. И вместе с тем к движению электронов в стационарных состояниях она применяла законы классической механики, хотя и считала неприменимой классическую электродинамику (поскольку нет излучения).
Итак, планетарную модель атома нельзя считать серьёзной теорией. Она просто неверна. Тот факт, что эта модель приводит к очень хорошим результатам в случае атома водорода (при расчете некоторых величин), по существу случайный. Этот успех явился мощным толчком к развитию квантовой теории атома. Сам Бор рассматривал свою теорию как промежуточный этап в поисках верной теории. Такой последовательной теорией явилась квантовая физика.




















