Ядерная модель атома
§ 2.4. Ядерная модель атома.
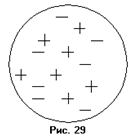
Исторически существовало две признанных модели атома: модель Томпсона и модель Резерфорда.
По модели Томпсона (рис. 35) атом представлял собой непрерывно распределённый в пространстве положительный заряд, в который были вкраплены отдельные отрицательные заряды. Электроны взаимодействуют с элементами положительно заряженной среды атома по закону Кулона. При отклонении электрона от положения равновесия, возникают силы, которые стремятся возвратить его в положение равновесия. Благодаря этому возникают колебания электрона. Колебания электронов обуславливают излучение атомов.
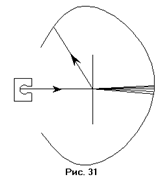
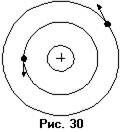
Вторая модель, модель Резерфорда (рис.36), приписывала атому строение, аналогичное строению Солнечной системы: в центре находится положительно заряженное ядро, вокруг которого, подобно планетам, движутся электроны, удерживаемые у ядра силами кулоновского притяжения. Спор между двумя этими теориями разрешил эксперимент, поставленный Резерфордом. Резерфорд изучал движение тяжёлых положительно заряженных частиц в поле, создаваемом атомом. Схема использовавшейся установки приведена на рисунке 31. Узкий пучок  – частиц из источника излучения падала на тонкую золотую фольгу. За фольгой находилась поверхность, покрытая веществом, способным сцинтиллировать, например,
– частиц из источника излучения падала на тонкую золотую фольгу. За фольгой находилась поверхность, покрытая веществом, способным сцинтиллировать, например,  .
.  – частицы пролетали сквозь фольгу и падали на сцинтиллятор. Сцинтиллятор на короткое время начинал светиться в точке падения
– частицы пролетали сквозь фольгу и падали на сцинтиллятор. Сцинтиллятор на короткое время начинал светиться в точке падения  – частиц. За этими вспышками как раз и наблюдали. Если бы взаимодействия частиц с веществом не было, то вспышки наблюдались бы все в одном и том же месте. Тем не менее, большинство частиц отклонялись от направления своего первоначального движения на 3°-5°, и что ещё более интересно, приблизительно одна из 6000 – 8000 частиц отклонялась от первоначального направления движения на угол более 90°. В то же время не было частиц, которые притягивались бы. Это навело Резерфорда на мысль, что в атоме должен находиться мощный силовой центр, который заставляет отклоняться частицы на большие углы, причём, так как заряд
– частиц. За этими вспышками как раз и наблюдали. Если бы взаимодействия частиц с веществом не было, то вспышки наблюдались бы все в одном и том же месте. Тем не менее, большинство частиц отклонялись от направления своего первоначального движения на 3°-5°, и что ещё более интересно, приблизительно одна из 6000 – 8000 частиц отклонялась от первоначального направления движения на угол более 90°. В то же время не было частиц, которые притягивались бы. Это навело Резерфорда на мысль, что в атоме должен находиться мощный силовой центр, который заставляет отклоняться частицы на большие углы, причём, так как заряд  – частицы считался положительным, этот силовой центр также должен быть положительным. Редкость отскакивания частицы на угол более 90° говорила о том, что центр должен быть точечным. Итак, по Резерфорду получалось, что в центре атома существует нечто, обладающее большой массой и имеющее малые размеры и положительный заряд. Изучая движение частиц сквозь фольгу, Резерфорд получил соотношение, связывающее угол рассеяния частицы с прицельным параметром
– частицы считался положительным, этот силовой центр также должен быть положительным. Редкость отскакивания частицы на угол более 90° говорила о том, что центр должен быть точечным. Итак, по Резерфорду получалось, что в центре атома существует нечто, обладающее большой массой и имеющее малые размеры и положительный заряд. Изучая движение частиц сквозь фольгу, Резерфорд получил соотношение, связывающее угол рассеяния частицы с прицельным параметром  .
.
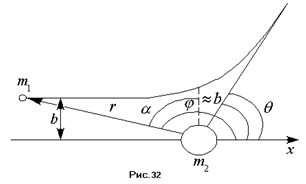
Прицельным параметром  называется расстояние наименьшего сближения частиц, при отсутствии взаимодействия между ними (см. рис. 32). Получим это соотношение. Пусть на положительно заряженную частицу массой
называется расстояние наименьшего сближения частиц, при отсутствии взаимодействия между ними (см. рис. 32). Получим это соотношение. Пусть на положительно заряженную частицу массой  и зарядом
и зарядом  налетает положительно же заряженная частица массой
налетает положительно же заряженная частица массой  , движущаяся со скоростью
, движущаяся со скоростью и имеющая заряд
и имеющая заряд  , причём
, причём  . Тогда при движении частицы в поле центральных сил, должна сохраняться энергия системы и момент импульса частиц. Запишем эти законы:
. Тогда при движении частицы в поле центральных сил, должна сохраняться энергия системы и момент импульса частиц. Запишем эти законы:  (1) – закон сохранения энергии1.
(1) – закон сохранения энергии1.  – момент импульса для первой частицы. Из последнего выражения можно записать:
– момент импульса для первой частицы. Из последнего выражения можно записать:  (2);
(2);  . Осуществим замену переменных:
. Осуществим замену переменных:  . Тогда
. Тогда  . Подставляя полученное выражение в (1), переходя к переменной
. Подставляя полученное выражение в (1), переходя к переменной  , получим:
, получим:  . Раскроем скобки. Тогда
. Раскроем скобки. Тогда  . Умножим слева и справа это выражение на 2 и перенесём вправо слагаемое, характеризующее потенциальную энергию взаимодействия:
. Умножим слева и справа это выражение на 2 и перенесём вправо слагаемое, характеризующее потенциальную энергию взаимодействия:  . Совершим некоторые очевидные преобразования:
. Совершим некоторые очевидные преобразования:  . Возвращаясь к формуле (2), и подставляя ей в данное выражение, получим:
. Возвращаясь к формуле (2), и подставляя ей в данное выражение, получим:  , или
, или  . Продифференцируем теперь по
. Продифференцируем теперь по  :
:  ;
;  ,
,  . Введём следующее обозначение:
. Введём следующее обозначение:  . Тогда рабочее соотношение примет вид:
. Тогда рабочее соотношение примет вид:  . Решением данного уравнения, как нетрудно убедиться, будет
. Решением данного уравнения, как нетрудно убедиться, будет  (3) . чтобы найти неизвестную константу
(3) . чтобы найти неизвестную константу  , прибегнем к следующему приёму. Рассмотрим случай, когда частицы находятся друг от друга бесконечно далеко. Тогда можно записать следующее соотношение: при
, прибегнем к следующему приёму. Рассмотрим случай, когда частицы находятся друг от друга бесконечно далеко. Тогда можно записать следующее соотношение: при  ,
,  . Тогда, подставляя данное допущение в уравнение (3), получим:
. Тогда, подставляя данное допущение в уравнение (3), получим:  ;
; . Таким образом, мы получили всего две неизвестных константы и два граничных условия. Из рисунка 32 следует очевидное равенство:
. Таким образом, мы получили всего две неизвестных константы и два граничных условия. Из рисунка 32 следует очевидное равенство:  ,
,  . Из рисунка 32 также следует, что
. Из рисунка 32 также следует, что  , а с учётом последнего выражения
, а с учётом последнего выражения  . Отсюда
. Отсюда  . Тогда, с помощью этого выражения, а также уравнения (3) мы получим при
. Тогда, с помощью этого выражения, а также уравнения (3) мы получим при  :
:  . Так как
. Так как  , то
, то  или
или  ,
,  . Таким образом, возвращаясь к уравнению (3), получим:
. Таким образом, возвращаясь к уравнению (3), получим:  Разделим полученное выражение на
Разделим полученное выражение на  :
:  . Разложим синусы и косинусы по формулам половинного аргумента и сократим подобные множители:
. Разложим синусы и косинусы по формулам половинного аргумента и сократим подобные множители:  ;
;  . Рассмотрим теперь другое предельное значение угла
. Рассмотрим теперь другое предельное значение угла  . Тогда
. Тогда  и
и  . Подставляя сюда значение постоянной
. Подставляя сюда значение постоянной  , получим:
, получим:  . Возведём в квадрат закон сохранения импульса; полученный результат подставим в рабочую формулу:
. Возведём в квадрат закон сохранения импульса; полученный результат подставим в рабочую формулу:  ,
,  ;
;  (4). Последняя формула была получена Резерфордом и связывает угол рассеяния частицы с прицельным параметром
(4). Последняя формула была получена Резерфордом и связывает угол рассеяния частицы с прицельным параметром  .
.
Рекомендуемые материалы
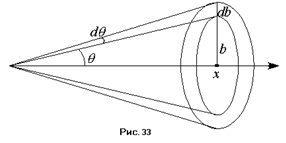
Оставалось только проверить эту формулу. В опыте Резерфорд имел дело не с одной частицей, а с большим их числом. Частицы двигались под некоторыми углами, то есть имел место некоторый разброс углов. Частицы рассеивались на различных атомах и после рассеяния приобретали некоторые импульсы, значения которых также претерпевали некоторый разброс. Для того чтобы описать данный процесс, немыслимо пытаться рассчитывать траекторию движения каждой частицы. Полученная система уравнений будет слишком громоздка и практически неразрешима. В данном случае уместно прибегнуть к теории вероятностей. Введём понятие дифференциального поперечного сечения рассеяния  в угол между
в угол между  и
и  . Так будем называть отношение числа частиц
. Так будем называть отношение числа частиц  , рассеянных в единицу времени в угол
, рассеянных в единицу времени в угол  к полному потоку частиц
к полному потоку частиц  :
:  . Здесь
. Здесь  , где
, где  – полное число частиц. Все частицы, для которых
– полное число частиц. Все частицы, для которых  , будут рассеиваться в угол
, будут рассеиваться в угол  . Число частиц, прицельный параметр которых заключён в этом интервале, будет равно числу частиц, падающих на кольцо шириной
. Число частиц, прицельный параметр которых заключён в этом интервале, будет равно числу частиц, падающих на кольцо шириной  и радиусом внутренней окружности
и радиусом внутренней окружности  :
:  . Тогда
. Тогда  ,
,  . Нам не важен здесь знак
. Нам не важен здесь знак  , поэтому в дальнейшем будем рассматривать лишь его модуль. Воспользуемся теперь полученной нами формулой (4) для нахождения
, поэтому в дальнейшем будем рассматривать лишь его модуль. Воспользуемся теперь полученной нами формулой (4) для нахождения  :
:  . Подставляя полученное выражение в уравнение для
. Подставляя полученное выражение в уравнение для  , получим
, получим ,
,  . Последняя формула называется формулой Резерфорда. Перейдём теперь от плоского угла
. Последняя формула называется формулой Резерфорда. Перейдём теперь от плоского угла  к телесному
к телесному  . Известно, что они связаны соотношением
. Известно, что они связаны соотношением  в сферической системе координат. Тогда если угол
в сферической системе координат. Тогда если угол  ,
, . Из последней формулы выразим
. Из последней формулы выразим  и подставим его в формулу Резерфорда для плоского угла:
и подставим его в формулу Резерфорда для плоского угла:  ,
,  ;
;  , или
, или  (5). Мы получили формулу Резерфорда для телесного угла. Данная формула подтверждается с хорошей точностью и при современных исследованиях. Использовались разные частицы, двигавшиеся с различными скоростями, и формула была в согласии с полученными результатами. Таким образом, косвенно подтвердилось уравнение (4), которое было выведено исходя из соображений планетарного строения атома, что и утвердило главенствующее положение этой теории. Если известно сечение рассеяния
(5). Мы получили формулу Резерфорда для телесного угла. Данная формула подтверждается с хорошей точностью и при современных исследованиях. Использовались разные частицы, двигавшиеся с различными скоростями, и формула была в согласии с полученными результатами. Таким образом, косвенно подтвердилось уравнение (4), которое было выведено исходя из соображений планетарного строения атома, что и утвердило главенствующее положение этой теории. Если известно сечение рассеяния  , то с помощью формул (4) и (5) можно вычислить зарядовое число
, то с помощью формул (4) и (5) можно вычислить зарядовое число  . Эксперименты Резерфорда показали, в частности, что элементы в таблице Менделеева изменяются по порядку зарядового числа.
. Эксперименты Резерфорда показали, в частности, что элементы в таблице Менделеева изменяются по порядку зарядового числа.
При всём удобстве планетарной модели атом по Резерфорду, очевидна её неустойчивость. Действительно, электроны движутся по орбитам с центростремительным ускорением. Тогда в соответствии с электродинамикой Максвелла, они должны непрерывно излучать. Но тогда они теряли бы энергию и, в конце концов, упали бы на ядро. Расчёты показали, что такой процесс «схлопывания» атома произошёл бы очень быстро. Чтобы разрешить возникшее противоречие, Нильс Бор выдвинул следующие требования к атомной излучающей системе, которые впоследствии назвали постулатами Бора.
1. Атомы могут определённое время, в зависимости от их структурных особенностей, находиться в определённых, так называемых стационарных состояниях. Энергии этих состояний  образуют дискретный ряд. В стационарных состояниях атомы не излучают.
образуют дискретный ряд. В стационарных состояниях атомы не излучают.
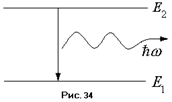
2. При переходе атома из одного состояния с энергией  в другое с энергией
в другое с энергией  , происходит излучение, если
, происходит излучение, если  , или поглощение, если
, или поглощение, если  кванта света с частотой пропорциональной разности энергий состояний:
кванта света с частотой пропорциональной разности энергий состояний:  .
.
Бор ввёл также правила, в соответствии с которыми определяются стационарные состояния атомных систем. Данные правила получили название правил квантования. Бор предположил, что стационарными являются лишь те состояния, в которых момент импульса электрона равен целому числу постоянных Планка:  . Коэффициент пропорциональности между моментом импульса электрона и постоянной Планка называют главным квантовым числом (так как оно определяет электронов, атома и его энергию). Рассмотри правила квантования на примере атома водорода. Электрон движется по круговой орбите с центростремительным ускорением, которое определяется силой кулоновского взаимодействия. Будем рассматривать уединённый атом. Тогда на электрон не будут действовать никакие другие силы, за исключением силы Кулона. По второму закону Ньютона мы можем записать:
. Коэффициент пропорциональности между моментом импульса электрона и постоянной Планка называют главным квантовым числом (так как оно определяет электронов, атома и его энергию). Рассмотри правила квантования на примере атома водорода. Электрон движется по круговой орбите с центростремительным ускорением, которое определяется силой кулоновского взаимодействия. Будем рассматривать уединённый атом. Тогда на электрон не будут действовать никакие другие силы, за исключением силы Кулона. По второму закону Ньютона мы можем записать:  . Подставляя в это уравнение выражения для силы Кулона и центростремительного ускорения, получим
. Подставляя в это уравнение выражения для силы Кулона и центростремительного ускорения, получим  , где
, где  – главное квантовое число. Запишем правило квантования:
– главное квантовое число. Запишем правило квантования:  . Выразим из него скорость и подставим во второй закон Ньютона:
. Выразим из него скорость и подставим во второй закон Ньютона:  ;
;  ;
;  . Мы нашли радиусы орбит основных состояний атома. В частности, радиус первой боровской орбиты составляет
. Мы нашли радиусы орбит основных состояний атома. В частности, радиус первой боровской орбиты составляет  . Мы можем найти также энергию связи электрона в атоме – энергию, которую необходимо затратить, чтобы оторвать электрон от ядра. Полная энергия электрона в атоме равна сумме кинетической энергии его движения и потенциальной энергии его взаимодействия с ядром:
. Мы можем найти также энергию связи электрона в атоме – энергию, которую необходимо затратить, чтобы оторвать электрон от ядра. Полная энергия электрона в атоме равна сумме кинетической энергии его движения и потенциальной энергии его взаимодействия с ядром:  . Подставляя значения этих энергий, получим:
. Подставляя значения этих энергий, получим:  . Подставим в эту формулу значение квадрата скорости, выраженное из второго закона Ньютона:
. Подставим в эту формулу значение квадрата скорости, выраженное из второго закона Ньютона:  . Подставим сюда значение боровского радиуса:
. Подставим сюда значение боровского радиуса:  , или
, или  . Таким образом, энергия связи определяется однозначно главным квантовым числом. Состояние атома с наименьшей энергией называется основным состоянием. Если атому каким-либо способом сообщается энергия, то атом переходит в другое энергетическое состояние. Состояние атома с энергией больше, чем энергия основного состояния называется возбуждённым. Так как основному состоянию атома соответствует главное квантовое число
. Таким образом, энергия связи определяется однозначно главным квантовым числом. Состояние атома с наименьшей энергией называется основным состоянием. Если атому каким-либо способом сообщается энергия, то атом переходит в другое энергетическое состояние. Состояние атома с энергией больше, чем энергия основного состояния называется возбуждённым. Так как основному состоянию атома соответствует главное квантовое число  , то первому возбуждённому состоянию –
, то первому возбуждённому состоянию –  .
.
Структура энергетических уровней атома водорода.
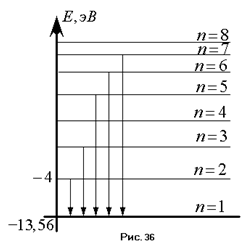
Из предыдущего следует, что атом обладает дискретным набором значений энергий, соответствующих различным энергетическим уровням. Вычисляя эти энергии, можно заметить, что с ростом главного квантового числа разность энергий между двумя соседними энергетическими состояниями всё время уменьшается. В конце концов, она будет стремиться к нулю.
Рекомендуем посмотреть лекцию "Примеры линейных пространств".
Энергия, которую необходимо затратить, чтобы перевести атом из основного состояния в состояние с  , называется энергией ионизации атома. Водорода потенциал ионизации составляет
, называется энергией ионизации атома. Водорода потенциал ионизации составляет  . В опытах Франка – Герца, как мы помним, фигурировало именно это число. Основываясь на представлении Бора о процессе излучения атома, можно сделать вывод, что спектральные серии соответствуют переходу атома с одних энергетических уровней на какой-то другой. Так, например, серии Лаймана соответствует переход атома водорода на первый энергетический уровень, серии Бальмера – на второй; серии Пашена – на третий. Этот факт позволяет найти длины волн в каждой серии. В соответствии со вторым постулатом Бора, мы можем записать, что при переходе с
. В опытах Франка – Герца, как мы помним, фигурировало именно это число. Основываясь на представлении Бора о процессе излучения атома, можно сделать вывод, что спектральные серии соответствуют переходу атома с одних энергетических уровней на какой-то другой. Так, например, серии Лаймана соответствует переход атома водорода на первый энергетический уровень, серии Бальмера – на второй; серии Пашена – на третий. Этот факт позволяет найти длины волн в каждой серии. В соответствии со вторым постулатом Бора, мы можем записать, что при переходе с  – го энергетического уровня на
– го энергетического уровня на  – й, излучается волна частоты
– й, излучается волна частоты  . Как было сказано выше, Бальмер получил формулу для частоты излучённой волны:
. Как было сказано выше, Бальмер получил формулу для частоты излучённой волны:  . Сравнивая её с предыдущей, получим:
. Сравнивая её с предыдущей, получим:  . Мы получили формулу для определения постоянной Ридберга. Так как для атома водорода
. Мы получили формулу для определения постоянной Ридберга. Так как для атома водорода  , то постоянная Ридберга для атома водорода будет иметь вид:
, то постоянная Ридберга для атома водорода будет иметь вид:  . Так как
. Так как  , то
, то  . Отсюда постоянная Ридберга для длины волны будет:
. Отсюда постоянная Ридберга для длины волны будет:  .
.
Различие между частотами, полученными по этой формуле, и при опыте всё равно присутствовало. Его объясняли так. При выводе формулы для радиусов боровских орбит, мы не учитывали тот факт, что электрон с ядром образуют систему двух тел, которая вращается вокруг общего центра масс. Данный факт можно учесть, если заменить в формуле для постоянной Ридберга массу электрона приведённой массой системы электрон – ядро:  ,
,  .
.  ,
,  ;
;  ;
;  . Найдём теперь спектральных линий между полученными экспериментально и теоретически:
. Найдём теперь спектральных линий между полученными экспериментально и теоретически:  ,
,  ,
,  ,
,  . Оцененная разность составила:
. Оцененная разность составила:  , что совпадало с опытными данными.
, что совпадало с опытными данными.
Как следует из уравнения для постоянной Ридберга, для элементов с одинаковыми зарядами, но разной массой ядра, спектральные линии излучения должны отличаться. Такие элементы называют изотопами. Так как заряд ядра определяется количеством протонов, то изотопы различаются количеством нейтронов в ядре, а разница в частоте спектральных линий – изотопическим сдвигом. Для водорода существуют 3 изотопа: протий, дейтерий и тритий. Можно определить массу присутствующего изотопа в чистом веществе по изотопическому сдвигу. Для этого лазером с определённой длиной волны возбуждают различные энергетические уровни, которые для атомов исследуемого вещества известны. Атомы излучают, а по интенсивности смещённых линий, относительно спектральных линий чистого вещества можно сделать вывод о концентрации изотопов.
В заключение необходимо сказать, что орбиты электронов нельзя считать сферическими, даже эллиптическими, как это делали Вильсон и Зоммерфельд. Они ввели обобщённые координаты и импульсы, угловоё момент импульса и радиальный момент импульса и предположили, что каждый из этих моментов должен квантоваться по отдельности. Поэтому они ввели понятия углового и радиального квантовых чисел:  . В действительности не имеет смысла даже говорить об орбите. Существует лишь вероятность обнаружить электрон в данный момент времени в данной точке пространства. Такая вероятность представляет собой некоторое размытое облако. Максимум же вероятности приходится как раз на боровские орбиты в основных состояниях.
. В действительности не имеет смысла даже говорить об орбите. Существует лишь вероятность обнаружить электрон в данный момент времени в данной точке пространства. Такая вероятность представляет собой некоторое размытое облако. Максимум же вероятности приходится как раз на боровские орбиты в основных состояниях.
1 См. Курс теоретической механики под редакцией Ерыкалина А. В.



















