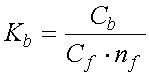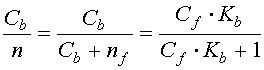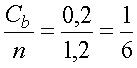Кальциевый насос животной клетки
Кальциевый насос животной клетки
Резюме
Кальций-транспортная АТФаза - сравнительно небольшой белок, состоящий из одной полипептидной цепи. Он выполняет важнейшую функцию - активный перенос ионов кальция через мембраны клеток, поддерживая тем самым низкую концентрацию этих ионов в клетке (10-7 М) по сравнению с окружающей средой (3•10-3 М). Хотя полная пространственная структура фермента еще не раскрыта, основные стадии его работы выяснены, и теперь нам понятно, каким образом энергия гидролиза АТФ тратится на перенос Ca2+ из области меньших в область больших концентраций этих ионов.
Введение
В цитоплазме клеток концентрация ионов кальция составляет всего 50-100 нМ (5·10-8 - 1·10-7 М), тогда как в окружающей клетки среде она равна примерно 3 мМ (3·10-3 М). Поддерживает эту разницу в концентрации (на четыре порядка величины!) система активного транспорта ионов кальция, главную роль в которой играет кальциевый "насос" - фермент кальциевая АТФаза, сокращенно Са-АТФаза. Точнее говоря, не один фермент, а группа кальциевых АТФаз, различающихся по локализации в клетке, строению и способу регуляции.
Но все эти ферменты переносят ионы кальция из клеточного сока во внеклеточную жидкость или во внутриклеточные депо кальция - пузырьки эндоплазматического ретикулума за счет энергии гидролиза АТФ, поддерживая тем самым низкую концентрацию ионов кальция в цитоплазме.
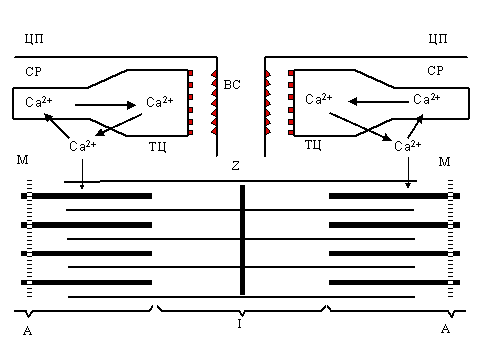
Поддержание низкой концентрации ионов кальция в цитоплазме покоящихся клеток создает возможность регуляции клеточных функций путем увеличения проницаемости клеточных мембран для Ca2+: входя в клетку, эти ионы активируют великое множество различных внутриклеточных процессов. Яркий пример - сокращение мышцы, которое начинается с выхода ионов кальция из саркоплазматического ретикулума и его взаимодействия с сократительными белками.
Под действием электрического импульса, распространяющегося по плазмалемме, ионы кальция выходят из везикул саркоплазматического ретикулума и вызывают сокращение. Удаление кальция саркоплазматическим ретикулумом приводит к расслаблению мышцы. Последующее удаление Ca2+ из цитоплазмы и накопление его в ёмкостях эндоплазматического ретикулума осуществляется Са-АТФазой и приводит к расслаблению мышцы (см. рис.1).
Рекомендуемые материалыВариант 6 - Сельское хозяйство Историческая ономастика FREE Бонистика FREE Фалеристика FREE Ономастика FREE Геральдика и хронология
| P и с. 1. Ионы кальция как регуляторы цикла сокращение - расслабление в поперечнополосатых мышцах: ТЦ - терминальные цистерны саркоплазматического ретикулума (СР), ЛТ - продольные (латеральные) трубочки, ВС - внутренний синапс, ТТ - Т-система, Ц - цитоплазматическая мембрана (плазмалемма), A - миозиновые нити, I- актин, Z - Z-пластинка, М - М-полоса. |
В других клетках ионы кальция, входя пассивно через открывающиеся каналы, связанные с различными рецепторами, также играют роль посланников, дающих приказы включить ту или иную внутриклеточную систему . После исполнения приказа "посланников" надо выпроводить из цитоплазмы, что и делают Са-АТФазы, а также Na+-Ca2+ обменники.
Кальциевые АТФазы, входящие в состав цитоплазматических мембран и внутриклеточных мембран, различаются по ряду свойств. Все Са-АТФазы представляют собой мономерные белки, т. е. состоят из единственной полипептидной цепи, но несколько различаются по молекулярной массе. Так Са-АТФаза саркоплазматического ретикулума имеет молекулярную массу 108 кД, а плазматическая Са-АТФаза - 120 кД. Лучше всего изучена Са-АТФаза саркоплазматического ретикулума поперечно-полосатых мышц, и именно ее строение и работу мы рассмотрим подробно в данной статье.
Выделение и очистка Са-АТФазы
Изучение механизма транспорта Са2+ при работе Са-АТФазы проводилось, главным образом, на изолированных пузырьках саркоплазматического ретикулума, полученных после гомогенизации тканей путем последовательных центрифугирований. Пузырьки СР в электронном микроскопе выглядят так же, как и другие мембранные структуры. На сколах замороженных суспензий изолированных пузырьков саркоплазматического ретикулума видны внутримембранные частицы диаметром около 9 нм.
Эти глобулярные частицы на поверхности скола образуются вследствие внедрения в гидрофобную зону мембраны участков полипептидной цепи Са-АТФазы. Анализ белкового состава пузырьков показывает, что основным белком в ретикулуме является Са-АТФаза (70-80% всех белков). Используя различные приемы, можно очистить Са-АТФазу от других белков. Правда, при очистке обычно повреждается мембрана, и изучать транспортную функцию становится невозможным. Но добавив фосфолипиды, удается восстановить целостность везикул и получить прекрасный объект для изучения функции Са-АТФазы: фосфолипидные пузырьки со встроенным в них работающим ферментом.
Энергетика транспорта ионов кальция
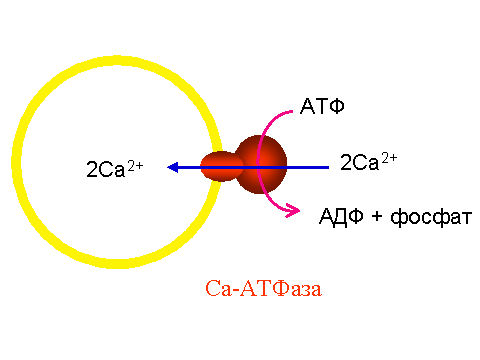
Используя различные методы, удалось установить, что при гидролизе одной молекулы АТФ Са-АТФаза СР переносит 2 иона кальция из окружающей среды внутрь везикул, как это показано на рис. 2.
|
| Рис. 2. Схематическое изображение везикулы саркоплазматического ретикулума со встроенной молекулой Са-АТФазы Во внешнюю среду (цитоплазму) обращена головка фермента, диаметром около 9 нм. С ней связываются АТФ и ионы кальция. Мембрану пронизывает канал, по которому, как полагают, кальций переносится при гидролизе АТФ. Более подробная схема строения фермента показана на рис. 4. |
Перенос ионов кальция сопровождается переносом электрических зарядов, но разность потенциала на мембране не удерживается, потому что мембрана СР хорошо проницаема для других ионов. Для того чтобы перенести через мембрану 2 грамм-эквивалента ионов кальция из клеточного сока, где его концентрация Ci = 1·10-7 М, во внутреннюю полость саркоплазматического ретикулума, где концентрация кальция близка к одному мМ (Co = 1·10-3) требуется затратить энергию, равную:
DG = 2Dm = 2 [Dmo + RT ln(Ci/Co) + zFDj) (1)
Поскольку внутри саркоплазматического ретикулума потенциал равен внутриклеточному (Dj = 0), а величина mo примерно одинакова для ионов кальция в водных растворах (Dmo = 0), можно считать, что изменение свободной энергии при переносе двух молей Ca2+ равно при 37оС (310 К):
DG = 2RTln (Ci/Co) = 47,5 кДж/моль (2)
Это приблизительно равно энергии гидролиза макроэргической связи АТФ при физиологических концентрациях АТФ , АДФ и ортофосфата. Таким образом, транспорт кальция через мембрану саркоплазматического ретикулума осуществляется с высоким коэффициентом полезного действия, без потерь энергии. Помимо прочего, это предполагает обратимость работы Са-АТФазы. И действительно, было показано, что можно получить синтез АТФ из АДФ и фосфата, если нагрузить изолированные везикулы СР кальцием, а затем убрать кальций из окружающей среды, добавив туда комплексон - соединение, связывающее Ca2+. Заметим, что обратимо могут работать также и другие транспортные АТФазы: Na/K-АТФаза цитоплазматических мембран и H+- АТФаза митохондрий.
Механизм переноса ионов кальция
Хотя транспортные АТФазы и называют ионными насосами, от корабельной помпы их отличает то, что они не качают жидкость, а переносят дискретные частицы - ионы. Каждый цикл переноса включает в себя как минимум три стадии:
1. 1. частицу надо захватить с одной стороны мембраны,
2. 2. перенести ее через мембрану (транслокация) и
3. 3. выпустить с другой стороны
Осуществление этих стадий сопряжено с расходом энергии и следовательно одновременно что-то должно происходить с АТФ. Сама молекула АТФ тоже должна быть (1) захвачена и (2) гидролизована с запасанием энергии и расходом ее на перенос кальция, а продукты, АДФ и фосфат, должны перейти из связанного с ферментом состояния в водный раствор (3). В каждом цикле фермент одновременно использует не один, а два субстрата: внутриклеточный кальций и АТФ, - и образует три продукта: кальций, накопленный внутри везикул эндоплазматического ретикулума, АДФ и ортофосфат.
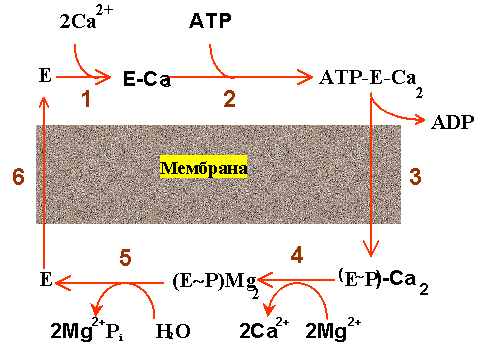
Усилиями многих ученых была в общих чертах расшифрована последовательность стадий при работе Ca-АТФазы (см. рис. 3), которая включает в себя все перечисленные выше этапы и кроме того замечательна тем, что стадии "переработки"АТФ как бы чередуются со стадиями переноса Ca2+.
|
| Рис. 3. Последовательность стадий работы Са-АТФазы 1 - связывание ионов кальция, 2 - связывание АТФ, 3 - образование фермент-фосфата, 4 - отщепление ионов кальция, 5 - гидролиз фермент-фосфата, 6 - возвращение фермента в исходное состояние. Остальные объяснения даны в тексте. |
Вот эти стадии:
1. 1. Связывание двух ионов кальция на поверхности АТФазы, обращенной в цитоплазму (или наружу в изолированных пузырьках СР).
2. 2. Связывание на той же поверхности молекулы АТФ.
3. 3. Фосфорилирование белка (образование фосфофермента) и высвобождение АДФ.
4. 4. Высвобождение ионов кальция с поверхности АТФазы, обращенной внутрь пузырьков СР.
5. 5. Гидролиз фосфатной связи и отщепление ионов магния.
6. 6. Переход молекулы фермента в исходное состояние (центры связывания кальция оказываются опять на поверхности пузырьков СР).
В последующих разделах эти стадии будут рассмотрены более подробно.
Связывание ионов кальция(стадия 1)
Чтобы изучить количественно способность везикул СР связывать ионы, к суспензии везикул с известной концентрацией АТФазы (Ca) добавляют разные количества изучаемых ионов и тем или иным способом измеряют концентрацию связавшегося (Cb) и оставшегося в растворе иона (Cf). На основе полученных данных рассчитывают два основных параметра связывания: константу связывания (Kb)и число мест связывания (n).
Константа связывания - это константа равновесия:
свободные ионы +вакантные места связывания«связанные ионы
По определению, константа связывания равна:
|
| (3) |
Из уравнения видно, что константа связывания Kb равна обратной концентрации свободных ионов при такой их концентрации Cf, когда концентрация связанных ионов Cb равна концентрации свободных мест связывания nf , т. е. когда занята половина всех имевшихся на поверхности фермента мест связывания. Чем выше константа связывания (т. е. сродство центров к иону), тем ниже концентрация ионов, при которой белок еще может их связывать.
Изучение связывания различных ионов мембранными пузырьками СР показало, что только для ионов Са2+ имеются центры с высокой константой связывания (2·106М-1); на одну молекулу АТФазы приходится два таких центра.
Т а б л и ц а 1 Константы связывания Ca2+ и АТФ с Са-АТФазой
| Метод определения | Константа связывания Ca2+ | Константа связывания ATP |
| Связывание 45Ca2+ или 14С-АТФ | 4·106 | 2·105 |
| Зависимость АТФазной активности от концентрации | 2·106 2,5·106 | 2,5·105 |
| Зависимость скорости образования Е~ Р от концентрации | 106 | 2·105 |
Пользуясь уравнением 2, подсчитаем, какая доля всех центров связывания кальция будет занята ионами при концентрации свободных ионов в растворе, равной 1•10-7М. Поскольку общее число мест связывания n = Cb + nf, то из уравнения 2 нетрудно найти долю занятых центров связывания:
|
| (4) |
Подставив значения Cf и Kb в уравнение 3, находим:
|
| (5) |
Таким образом каждый шестой центр связывания на поверхности молекул АТФазы занят ионами кальция при той чрезвычайно низкой (100 нМ) их концентрации, которая типична для внутриклеточного содержимого.
Конечно, сразу возникает вопрос, является ли связывание кальция действительно первой стадией его переноса или перенос и адсорбция кальция - разные и независимые процессы. Было получено много доказательств того, что именно связывание кальция с центрами с высоким сродством есть первая стадия переноса. Одно из них заключается в одинаковой зависимости связывания и переноса от концентрации кальция. С другой стороны, всякое снижение связывания под действием конкурирующих ионов всегда одновременно снижало и перенос кальция через мембраны. Заметим, что присутствие магния мало влияет на связывание кальция АТФазой, поскольку сродство к Ca2+ у центров связывания в 30 000 раз выше, чем к Mg2+.
Связывание АТФ(стадия 2)
Изучение связывания АТФ с кальциевой АТФазой, встроенной в мембранные везикулы, показало, что АТФ связывается в комплексе с ионами Mg2+ (или Mn2+), причем связывание комплекса Mg·АТФ происходит независимо от Са2+. Это означает, что имеются два разных центра связывания для Mg·АТФ и для Са2+.Константа связывания Mg·АТФ составляет 2·105 М-1, т. е. сродство активного центра фермента к субстрату довольно велико: половина молекул АТФ связывается при его концентрации 5 мкМ. Наряду с одним центром связывания, обладающим высоким сродством к АТФ, на поверхности молекулы АТФазы есть второй центр связывания с низким сродством, который не участвует в процессе гидролиза АТФ и переноса кальция, но, возможно, имеет значение для регуляции активности фермента.
Гидролиз АТФ
Итак, на поверхности АТФазы имеются центры связывания для двух ионов кальция и для одной молекулы АТФ, обладающие высоким сродством к субстрату. Они взаимодействуют между собой, так как связывание Са2+"запускает'' гидролиз АТФ, присоединенного вместе с Mg2+ к своему центру. При этом было показано, что гидролиз АТФ начинается только после того как оба иона кальция присоединятся к своим участкам связывания. Это соответствует стехиометрии переноса Са2+ и гидролиза АТФ, равной 2, о которой мы уже говорили.
Фосфорилирование белка(стадия3)
Гидролиз АТФ осуществляется Са-АТФазой в три этапа: вначале происходит связывание АТФ, затем - фосфорилирование белка и отщепление АДФ, и наконец - гидролитическое расщепление белок-фосфатной связи и высвобождение ортофосфата.
Фосфорилирование осуществляется по карбоксильной группе остатка аспарагиновой кислоты. Стадия эта обратима: добавив к изолированным везикулам эндоплазматического ретикулума, содержащим ферментфосфат (Е~ Р), АДФ в присутствии 1 мМ Са2+, можно наблюдать почти полный перенос фосфата с белка на АДФ с образованием АТФ. Таким образом, в мембранах СР существует равновесие:
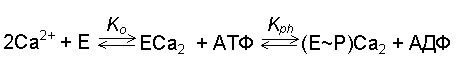
где Ko - константа связывания ионов кальция на АТФазе у наружной поверхности мембранных везикул СР, а Kph - константа равновесия реакции фосфорилирования. Последняя величина близка к единице.
Как известно, при гидролизе АТФ высвобождается большое количество энергии, благодаря чему связь между фосфатом и АДФ в молекуле АТФ называют макроэргической (богатой энергией).
Обратимость процесса фосфорилирования белка означает, что и связь фосфата с аспарагиновым остатком в фосфорилированном белке (на рис. 3 она обозначена знаком "~ ") тоже богата энергией, которая высвобождается при ее гидролизе. Ниже мы увидим, что именно эта энергия и тратится на активный перенос ионов кальция.
Гидролиз энзим-фосфатного комплекса(стадия 4)
Высокоэнергетическая (способная передавать остаток фосфорной кислоты на АДФ) форма фосфорилированной АТФазы стабильна только в присутствии миллимолярных (т. е. сравнительно высоких) концентраций ионов Са2+. При меньших концентрациях Ca2+ происходит вытеснение ионов Са2+ из Са - связывающих центров фосфофермента ионами Mg2+ (которые присутствуют в среде и без которых Са-АТФаза не работает); ионы кальция при этом выходят в окружающий раствор.
Эта стадия работы АТФазы (гидролиз E~ P) - важнейшая в цикле переноса ионов кальция и заслуживает пристального рассмотрения. Вытеснение ионов Са2+ из Са - связывающих центров высокоэнергетического фосфопроизводного белка ионами Mg2+ происходит, как выяснилось, не одномоментно, а в два этапа: сначала отщепляется кальций, а только потом - происходит гидролиз фосфатной связи (отщепление неорганического фосфата).
Кальциевый и магниевый комплексы энзим-фосфата принципиально различаются по их способности вступать в реакцию с АДФ с образованием АТФ. Как уже говорилось, комплекс кальция с энзим-фосфатом (существующий при высоких концентрациях кальция) может превратиться в исходную Са-АТФазу с синтезом АТФ (так называемое ионное фосфорилирование). Поэтому мы говорим, что фосфат связан с белком макроэргической связью и обозначаем комплекс как E~ P.
Оказалось, что комплекс энзим-фосфата с магнием не обладает способностью передавать фосфат на АДФ: при гидролитическом отщеплении фосфата уже не выделяется достаточной энергии; связь фосфата с белком не макроэргическая (комплекс обозначаем как E~ P).
На что же потратилась энергия фосфатной связи? - Оказывается, она пошла на изменение константы связывания кальция с АТФазой. Изучение влияния ионов Ca2+ на распад и образование фосфофермента показало, что при фосфорилировании константа связывания Ca2+ уменьшается более чем в 1000 раз, т. е. становится меньше 2·103М-1. В 0,5 мМ растворе Ca2+ половина всех связанных ранее ионов кальция после форсфорилирования белка отрывается от АТФазы и ионы переходят в раствор; при 1 мМ концентрации ионов кальция в среде в связанном состоянии находятся две трети ионов, остальные выходят в раствор (см. уравнение 3). Наличие ионов магния в среде дополнительно уменьшает количество связанного кальция, поскольку у фосфорилированной АТФазы разница в сродстве к Ca2+ и Mg2+ не очень велика.
Что же получается? До фосфорилирования АТФаза связывала кальций при низких концентрациях (10-7 M), а после фосфорилирования - только при высоких (10-3 M). Энергия АТФ пошла на то, чтобы АТФаза "вытолкнула" в концентрированный раствор Ca2+ ионы, которые фермент "выловил" из их разбавленного раствора. Но это еще не все. Дело ведь в том, что АТФаза связывает кальций по одну сторону мембраны, а отщепляется он - по другую.
Перенос кальция через мембрану(транслокация)
В везикулах саркоплазматического ретикулума молекулы Са-АТФазы ориентированы строго определенным образом, так что связывание ионов кальция и АТФ происходит с наружной стороны пузырьков, а высвобождение кальция - с внутренней. Изучение связывания ионов кальция на разных стадиях работы Са-АТФазы показало, что в нефосфорилированном состоянии Са- связывающие центры АТФазы доступны для ионов Ca2+ только с внешней стороны пузырьков и недоступны с внутренней.
После фосфорилирования фермента Са - связывающие центры становятся доступными с внутренней стороны и недоступными с внешней. Таким образом, фосфорилирование приводит к переносу центров связывания кальция через мембрану (транслокации). Поскольку перенос ионов осуществляет белковая молекула, очевидно, что какие-то ее части должны перемещаться, или, как принято говорить, должно происходить изменение конформации белковой молекулы. Одновременно, как уже говорилось, происходит изменение сродства центров связывания к ионам кальция. Механика сопряжена с энергетикой.
Завершение цикла - гидролиз фосфофермента
(стадии 5 и 6)
Магниевый комплекс энзим-фофата быстро гидролизуется, и фермент приобретает свои исходные свойства. При этом на поверхности фермента, обращенной наружу, вновь появляются центры связывания кальция с высоким сродством. Очевидно, что гидролиз E~P (стадия 5 на рис. 2) приводит, во первых, к освобождению центров связывания от магния, а во-вторых, к их обратной транслокации (стадия 6). При этом на поверхности фермента, обращенной наружу, центры связывания кальция приобретают вновь высокое сродство к этим ионам. Таким образом, дефосфорилирование E~P приводит к пространственным перемещениям участка белковой молекулы и к изменениям энергии связывания ионов точно так же, как и фосфорилирование АТФазы, но в противоположном направлении. Цикл работы фермента замыкается (см. рис. 3).
Прямые доказательства того, что фермент “шевелится”, когда работает
Хотя идея о том, что при работе фермента происходит изменение конформации белка, высказана давно, прямые доказательства этого получены далеко не для всех известных ферментативных реакций. В этом отношении транспортные АТФазы - благодарный объект, поскольку эти механохимические машины осуществляют перенос ионов с одной стороны мембраны на другую. Ясно, что такие действия связаны с перемещением в пространстве определенных участков белковой молекулы.
Было показано изменение конформации Са-АТФазы при работе этого фермента методами дифференциальной спектрофотометрии, собственной белковой флуоресценции и спиновых зондов. Однако интереснее всего узнать, на каких именно стадиях работы фермента происходят наиболее заметные изменения конформации белка. В работах, проведенных в нашей лаборатории совместно с В. Б. Ритовым методом спиновых меток, было обнаружено резкое увеличение подвижности участка белка, содержащего SH-группу, при присоединении к ферменту Mg·АТФ. (Спиновая метка - это химическая группировка, содержащая устойчивый свободный радикал - (иминоксил, > NO), сигнал ýïð которого зависит от физических свойств той среды, которая окружает иминоксильную ( > NO) группу. При увеличении подвижности полипептидной цепи, к которой присоединен иминоксильный радикал, меняется соответствующим образом и сигнал ýïð). Затем удалось показать изменение конформации фермента (подвижности спиновой метки, присоединенной к SH-группе) как при образовании фосфофермента, так и при его распаде. Таким образом, механические перемещения участка фермента, которые были предсказаны на основании изучения отдельных стадий работы АТФазы (рис. 3), были подтверждены прямыми опытами.
Физическое состояние липидов и работа Са-АТФазы
Активность многих мембранных ферментов, включая Са- АТФазу, существенно зависит от вязкости и химической природы окружающих липидов. Так, например, меняя фосфолипидный состав везикул, в которые встроена Са-АТФаза, можно заметно влиять на активность фермента, причем чем выше текучесть (величина, обратная вязкости) липидного бислоя липосом, тем выше скорость гидролиза АТФ. При изменении температуры также параллельно изменяется текучесть липидного слоя в везикулах и активность Са-АТФазы. Было также показано, что при увеличении вязкости липидного слоя мембран, вызванного окислением фосфолипидов, происходит снижение активности фермента.
Хотя кажется вроде бы очевидным, что активность фермента, плавающего в липидном слое, должна зависеть от вязкости этого слоя, над этим все-таки стоит призадуматься. В самом деле, ведь стадии присоединения субстрата и отщепления продуктов реакции протекают в водной фазе. Поэтому если бы фермент, выполняя свою функцию, не осуществлял никаких механических движений, вязкость вряд ли могла бы влиять на его деятельность.
По-видимому, к вязкости липидного окружения чувствительны только те мембранные ферменты, при работе которых происходит изменение их конформации. Продолжая эту мысль, можно полагать, что из всех стадий ферментативной реакции только те будут зависеть от вязкости липидов, на которых происходит изменение конформации белка. И действительно, было показано, что скорость распада фермент-фосфатного комплекса Са-АТФазы уменьшается с ростом вязкости липидов. Это подтверждает, что на этой стадии происходит движение участка фермента, которое, согласно схеме на рис. 3, связано с переносом ионов кальция через мембрану.
В живых клетках изменения липидного состава мембран, например состава жирных кислот в молекулах фосфолипидов, включение холестерина или окисление мембранных липидов, также могут влиять на микровязкость липидного слоя и тем самым на активность Са-АТФазы. Разумно предположить, например, что повышение вязкости клеточных мембран ввиду избытка холестерина или перекисного окисления липидов может привести к ухудшению работы ферментных систем, осуществляющих выкачивание Ca2+ из клетки и в результате этого - к повышению концентрации этих ионов в клеточном соке со всеми вытекающими последствиями.
Строение кальциевой АТФазы
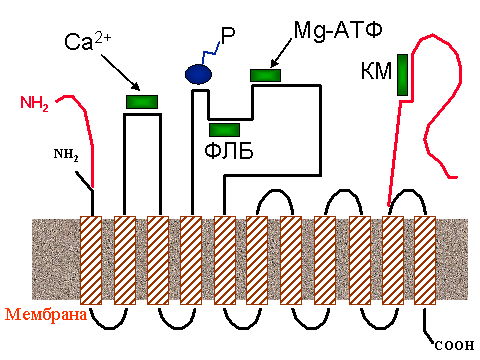
Выражение "О ферментах, как и о людях, судят по их действию" , символ веры первого поколения энзимологов, сейчас уже не так бесспорно. Многие ферменты получены в виде кристаллов, и на основании рентгеноструктурного анализа воссоздана их подробная пространственная структура, а подчас и структура их комплексов с субстратами и ингибиторами. К сожалению, транспортные АТФазы, не растворимые в воде и работающие в составе мембран, не удается получить в виде настоящих кристаллов. Тем не менее, многое об их структуре все же известно, включая последовательность аминокислот в полипептидной цепи, локализацию мест связывания ионов и АТФ в полипептидной цепи и расположение определенных участков цепи по отношению к мембране.
|
| Черная линия - полипептидная цепь Са-АТФазы саркоплазматического ретикулума, красная - участки цепи Са-АТФазы цитоплазматической мембраны. Заштрихованные прямоугольники - a-спиральные участки, пронизывающие мембрану (обозначены в тексте как М1, М2 и т, считая слева направо), NH2 - N- конец полипептидной цепи, COOH - C-конец. Зеленые прямоугольники обозначают участки связывания: Са2+ - ионов кальция, Mg-ATP - молекулы АТФ, PLB - фосфоламбана (у Са-АТФазы эндоплазматического ретикулума), CM - кальмодулина (у цитоплазматической Са-АТФазы). P - участок фосфорилирования |
На рис. 4 приведено схематическое изображение Са-АТФазы саркоплазматического ретикулума скелетных мышц. Фермент пронизывает мембрану 11-ю a-спиральными участками, большая часть которых соединена снаружи короткими полипептидными связками, за исключением двух протяженных гидрофильных (т. е. хорошо растворимых в воде) петель на стороне цитоплазмы. Более короткая петля расположена между a-спиралями М2 и М3, более длинная - между a-спиралями М4 и М5. Длинная петля содержит АТФ-связывающий участок, включающий остаток аспарагиновой кислоты, к которому присоединяется фосфат. Связывание ионов Ca2+ происходит на участке, образованном малой петлей (между a-спиралями 2М и 3М), возможно с участием аминокислотных остатков, прилежащих к спиралям М1 и М4. В местах связывания собрано несколько остатков аспарагиновой кислоты, несущих отрицательные заряды.
Другие Са-АТФазы
Даже в одних и тех же клетках поперечно-полосатых мышц содержится не менее двух изоферментов Са-АТФазы, встроенной в мембраны эндоплазматического ретикулума, которые различаются по чувствительности к кофеину. Вообще же можно говорить о целом семействе кальциевых АТФаз. Различают Са-АТФазы цитоплазматических мембран и Са-АТФазы эндоплазматического (в том числе саркоплазматического) ретикулума. Каждая из них представлена несколькими изоформами. Плазматическая Са-АТФаза, в отличие от саркоплазматической, содержит третью петлю полипептидной цепи, экспонированной в цитоплазму и образуемый С-концом. На рис. 4 она обозначена красным цветом. На этом домене имеется центр связывания кальмодулина - регуляторного белка, который, помимо ряда других функций, реактивирует плазматическую Са-АТФазу, о чем будет сказано в следующем разделе.
Регуляция активности транспортных АТФаз
Активность кальциевых АТФаз внутриклеточных депо (например, эндоплазматического ретикулума клеток сердца, печени или эпителия) регулируется особым белком - фосфоламбаном, который связывает участок пептидной цепи АТФазы неподалеку от места фосфорилирования (см. рис. 4) и тормозит работу фермента за счет уменьшения сродства участков связывания Ca2+ к этому иону. При необходимости, внутриклеточные регуляторные системы "отцепляют" фосфоламбан от АТФазы, и ее работа восстанавливается. Это осуществляется за счет фосфорилирования фосфоламбана протеинкиназами. Фосфорилированный фосфоламбан не обладает способностью связываться с Са-АТФазой и снижать ее активность.
Основным регулятором кальциевых АТФаз цитоплазматической мембраны служит другой белок - кальмодулин. Его действие как бы противоположно действию фосфоламбана. Дело в том, что цитоплазматическая Са-АТФаза обладает любопытной способностью ингибировать саму себя. Ее С-конец, экспонированный, как уже говорилось, в цитоплазму, загибается и, подобно жалу скорпиона, поражает Са-АТФазу "прямо в сердце", блокируя центры связывания кальция. Кальмодулин берет на себя функцию защитника: он связывается с участком вблизи С-конца (см. рис. 3) и снимает ингибирование Са-АТФазы, лишая полипептидный хвост способности связываться с активным участком АТФазы. Таким образом, если фосфоламбан ингибирует эндоплазматическую Са-АТФазу, то кальмодулин реактивирует "аутоингибированную" цитоплазматическую Са-АТФазу. Несмотря на противоположное действие, кальмодулин и фосфоламбан - родственники: сравнение аминокислотных последовательностей показывает, что многие участки полипептидной цепи у них совпадают. Изобретательная природа сумела один и тот же исходный материал (белок-предшественник, как бы пра-кальмодулин) приспособить для выполнения противоположных функций.
Нарушение активности Са-АТФазы в патологии
У экспериментальных животных, страдающих гипертонией, снижена активность кальциевых АТФаз в гладких мышцах стенок кровеносных сосудов. Это снижение активности приводит к повышению содержания внутриклеточного кальция. А поскольку ионы Ca2+ запускают механизм мышечного сокращения, тонус сосудистой стенки увеличен, а это приводит к повышению кровяного давления в целом организме.
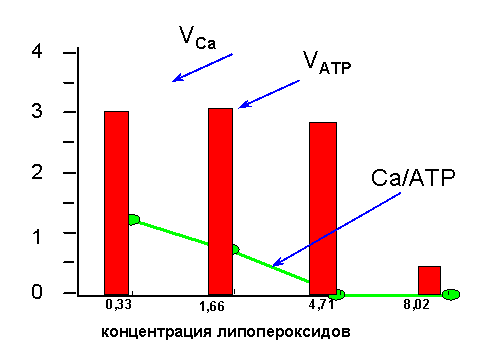
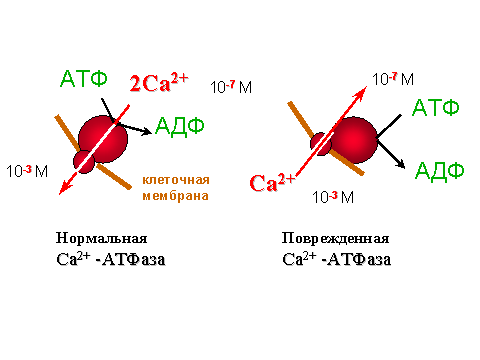
В числе причин поражения Са-АТФазы у гипертоников называют активацию процессов с участием свободных радикалов. Действительно, в модельных опытах с изолированными везикулами саркоплазматического ретикулума было показано, что Са-АТФаза очень чувствительна к перекисному окислению липидов, при котором происходит окисление SH-групп, входящих в активный центр фермента. Мало того, что "подпорченная" таким образом Са-АТФаза перестает качать ионы кальция (см. рис. 5); из насоса она превращается в канал для кальция, через который эти ионы начинают переноситься не из цитозоля в ретикулум, как им полагается, а наоборот, из ретикулума, где их концентрация выше, в клеточный сок, где их концентрация ниже (см. рис. 6).
| Ещё посмотрите лекцию "Контрольные вопросы к лекциям" по этой теме.
| Рис. 5. Изменение активности Са-АТФазы при перекисном окислении липидов мембран саркоплазматического ретикулума. По оси ординат отложена скорость гидролиза АТФ и переноса ионов кальция (в относительных единицах) и отношение числа перенесенных внутрь везикул ионов кальция к числу молекул гидролизованного АТФ. Видно, что способность фермента гидролизовать АТФ не изменяется вплоть до концентрации продуктов окисления липидов 4,7 мкмоль/г белка; к этому моменту способность ретикулума накапливать кальций полностью утрачивается (отношение Ca/ATP снижается и скорость накопления кальция VCa тоже падает). Объяснение данных этого опыта приведено на рис. 6. |
Превращение Са-АТФазы из помпы в канал предопределено ее структурой. Подобно велосипедному насосу, Са-АТФаза состоит из трубки, поршня и клапанов. Трубка - это ионный канал, состоящий из сравнительно небольшого фрагмента полипептидной цепи, который удалось отделить от остальной части АТФазы обработкой фермента протеазами, выделить и очистить. При встраивании этих фрагментов в липосомы их мембраны становятся проницаемыми для ионов Са2+. При перекисном окислении липидов, окружающих АТФазу, ее поршень и клапаны, по-видимому, ломаются, и ионы кальция начинают беспрепятственно течь по трубке в сторону меньшей концентрации.
|
| Рис. 6. Нарушение работы Са-АТФазы после повреждения фермента под действием процесса перекисного окисления липидов мембран Способность АТФазы гидролизовать АТФ сохраняется, но кальций не накачивается (сравни данные на рис. 5), а наоборот, начинает выходить из ретикулума, как показали специальные опыты. Ионный насос превратился в ионный канал. |
Подобного типа повреждение кальциевых насосов, надо думать, происходит нередко. Хорошо известна роль свободных радикалов в развитии широкого круга так называемых дегенеративных болезней, включая рак, многие интоксикации, болезни, связанные с атеросклерозом и иммунными нарушениями. Во многих случаях повреждение Са-АТФаз свободными радикалами может играть не последнюю роль в зарождении и развитии заболевания.