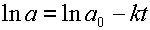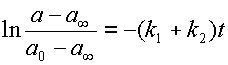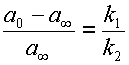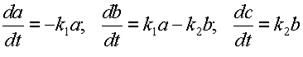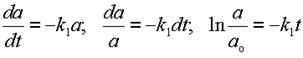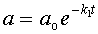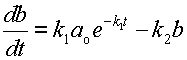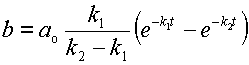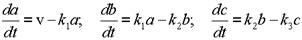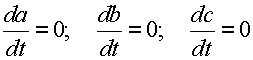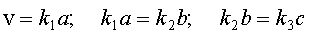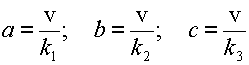Кинетика химических реакций
Кинетика химических реакций
Введение
Когда происходит химическая реакция, то одни вещества - субстраты реакции - превращаются в другие - продукты реакции. Соответственно этому, с течением времени после начала процесса концентрация субстратов уменьшается, а концентрация продуктов - возрастает. Зависимость изменения концентрации участников реакции (т.е. субстратов и продуктов) от времени называют кинетикой реакции. Кривые таких зависимостей называют кинетическими кривыми, а математические уравнения, которые описывают кинетические кривые, называют уравнениями кинетики.
Итак, повторим некоторые определения:
- Субстраты - вещества, вступающие в реакцию
- Продукты - вещества, образующиеся в результате реакции
- Промежуточные вещества -продукты, сразу же вступающие в новую реакцию
- Скорость реакции - изменение концентрации одного из продуктов, который рассматривается в качестве главного.
Скорость химической реакции
Концентрации веществ в химии принято выражать в киломолях на кубический метр (кмоль/м3) или, что то же самое, в молях на литр (моль/л). Концентрации в таких единицах называют молярными концентрациями и обозначают большой буквой М. Полумолярный раствор (0,5 моль/л) NaCl обозначают как 0,5М NaCl.
Молярная концентрация вещества в химической кинетике обозначается формулой того же вещества, заключенной в квадратные скобки. Так [Fe2+] - это молярная концентрация ионов двухвалентного железа.
Скорость химической реакции - это изменение концентрации какого-либо из участников реакции за секунду. Таким образом в реакции:
Fe2+ + HOOH ® Fe3+ + OH- + HO•
Рекомендуемые материалы
скорость реакции это:
|
|
От чего зависит скорость реакции
Интуитивно, каждый понимает, что число молекул, которые вступят в реакцию за единицу времени, зависит от ряда обстоятельств:
- от концентрации реагирующих молекул, т.е. от концентрации первого субстрата реакции; в нашем случае это концентрация ионов Fe2+.
- от вероятности встретить другую молекулу, которая пропорциональна числу молекул в единице объёма, а следовательно пропорциональна молярной концентрации второго субстрата реакции; в нашем случае это величина [HOOH].
- от вероятности того, что столкнувшиеся молекулы прореагируют. Обозначим её через р.
Таким образом, скорость реакции в нашем случае будет равна:
|
| (1) |
,
где K- коэффициент пропорциональности. Произведение констант K ´ p в свою очередь является некоторой постоянной и называется константой скорости реакции. Обозначим её через k.
|
| (2) |
Порядок рeакции
Поскольку скорость реакции взаимодействия двух веществ пропорциональна произведению концентраций этих двух субстратов, такого типа реакции называются реакциями второго порядка.
Если бы для реакции требовалось одновременное участие трёх субстратов, то скорость её должна была бы зависеть от произведения концентраций всех трёх веществ, и мы бы имели реакцию третьего порядка. Этого однако практически не бывает, поскольку в подобных ситуациях сначала обычно реагируют две молекулы. а уж потом в дело вступает третья.
Известны реакции, где имеется всего один субстрат; сюда относятся реакции распада или изомеризации веществ. В этом случае скорость реакции пропорциональна концентрации этого одного субстрата. Такие реакции называются реакциями первого порядка. Скорость реакции первого порядка A ® B равна:
|
| (3) |
Кинетика простейших реакций
Изучение химических реакций включает в себя выяснение строения продуктов реакции и изучение скорости реакции, а также зависимости скорости от условий протекания реакции: температуры, состава и свойств растворителя и т Практически исследователь имеет возможность, используя различные методы анализа, например спектрофотометрию, измерять непрерывно или время от времени концентрацию одного или нескольких субстратов и продуктов. Зависимость концентрации от времени (кинетические кривые) сравниваются с кривыми, полученными путём расчётов, т.е. с результатами математического моделирования процесса. Рассмотрим, как будут выглядеть кинетические кривые в разных случаях.
Реакции первого порядка
Как уже говорилось, кинетика реакции первого порядка описывается дифференциальным уравнением 3, из которого можно сразу найти зависимость от времени концентрации субстрата реакции [A]. Для этого разделим переменные и проинтегрируем:
|
| (4) |
Откуда
|
| (5) |
Если все молекулы субстрата A превратились в молекулы продукта B, то найти изменение во времени концентрации продукта можно, используя уравнение материального баланса:
|
| (6) |
Откуда
|
| (7) |
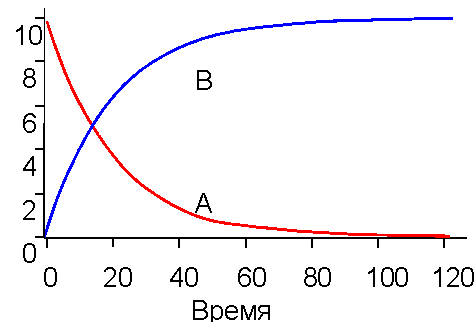
Кривые зависимости субстрата и продукта реакции от времени даны на рис.1.
|
| Рис. 1. Кинетика реакции первого порядка Построено по уравнению A=10exp(x/20) B=10-A |
Обратимые реакции
Предположим, вещество A может превращаться в вещество B, а оно, в свою очередь, обратно переходит в вещество A. Изменение концентрации вещества A обусловлено одновременным протеканием двух реакций: распада A со скоростью k1[A] и его образования со скоростью k2[B]. Скорость изменения концентрации вещества A равна разности этих величин:
|
| (8) |
Надо сказать, что чем сложнее схема реакции, тем сложнее соответствующая система уравнений, и преобразования могут стать довольно громоздкими. Поэтому в дальнейшем мы наряду с распространенным обозначением концентрации будем использовать переменные в виде малых латинских букв, т.е. a вместо [A], b вместо [B] и т
Концентрацию b находим из уравнения 6 материального баланса и подставляем в уравнение 8.
|
| (9) |
или, используя новые, более компактные обозначения:
|
| (10) |
Произведём разделение переменных:
|
| (10) |
и интегрирование в пределах от ao до a и от 0 до t:
|
| (11) |
После преобразований получаем весьма громоздкое выражение для значения концентрации субстрата:
 откуда
откуда 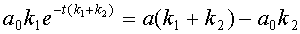
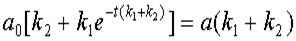
 (12)
(12)
Это выражение можно несколько упростить, если ввести понятие равновесной концентрации вещества A:  при
при  .
.
|
| (13) |
Из уравнения 12 получаем ,
|
| (14) |
Что вместе с 12 дает:
С другой стророны, из уравнения 13 находим
|
| (15) |
Разделив уравнение 14 на 15, получаем очень интересное выражение:
|
| (16) |
Откуда
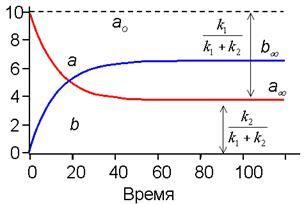
На рис. 2 приведены кривые кинетики (изменения во времени концентраций) для веществ A и B в случае обратимого процесса. Анализ этих кривых, если они получены экспериментально, сразу позволяет найти отношение констант скоростей k1/k2. Чтобы определить сами скорости, необходимо построить график в виде линейной анаморфозы (см. ниже).
|
| Рис. 2. Кинетика обратимой мономолекулярной реакции По отношению отрезков ординат для a при достижении равновесия (a¥ ) находим соотношение констант прямой и обратной реакции. (см. уравнение 16) |
Построение линейных анаморфоз
В химической кинетике кривые, полученные в эксперименте, стремятся путем математических операций превратить в прямые линии, поскольку анализ прямых позволяет получать параметры, включающие в себя константы скоростей реакций. Рассмотрим это на примерах обратимых и необратимых мономолекулярных реакций.
Для необратимой реакции существует линейная зависимость между логарифмом концентрации субстрата реакции и временем (см. уравнение 5):
|
| (17) |
Если найти опытным путем концентрации вещества A через разные промежутки времени после начала реакции, а затем построить график зависимости натурального логарифма концентрации от времени, то по тангенсу угла наклона полученной при этом прямой сразу находим константу скорости, поскольку она является угловым коэффициентом данной прямой (см. рис. 3).
|
| Рис. 3. Кривая расхода субстрата мономолекулярной реакции в полулогарифмическом масштабе. Объяснения даны в тексте. |
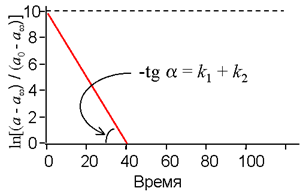
Построение линейной анаморфозы кинетической кривой для концентрации субстрата обратимой мономолекулярной реакции требует экспериментального определения равновесной концентрации субстрата a¥ , т.е. той концентрации, которая установится по источению некоторого времени и в дальнейшем не будет изменяться. Затем из экспериментальных данных рассчитывается для каждого момента времени, при котором определяли концентрации, отношение  , натуральный логарифм которого откладываем по ординате графика как функцию времени (см. рис. 4). Получается прямая линия (см. уравнение 16):
, натуральный логарифм которого откладываем по ординате графика как функцию времени (см. рис. 4). Получается прямая линия (см. уравнение 16):
|
| (18) |
По тангенсу угла наклона этой прямой находим сумму констант скоростей прямой и обратной реакции (см. рис. 4).
|
| Рис. 4. Кинетика обратимой мономолекулярной реакции Данные представлены в формате, позволяющем найти сумму констант скоростей прямой и обратной реакции по тангенсу угла наклона прямой. Объяснения - в тексте. |
Отношение констант мы находим из уравнения 13
|
| (19) |
Это уравнение нужно сопоставить с кривой на рисунке 2.
Мы надеемся, что читатель сумеет рассчитать константы скорости, зная их отношение и сумму .
Последовательные и параллельные реакции
Последовательные реакции с одним промежуточным продуктом
Рассмотрим кинетику реакции превращения вещества A в вещество B, которое затем сразу же превращается в вещество C. Вещество В называют промежуточным соединением или интермедиантом.
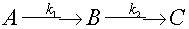
Запишем уравнения кинетики, т.е. дифференциальные уравнения, описывающие скорости реакций образования всех трёх участников:
|
| (20 - 22) |
а также уравнение материального баланса:
| a + b + c = ao | (23) |
Уравнение 20 решается после разделения переменных:
|
| (24) |
Откуда
|
| (25) |
Подставив значение a в уравнение 21, получаем дифференциальное уравнение:
|
| (26) |
Решением уравнения 26 служит следующее выражение
|
| (27) |
Имея значения a и b в каждый данный момент времени, можно подсчитать значение c по уравнению 23.
Примеры кинетических кривых, рассчитанных по уравнениям 6, 8 и 4, даны на рис. 1.
Стационарное состояние
В организме концентрации основных метаболитов поддерживаются на более или менее постоянном уровне; это означает, что скорость образования каждого метаболита равна скорости его утилизации. Такое состояние системы называется стационарным.
Для более строгого определения стационарного состояния рассмотрим последовательные реакции образования метаболита A и его превращения в промежуточные продукты B и C.
|
| (28) |
Скорости накопления продуктов равны
|
| (29) |
По определению, в стационарном стоянии
|
| (30) |
а следовательно:
|
| (31) |
Теперь нетрудно найти значения стационарных концентраций A, B и C:
|
| (32) |
Это простое уравнение полно глубокого смысла. В словесной формулировке оно выражает закон:
Информация в лекции "Критерии качества интерфейса (продолжение)" поможет Вам.
Стационарная концентрация метаболитов пропорциональна скорости их образования и обратно пропорциональна константе их распада.
Назовём для большей образности величину, обратную константе распада, стабильностью данного соединения. Из уравнения 32 следует, что
Чем стабильнее соединение, тем выше его стационарная концентрация
"Ловушки" нестабильных метаболитов
Возможность аналитического определения веществ в биохимической системе в основном определяется их концентрацией. Например, используя спектральные измерения поглощения света, можно определить концентрацию вещества в области от 10 до 100 мкМ (10-4 - 10-5М). С помощью измерений флуоресценции удаётся определять на 2-3 порядка более низкие концентрации флуоресцирующих соединений. Биолюминесценция в системе люциферин-люцифераза светляка позволяет измерять концентрации АТФ от 10-12 до 10-15М.
Несмотря на высокую чувствительность современным биохимических методов, многие метаболиты образуются медленно, а распадаются очень быстро и их стационарная концентрация (в полном соответствии с уравнением 32) слишком мала для её определения и даже для простого обнаружения метаболита. Типичный пример - это реакции с участием свободных радикалов. Свободные радикалы образуются не в очень уж больших количествах, а главное - обладают очень низкой стабильностью (т.е. высокой скоростью реакций с другими соединениями); поэтому обычно их не удаётся зарегистрировать ни одним из существующих методов, включая метод epr. Выход из положения был найден благодаря использованию спиновых ловушек: молекул, которые перехватывают радикалы, давая новые радикалы, но уже устойчивые (стабильные, т.е. с низкой скоростью взаимодействия с другими веществами).



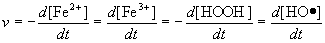
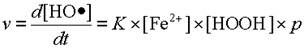
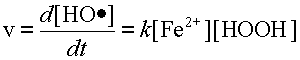
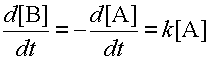
 ;
;  ;
; 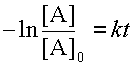
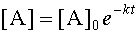
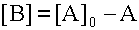
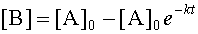
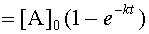
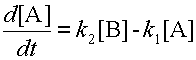
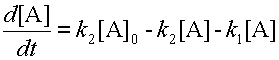
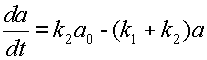
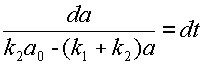
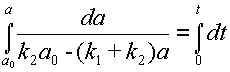
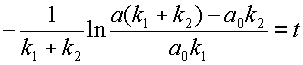
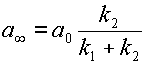
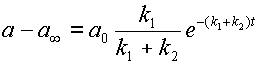
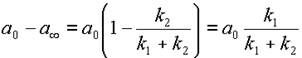
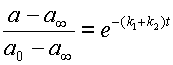
 , откуда
, откуда