Второй закон термодинамики
Г л а в а третья. Второй закон термодинамики
3.1. ЭНТРОПИЯ
Как уже указывалось, величина δq = du + pdv не является полным дифференциалом. Действительно, для того чтобы проинтегрировать правую часть этого выражения, нужно знать зависимость р от v, т. е. процесс, который совершает газ.
В математике доказывается, что дифференциальный двучлен всегда можно превратить в полный дифференциал путем умножения (или деления) на интегрирующий множитель (или делитель). Таким интегрирующим делителем для элементарного количества теплоты dq является абсолютная температура Т.
Покажем это на примере изменения параметров идеального газа в равновесных процессах:
 (3.1)
(3.1)
Выражение δq/Т при равновесном изменении состояния газа есть полный дифференциал некоторой функции состояния. Она называется энтропией, обозначается для 1 кг газа через s и измеряется в Дж/(кг К). Для произвольного количества газа энтропия, обозначаемая через S
S=Ms, Дж/К.
Рекомендуемые материалы
Таким образом, аналитически энтропия определяется следующим образом:
ds = δq/T (3.2)
Формула (3.2) справедлива как для идеальных газов, так и для реальных тел.
Подобно любой другой функции состояния энтропия может быть представлена в виде функции любых двух параметров состояния:
s = ξ1(p,v); s = ξ2(p,T); s = ξ3(v,T).
Значение энтропии для заданного состояния определяется интегрированием уравнения (3.2):
s = 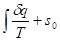
где s0 – константа интегрирования.
При температурах, близких к абсолютному нулю, все известные вещества находятся в конденсированном состоянии. В. Нернст (1906 г.) экспериментально установил, а М. Планк (1912 г.) окончательно сформулировал следующий принцип: при температуре, стремящейся к абсолютному нулю, энтропия вещества, находящегося в конденсированном состоянии с упорядоченной кристаллической структурой, стремится к нулю, т.е. So = 0 при T = 0 К. Этот закон называют т р е т ь и м з а к о н о м т е р м о д и н а м и к и или тепловой теоремой Нернста. Он позволяет рассчитать абсолютное значение энтропии в отличие от внутренней энергии и энтальпии, которые всегда отсчитываются от произвольного уровня.
Однако в технической термодинамике обычно используется не абсолютное значение энтропии, а ее изменение в каком-либо процессе:
 (3.3)
(3.3)
поэтому энтропию тоже часто отсчитывают от произвольно выбранного уровня.
Получим формулы, позволяющие вычислить изменение энтропии идеального газа. Для этого проинтегрируем уравнение (3.1), положив для простоты сv = const:
s2 – s1 = cv ln(T2/T1) + R ln(v2/v1) (3.4)
Из уравнения Клапейрона, записанного для состояний 1 и 2, следует:
T2/T1 = p2v2/p1v1; v2/v1 = T2p1/T1p2
После подстановки отношений T2/T1 и v2/v1 в выражение (3.4) получим следующие формулы для изменения энтропии идеального газа:
s2 – s1 = cp ln(T2/T1) + R ln(p2/p1) (3.5)
s2 – s1 = cv ln(p2/p1) + cp ln(v2/v1) (3.6)
Поскольку энтропия есть функция состояния рабочего тела, уравнениями (3.4) — (3.6) можно пользоваться вне зависимости от пути перехода рабочего тела между состояниями 1 и 2 и, в частности, от того, равновесный этот переход или нет.
Понятие энтропии позволяет ввести чрезвычайно удобную для термодинамических расчетов Т, s-диаграмму, на которой (как и на р,v- диаграмме) состояние термодинамической системы изображается точкой, а равновесный термодинамический процесс линией (рис. 3.1).
Из уравнения (3.2) следует, что в равновесном процессе
δq = Tds (3.7)
q =  (3.8)
(3.8)
Очевидно, что в Т, s-диаграмме элементарная теплота процесса δq изображается элементарной площадкой с высотой Т и основанием ds, а площадь, ограниченная линией процесса, крайними ординатами и осью абсцисс, эквивалентна теплоте процесса.
Формула (3.7) показывает, что ds и δq имеют одинаковые знаки, следовательно, по характеру изменения энтропии в равновесном процессе можно судить о том, в каком направлении происходит теплообмен. При подводе теплоты к телу (δq >0) его энтропия возрастает (ds> 0), а при отводе теплоты (δq <0) — убывает (ds<0).
3.2. ОБЩАЯ ФОРМУЛИРОВКА ВТОРОГО ЗАКОНА
Из первого закона термодинамики следует, что взаимное превращение тепловой и механической энергии в двигателе должно осуществляться в строго эквивалентных количествах. Двигатель, который позволял бы получать работу без энергетических затрат, называется вечным двигателем первого рода. Ясно, что такой двигатель невозможен, ибо он противоречит первому закону термодинамики. Поэтому первый закон можно сформулировать в виде следующего утверждения: вечный двигатель первого рода невозможен. В 1755 г. французская Академия наук «раз и навсегда» объявила, что не будет больше принимать на рассмотрение какие-либо проекты вечных двигателей.
Несмотря на эквивалентность теплоты и работы, процессы их взаимного превращения неравнозначны. Опыт показывает, что механическая энергия может быть полностью превращена в теплоту, например, путем трения, однако теплоту полностью превратить в механическую энергию в периодически повторяющемся процессе нельзя. Многолетние попытки осуществить такой процесс не увенчались успехом. Это связано с существованием фундаментального закона природы, называемого в т о р ы м з а к о н о м т е р м о д и н а м и к и. Чтобы выяснить его сущность, обратимся к принципиальной схеме теплового двигателя (рис. 3.2).
Как показал опыт, все без исключения тепловые двигатели должны иметь горячий источник теплоты, рабочее тело, совершающее замкнутый процесс — цикл, и холодный источник теплоты.
Практически в существующих тепловых двигателях горячими источниками служат химические реакции сжигания топлива или внутриядерные реакции, а в качестве холодного источника используется окружающая среда - атмосфера. В качестве рабочих тел, как отмечалось выше, применяются газы или пары.
Работа двигателя осуществляется следующим образом (рис. 3.3). Расширяясь по линии 1B2, рабочее тело совершает работу, равную площади 1В22111. В непрерывно действующей тепловой машине этот процесс должен повторяться многократно. Для этого нужно уметь возвращать рабочее тело в исходное состояние. Такой переход можно осуществить в процессе 2В1, но при этом потребуется совершить над рабочим телом ту же самую работу. Ясно, что это не имеет смысла, так как суммарная работа — работа цикла — окажется равной нулю.
Для того чтобы двигатель непрерывно производил механическую энергию, работа расширения должна быть больше работы сжатия. Поэтому кривая сжатия 2А1 должна лежать ниже кривой расширения. Затраченная в процессе 2А1 работа изображается площадью 2А11121 . В результате каждый килограмм рабочего тела совершает за цикл полезную работу lц, эквивалентную площади 1В2А1, ограниченной контуром цикла. Цикл можно разбить на два участка: А1В,на котором происходит подвод теплоты q1 и В2А, на котором происходит отвод теплоты q2. В точках А и В нет ни подвода ни отвода теплоты, и в этих точках поток теплоты меняет знак. Таким образом для непрерывной работы двигателя необходим циклический процесс, в котором к рабочему телу от горячего источника подводится теплота q1 и отводится от него к холодному теплота q2. В Т,s - диаграмме теплота q1 эквивалентна площади А1А1ВВ1 , а q2 площади А1А2ВВ1.
Применим первый закон термодинамики к циклу, который совершает 1 кг рабочего тела:
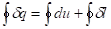
Здесь  означает интегрирование по замкнутому контуру 1В2А1.
означает интегрирование по замкнутому контуру 1В2А1.
Внутренняя энергия системы является функцией состояния. При возвращении рабочего тела в исходное состояние она также приобретает исходное значение. Поэтому  du = 0, и предыдущее выражение превращается в равенство
du = 0, и предыдущее выражение превращается в равенство
qц = lц (3.9)
где qц=  δq представляет собой ту часть теплоты горячего источника, которая превращена в работу. Это — теплота, полезно использованная в цикле, она равна разности теплот q1 – q2 и эквивалентна площади, ограниченной контуром цикла в T,s-диаграмме.
δq представляет собой ту часть теплоты горячего источника, которая превращена в работу. Это — теплота, полезно использованная в цикле, она равна разности теплот q1 – q2 и эквивалентна площади, ограниченной контуром цикла в T,s-диаграмме.
Отношение работы, производимой двигателем за цикл, к количеству теплоты, подведенной за этот цикл от горячего источника, называется термическим коэффициентом полезного действия (КПД) цикла:
ηt = lц/ q1 = (q1 - q2 )/q1 (3.10)
Коэффициент полезного действия оценивает степень совершенства цикла теплового двигателя. Чем больше КПД, тем большая часть подведенной теплоты превращается в работу.
Соотношение (3.9) является математическим выражением принципа эквивалентности тепловой и механической энергии.
Отметим, что если исключить из схемы теплового двигателя холодный источник, то формально принцип эквивалентности не будет нарушен. Однако, как показывает опыт и как следует из проведенного выше анализа работы двигателя, такой двигатель работать не будет.
Тепловой двигатель без холодного источника теплоты, т. е. двигатель, полностью превращающий в работу всю полученную от горячего источника теплоту, называется вечным двигателем второго рода.
Таким образом, второй закон термодинамики можно сформулировать в виде следующего утверждения: «Вечный двигатель второго рода невозможен».
3.3. ПРЯМОЙ ЦИКЛ КАРНО
Итак, для превращения теплоты в работу в непрерывно действующей машине нужно иметь по крайней мере тело или систему тел, от которых можно было бы получить теплоту (горячий источник); рабочее тело, совершающее термодинамический процесс, и тело, или систему тел, способную охлаждать рабочее тело, т. е. забирать от него теплоту, не превращенную в работу (холодный источник).
Рассмотрим простейший случай, когда имеется один горячий с температурой Т1 и один холодный с температурой Т2 источники теплоты. Теплоемкость каждого из них столь велика, что отъем рабочим телом теплоты от одного источника и передача ее другому практически не меняет их температуры. Хорошей иллюстрацией могут служить земные недра в качестве горячего источника и атмосфера в качестве холодного.
Единственная возможность осуществления в этих условиях цикла, состоящего только из равновесных процессов, заключается в следующем. Теплоту от горячего источника к рабочему телу нужно подводить изотермически. В любом другом случае температура рабочего тела будет меньше температуры источника Т1, т. е. теплообмен между ними будет неравновесным. Равновесно охладить рабочее тело от температуры горячего до температуры холодного источника Т2, не отдавая теплоту другим телам (которых по условию нет), можно только путем адиабатного расширения с совершением работы.
По тем же соображениям процесс теплоотдачи от рабочего тела к холодному источнику тоже должен быть изотермическим, а процесс повышения температуры рабочего тела от Т1 до Т2 — адиабатным сжатием с затратой работы. Такой цикл, состоящий из двух изотерм и двух адиабат, носит название цикла К а р н о, поскольку именно с его помощью
С. Карно в 1824 г. установил основные законы превращения тепловой энергии в механическую.
Осуществление цикла Карно в тепловой машине можно представить следующим образом. Газ (рабочее тело) с начальными параметрами, характеризующимися точкой а (рис. 3.4), помещен в цилиндр под поршень, причем боковые стенки цилиндра и поршень абсолютно нетеплопроводны, так что теплота может передаваться только через основание цилиндра.
Вводим цилиндр в соприкосновение с горячим источником теплоты. Расширяясь изотермически при температуре Т1 от объема vа до объема vь, газ забирает от горючего источника теплоту q1 = Т1(s2 – s1). В точке b подвод теплоты прекращаем и ставим цилиндр на теплоизолятор. Дальнейшее расширение рабочего тела происходит адиабатно. Работа расширения совершается при этом только за счет внутренней энергии, в результате чего температура газа падает до Т2.
Теперь возвратим тело в начальное состояние. Для этого сначала поместим цилиндр на холодный источник с температурой Т2 и будем сжимать рабочее тело по изотерме cd, совершая работу l2 и отводя при этом к нижнему источнику от рабочего тела теплоту q2 = Т2(s2 – s1) . Затем снова поставим цилиндр на теплоизолятор и дальнейшее сжатие проведем в адиабатных условиях. Работа, затраченная на сжатие по линии da, идет на увеличение внутренней энергии, в результате чего температура газа увеличивается до Т1.
Таким образом, в результате цикла каждый килограмм газа получает от горячего источника теплоту q1, отдает холодному теплоту q2 и совершает работу lц.
Подставив в формулу (3.10), справедливую для любого цикла, выражения для q1 и q2, получим, что термический КПД цикла Карно определяется формулой
ηt = 1 – T2/T1 (Т2 < Т1) (3.11)
Из нее видно, что термический КПД цикла Карно зависит только от абсолютных температур горячего и холодного источников. Увеличить КПД цикла можно либо за счет увеличения температуры горячего источника, либо за счет уменьшения температуры холодного, причем влияние температур T1 и T2 на значение ηt различно:

ð ηt / ðT1 = T2/T12,
ð ηt / ðT2 = - 1/T1 = - Т1/Т12,
а так как Т1>T2, то | ð ηt / ðT2| > | ð ηt / ðT1|.
Таким образом, увеличение температуры горячего источника в меньшей степени повышает КПД цикла Карно, чем такое же (в Кельвинах) уменьшение температуры холодного.
Являясь следствием второго закона термодинамики, формула для КПД цикла Карно, естественно, отражает его содержание. Из нее видно, что теплоту горячего источника можно было бы полностью превратить в работу, т. е. получить КПД цикла, равный единице, лишь в случае, когда Т1  либо Т2
либо Т2 0 .Оба значения температур недостижимы. (Недостижимость абсолютного нуля температур следует из третьего начала термодинамики).
0 .Оба значения температур недостижимы. (Недостижимость абсолютного нуля температур следует из третьего начала термодинамики).
При Т1 = Т2 термический КПД цикла равен нулю. Это указывает на невозможность превращения теплоты в работу, если все тела системы имеют одинаковую температуру, т. е. находятся между собой в тепловом равновесии.
Для ориентировки приводим значения термического КПД цикла Карно при различных температурах горячего источника и при температуре холодного источника, равной 10 °С. Так при изменении температуры горячего источника от 200 до 1600оС КПД изменяется от 0,4 до 0,85.
Приведенные цифры дают КПД идеального цикла. Коэффициент полезного действия реального теплового двигателя будет, конечно, ниже.
3.4. ОБОБЩЕННЫЙ (РЕГЕНЕРАТИВНЫЙ) ЦИКЛ КАРНО
При наличии только двух источников теплоты с температурами Т1 и Т2 можно осуществить более сложный цикл, если использовать
р е г е н е р а ц и ю т е п л о т ы. Сущность ее заключается в следующем.
Рассмотрим цикл adfe на рис. 3.5, а, состоящий из двух изотерм ab и fe и двух равновесных процессов bf и ea, линии которых эквидистантны в T, s-диаграмме. Для равновесного нагрева рабочего тела по линии еа и охлаждения по линии bf нужно располагать бесконечно большим количеством источников теплоты, чтобы при каждой температуре в диапазоне T2— T1 теплообмен между источником теплоты и рабочим телом протекал равновесно. Однако можно осуществить процесс так, чтобы теплота δq, выделяющаяся при охлаждении тела при температуре Т по линии bf, затрачивалась на нагрев тела при той же температуре по линии еа. Если линии еа и bf эквидистантны, то количества отданной при охлаждении (площадь ifbk) и полученной при нагреве (площадь geah) теплоты одинаковы, т. е. теплота, выделенная при охлаждении по линии bf, полностью используется (регенерируется) по линии еа.
От горячего источника при температуре T1 по-прежнему подводится теплота q1, эквивалентная площади habk, и к холодному источнику при температуре T2 теплота q2 , соответствующая площади gefi.
Термический КПД данного цикла
 ,
,
но sк — sh, = si — sg вследствие эквидистантности кривых bf и еа, поэтому
ηt = (T1 – T2)/T1.
Таким образом, равновесные циклы, подобные рассмотренному и осуществляемые так же, как и цикл Карно, между двумя источниками теплоты, имеют КПД, равный КПД цикла Карно. Они называются обобщенными (регенеративными) циклами Карно.
Во всех других случаях любой цикл с верхней температурой T1 и нижней температурой T2 имеет термический КПД ниже, чем цикл Карно. На рис. 3.5, б изображен произвольный цикл efgh, осуществимый при наличии бесконечно большого количества источников теплоты. Опишем вокруг этого цикла цикл Карно abcd и обозначим через А, В и т.д. соответствующие площадки, тогда
 ;
;
 ;
;
отсюда следует, что  , т. е. при одинаковых предельных температурах цикл Карно имеет более высокий термический КПД, чем любой другой цикл. Поэтому формула ηt = 1 – Т2/Т1 выражает максимально возможную при заданных температурных условиях степень использования теплоты в цикле, и цикл Карно является своего рода эталоном, в сравнении с которым определяется степень эффективности любого цикла.
, т. е. при одинаковых предельных температурах цикл Карно имеет более высокий термический КПД, чем любой другой цикл. Поэтому формула ηt = 1 – Т2/Т1 выражает максимально возможную при заданных температурных условиях степень использования теплоты в цикле, и цикл Карно является своего рода эталоном, в сравнении с которым определяется степень эффективности любого цикла.
3.5. ОБРАТНЫЙ ЦИКЛ КАРНО
Осуществим цикл Карно в обратном направлении. Рабочее тело с начальными параметрами точки а (рис. 3.6) расширяется адиабатно, совершая работу расширения за счет внутренней энергии, и охлаждается от температуры Т1 до температуры Т2. Дальнейшее расширение происходит по изотерме, и рабочее тело отбирает от нижнего источника с температурой Т2 теплоту q2. Далее газ подвергается сжатию сначала по адиабате, и его температура от Т2 повышается до Т1, а затем — по изотерме (Т1 = const). При этом рабочее тело отдает верхнему источнику с температурой Т1 количество теплоты q1.
Общая схема преобразования энергии показана на рис. 3.7.
Поскольку в обратном цикле сжатие рабочего тела происходит при более высокой температуре, чем расширение, работа сжатия, совершаемая внешними силами, больше работы расширения на величину площади abcd, ограниченной контуром цикла. Эта работа превращается в теплоту и вместе с теплотой q2 передается верхнему источнику. Таким образом, затратив на осуществление обратного цикла работу lц можно перенести теплоту от источника с низкой температурой к источнику с более высокой температурой, при этом нижний источник отдаст количество теплоты q2, а верхний получит количество теплоты q1 = q2 + lц.
Обратный цикл Карно является идеальным циклом холодильных установок и так называемых тепловых насосов.
В холодильной установке рабочими телами служат, как правило, пары легкокипящих жидкостей — фреона, аммиака и т. п. Процесс «перекачки теплоты» от тел, помещенных в холодильную камеру, к окружающей среде происходит за счет затрат электроэнергии.
Э ф ф е к т и в н о с т ь х о л о д и л ь н о й у с т а н о в к и оценивается холодильным коэффициентом, определяемым как отношение количества теплоты, отнятой за цикл от холодильной камеры, к затраченной в цикле работе:
ε = q2/lц = q2/(q1- q2). (3.12)
Для обратного цикла Карно
ε = T2/(T1 – T2) (3.13)
Заметим, что чем меньше разность температур между холодильной камерой и окружающей средой, тем меньше нужно затратить энергии для передачи теплоты от холодного тела к горячему и тем выше холодильный коэффициент.
Холодильную установку можно использовать в качестве теплового насоса. Если, например, для отопления помещения использовать электронагревательные приборы, то количество теплоты, выделенное в них, будет равно расходу электроэнергии. Если же это количество электроэнергии использовать в холодильной установке, горячим источником, т. е. приемником теплоты q1 в которой является отапливаемое помещение, а холодным — наружная атмосфера, то количество теплоты, полученное помещением,
q1 = q2 + lц,
где q2 — количество теплоты, взятое от наружной атмосферы, а lц — расход
электроэнергии. Понятно, что, q1>l ц т. е. отопление с помощью теплового насоса выгоднее простого электрообогрева.
Используя обратный цикл Карно, рассмотрим еще одну формулировку второго закона термодинамики, которую в то же время, что и В. Томсон, предложил Р. Клаузиус: теплота не может самопроизвольно (без компенсации) переходить от тел с более низкой к телам с более высокой температурой.
Эта формулировка интуитивно следует из нашего повседневного опыта, который показывает, что самопроизвольно теплота переходит только от тел с более высокой к телам с более низкой температурой, а не наоборот. Можно доказать, что формулировка Р. Клаузиуса эквивалентна формулировке В. Томсона.
Действительно, если бы теплота q2, полученная за цикл холодным источником, могла самопроизвольно перейти к горячему источнику, то за счет нее снова можно было бы получить какую-то работу — вечный двигатель второго рода, таким образом, был бы возможным.
Из рассмотрения обратного цикла Карно следует, что передача теплоты от тела менее нагретого к телу более нагретому возможна, но этот неестественный (точнее – несамопроизвольный) процесс требует соответствующей энергетической компенсации в системе. В обратном цикле Карно в качестве такой компенсации выступала затраченная работа, но это может быть и затрата теплоты более высокого потенциала, способной совершить работу при переходе на более низкий потенциал.
3.8. ЭКСЕРГИЯ
Основываясь на втором начале Термодинамики, установим количественное соотношение между работой, которая могла бы быть совершена системой при данных внешних условиях в случае протекания в ней равновесных процессов, и действительной работой, производимой в тех же условиях, при неравновесных процессах.
Рассмотрим изолированную систему, состоящую из горячего источника с температурой Т1, холодного источника (окружающей среды) с температурой То и рабочего тела, совершающего цикл.
Э к с е р г и е й (или работоспособностью) т е п л о т ы Q1 отбираемой от горячего источника с температурой Т1 при неравновесных процессах, называется максимальная полезная работа, которая может быть получена за счет этой теплоты при условии, что холодным источником является окружающая среда с температурой То.
Из предыдущего ясно, что максимальная полезная работа L1макс теплоты Q1 представляет собой работу равновесного цикла Карно, осуществляемого в диапазоне температур Т1 – Т0:
L1макс = ηt Q1 (3.16)
где ηt = 1 - Т0/Т1
Таким образом, э к с е р г и я теплоты Q1
L1макс = Q1 (1 – Т0/Т1) (3.17)
т. е. работоспособность теплоты тем больше, чем меньше отношение То/Т1 . При Т1 = То она равна нулю.
Полезную работу, полученную за счет теплоты Q1 горячего источника, можно представить в виде L1 = Q1 — Q2,
где Q2 — теплота, отдаваемая в цикле холодному источнику (окружающей среде) с температурой Т0.
Если через Δsхол обозначить приращение энтропии холодного источника, то Q2 = Т0 sхол , тогда
L1 = Q1 – T0ΔSхол (3.18)
Если бы в рассматриваемой изолированной системе протекали только равновесные процессы, то энтропия системы оставалась бы неизменной, а увеличение энтропии холодного источника ΔSхол равнялось бы уменьшению энтропии горячего ΔSгор . В этом случае за счет теплоты Q1 можно было бы получить максимальную полезную работу
L1макс = Q1 – T0ΔSгор (3.19)
Что следует из уравнения (3.18).
Действительное количество работы, произведенной в этих же условиях, но при неравновесных процессах, определяется уравнением (3.18).
Таким образом, потерю работоспособности теплоты можно записать как
Если Вам понравилась эта лекция, то понравится и эта - 63 Автоматическая переездная сигнализация для участков с двухпутной кодовой АБ переменного тока 25 Гц с двухсторонним движением поездов.
ΔL = L1макс - L1 = T0(ΔSхол - ΔSгор),
Но разность (ΔSхол - ΔSгор) представляет собой изменение энтропии рассматриваемой изолированной системы, поэтому
ΔL = T0 ΔScист (3.20)
Величина ΔL определяет п о т е р ю р а б о т ы, обусловленную рассеиванием энергии вследствие неравновесности протекающих в системе процессов. Чем больше неравновесность процессов, мерой которой является увеличение энтропии изолированной системы ΔScист , тем меньше производимая системой работа.
Уравнение (3.20) называют уравнением Гюи — Стодолы по имени французского физика М. Гюи, получившего это уравнение в 1889 г., и словацкого теплотехника А Стодолы, впервые применившего это уравнение.






















