Прогноз термодинамической возможности электрохимической коррозии
Прогноз термодинамической возможности электрохимической коррозии.
Электрохимическая коррозия возможна, если равновесный потенциал окислительно-восстановительной пары Ox/Red оказывается выше равновесного потенциала металла, т.е.
jр (Ox/Red)>jр(Меn+/Me) .
Таким образом, коррозия термодинамически возможна, если окислительно-восстановительный потенциал раствора оказывается выше окислительно-восстановительного потенциала металла.
Иногда для оценки возможности протекания электрохимической коррозии используется упрощенный критерий через стандартные (а не равновесные потенциалы)
электрохимическая коррозия термодинамически возможна, если стандартный потенциал окислительно-восстановительной пары раствора выше стандартного потенциала металла.
Критерий для коррозии с водородной деполяризацией.
В этом случае в качестве окислительно- восстановительной реакции
выступает реакция восстановления ионов водорода
Рекомендуемые материалы
2H+ + 2e = H2
Равновесный потенциал для этой реакции при Р=1 ат определяется уравне-
нием Нернста
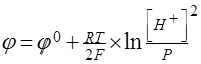
Из этого уравнения следует, что для нейтрального раствора (рН=7) [Н+]=10-7 и Р= 1 атм при j0=0 j= -0.41 В. Таким образом, если стандартный потенциал металла лежит отрицательнее -0.41 В, то коррозия этого металла с водородной деполяризацией возможна. В противном случае коррозия с водородной деполяризацией невозможна.
Ниже на схеме даны стандартные потенциалы некоторых металлов

Критерий для коррозии с кислородной деполяризацией.
В этом случае в качестве окислительно- восстановительной реакции
является реакция восстановления кислорода
O2 + 4H+ + 4e = 2H2O восстановление кислорода
Равновесный потенциал для этой реакции при Р=1 ат определяется уравне-
нием Нернста
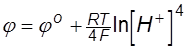
Для нейтрального раствора (рН=7) из этого уравнения получаем j=0.82 В.
Таким образом, если стандартный потенциал металла лежит отрицательнее 0.82 В, то коррозия этого металла с кислородной деполяризацией возможна. В противном случае коррозия с кислородной деполяризацией невозможна.

Кислород является более сильным окислителем, чем ион водорода
(окислительный потенциал 0.82 В его выше окислительного потенциала ио-
нов водорода -0.41 В).
Если Вам понравилась эта лекция, то понравится и эта - 30 Отмена крепостного права.
По значению стандартного потенциала металла все металлы можно расположить в ряд напряжений :
Ряд напряжений
Li, Cs, K, Na, Nd, La, Mg, U, Ti, Hf, Be, Al, Zr, V, Nb, Mn,
Cr(II), Zn, Cr(III), Ga, Fe(II), Cd, In, Tl, Co, Ni, Mо, Pb, Fe(III), Н,
Cu, Hg, Ag, Pd, Pt, Au.
Все металлы левее водорода могут корродировать с водородной деполяризацией, а все металлы правее водорода не могут корродировать с водородной деполяризацией.




















