Электрокинетические свойства дисперсных систем
Лекция 4. Электрокинетические свойства дисперсных систем.
Теории образования и строения двойного электрического слоя (ДЭС)
Электрокинетический потенциал
Влияние электролитов на электрокинетический потенциал
Строение мицеллы
Электрокинетические явления
Практическое использование электрокинетических явлений
Рекомендуемые материалы
Теории образования и строения ДЭС.
Существование двойного электрического слоя (ДЭС) ионов и скачка потенциала на границе раздела двух фаз играет важную, а иногда – основную роль во многих явлениях важных для теории и практики. К ним относятся: электродные процессы, электрокапиллярные и электрокинетические явления, явления связанные с электростатическим взаимодействием коллоидных частиц, в значительной степени определяющие устойчивость дисперсной системы. Все эти явления, взаимосвязанные посредством ДЭС, называются электроповерхностными.
Рассмотрим явление, имеющее место на границе раздела фаз – возникновение двойного электрического слоя, обусловливающего различные электроповерхностные явления.
Различают три возможных механизма образования ДЭС:
- в результате перехода ионов или электронов из одной фазы в другую (поверхностная ионизация);
- в результате избирательной адсорбции в межфазном слое ионов электролитов;
- в результате ориентирования полярных молекул сопряженных фаз при их взаимодействии.
По первому механизму, заряд на поверхности может образовываться в результате электролитической диссоциации молекул поверхности твердой фазы, в результате чего ионы одного знака остаются в фиксированном положении на этой поверхности, а противоионы (ионы противоположного знака) поступают в прилегающий раствор. По такому механизму ДЭС возникает в растворе целого ряда высокомолекулярных соединений.
По второму механизму, ионы одного знака необменно адсорбируются поверхностью, а ионы противоположного знака, в силу электростатического притяжения, располагаются около нее. Величина и знак заряда поверхности зависит от природы твердых частиц адсорбента и от природы жидкости, с которой он соприкасается.
Рассмотрим схемы строения ДЭС согласно различным теориям.
Впервые представление о ДЭС было высказано Квинке (1859) и развито в работах Гельмгольца (1879).
Теория ДЭС получила развитие в трудах ученых СССР А.Н. Фрумкина и Б.В. Дерягина.
Первой теорией строения ДЭС была теория Гельмгольца: ДЭС состоит из двух плоских зарядов, расположенных на молекулярном расстоянии один от другого и взаимодействующих между собой только за счет электростатических сил притяжения. Структура подобна плоскому конденсатору, падение потенциала между слоями происходит линейно.
Модель Гуи-Чепмена предполагала диффузионное расположение противоионов, находящихся под воздействием сил, действующих в противоположных направлениях: электростатических сил притяжения к поверхности и сил теплового движения ионов, приводящих к диффузии и размыванию внешнего слоя. Теория вводит понятие диффузионного слоя, ионы рассматриваются как точечные заряды, не имеющие собственных размеров.
По современным представлениям (теория Штерна) строение ДЭС представляется следующим образом: ионы входящие в состав твердой фазы, образуют внутреннюю обкладку двойного слоя; ионы противоположного знака, т.е. противоионы образуют внешнюю обкладку, при этом часть противоионов находится в непосредственном соприкосновении с ионами твердой фазы, образуя плотный слой (слой Гельмгольца, адсорбционный слой), другая часть противоионов составляет диффузный слой (слой Гуи).
Система в целом всегда является электронейтральной, то есть число зарядов внутренней обкладки должно быть равно числу зарядов противоионов (плотный слой + избыток в диффузном слое).
В пределах ДЭС действует электрическое поле, интенсивность которого характеризуется значением потенциала. Изменение потенциала в ДЭС в зависимости от расстояния показано на рис. 4.1.
При этом падение потенциала в пределах плотного слоя происходит линейно, а в диффузном слое – по экспоненте.
В настоящее время учение о ДЭС продолжает развиваться, т.к. оно имеет большое значение для понимания и усовершенствования таких практически важных процессов как коагуляция коллоидов, флотация, ионный обмен и др.
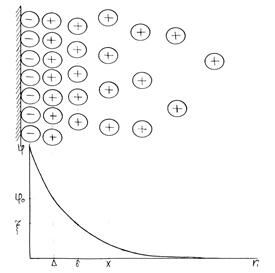
Рис. 4.1. Схема строения двойного электрического слоя и изменение потенциала.
Образование двойного слоя ионов приводит к появлению определенных электрических потенциалов на границе твердой и жидкой фаз.
На твердой поверхности возникает заряд, называемый φ-потенциал.
Знак φ-потенциала совпадает со знаком заряда потенцалобразующих ионов.
φ-потенциал можно рассчитать по уравнению Нернста:
 ,
,
где  - электрический потенциал на поверхности;
- электрический потенциал на поверхности;
 - универсальная газовая постоянная;
- универсальная газовая постоянная;
 - абсолютная температура;
- абсолютная температура;
 - заряд потенциалобразующих ионов;
- заряд потенциалобразующих ионов;
 - постоянная Фарадея (
- постоянная Фарадея ( )
)
 и
и  - активность ионов на поверхности и в растворе.
- активность ионов на поверхности и в растворе.
φ-потенциал равен работе переноса единичного (элементарного) заряда из бесконечно удаленной точки объема раствора на поверхность твердой фазы.
Электрокинетический потенциал.
Потенциал на поверхности - φ называется термодинамическим потенциалом и характеризует скачок потенциала на поверхности раздела между фазами.
Потенциал на поверхности раздела φ и потенциал так называемой плоскости максимального приближения (расположенной на расстоянии Δ порядка молекулярных размеров) φ0 принадлежат к разряду практически неизмеримых величин.
Для характеристики электрических свойств поверхности используют ζ-потенциал – потенциал границы скольжения фаз, определяемый экспериментально различными методами (метод потенциала протекания, электрофоретический метод и др.).
ζ-потенциал можно представить как работу, необходимую для переноса единичного заряда из бесконечно удаленного элемента объема раствора на поверхность скольжения.
ζ-потенциал по знаку совпадает с φ-потенциалом.
Из рис. 4.1 видно, что потенциал границы скольжения ниже чем потенциал на поверхности, тем не менее величина ζ-потенциала широко используется для характеристики свойств поверхности при рассмотрении адсорбции, адгезии, агрегативной устойчивости дисперсных систем и других важных процессов.
Влияние электролитов на электрокинетический потенциал
Как видно из рис. 4.1, значение электрокинетического потенциала зависит от числа нескомпенсированных на поверхности скольжения зарядов адсорбционного слоя, т.е. от числа ионов в диффузном слое.
Толщина двойного электрического слоя и значение электрокинетического потенциала зависят от концентрации электролита в растворе.
Изменение электрокинетического потенциала с изменением концентрации ионов разных валентностей показано на рис. 4.2.
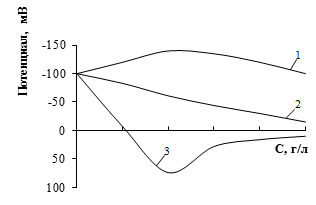
Рис. 4.2. Зависимость электрокинетического потенциала от концентрации электролита для одно (1), двух (2) и трех (3) зарядных противоионов.
Изменение толщины ДЭС при добавлении электролита к раствору объясняется тем, что при этом в растворе изменяются соотношения между влиянием электростатического притяжения и диффузии, определяющими распределение ионов в наружной обкладке двойного слоя.
Катионы оказывают тем более понижающее действие (при отрицательном знаке заряда поверхности), чем выше их валентность. Такое действие можно объяснить тем, что с увеличением заряда иона возрастает сила электростатического притяжения его к поверхности и ионы большей валентности могут ближе подойти к поверхности, вызывая тем самым более сильное сжатие диффузного слоя и, соответственно, понижение ζ-потенциала.
Многовалентные ионы могут не только уменьшить величину электрокинетического потенциала, но и изменить его знак, т.е. произвести перезарядку поверхности. Это объясняется их высокой специфической адсорбционной способностью: сильно электростатически притягиваясь к поверхности, многовалентные катионы нейтрализуют ее заряд, дальнейшая сверхэквивалентная адсорбция катионов поверхностью приводит к появлению избыточного положительного заряда на поверхности раздела, который вновь будет компенсироваться отрицательными противоионами, вследствии чего на поверхности возникнет новый двойной электрический слой с положительной внутренней обкладкой и отрицательным слоем противоионов.
Четырехвалентные металлы, например цирконий, обеспечивают уже в незначительном количестве резкое снижение электрокинетического потенциала, минимальное увеличение концентрации металла приводит к перезарядке поверхности и увеличению значений ζ-потенциала.
Строение мицеллы.
Согласно общепринятой мицеллярной теории строения коллоидных растворов, золь состоит из 2-х частей:
1. Мицелла – структурная коллоидная единица (частица дисперсной фазы), окруженная двойным электрическим слоем.
2. Интермицеллярная жидкость – дисперсионная среда, разделяющая мицеллы, в которой растворены электролиты, неэлектролиты и ПАВ.
Строение мицеллы может быть рассмотрено лишь в первом приближении, т.к. она не имеет определенного состава. В настоящее время нет возможности учесть влияния на строение мицеллы всех процессов, обусловленных сложными ионно-молекулярным взаимодействием на поверхности раздела двух фаз в растворе.
Рассмотрим, без учета влияния интермицеллярной жидкости, упрощенные схемы мицеллы иодида серебра, полученные по реакции:
| AgNO3+KJ®AgJ¯+KNO3 | |
| избыток AgNO3 | избыток KJ |
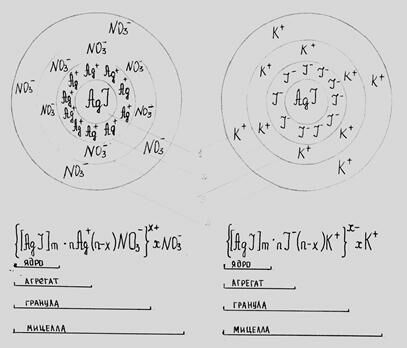
Элементарная коллоидная частица – мицелла (4) – имеет следующее строение:
- в центре находится ядро (1), представляющее собой микрокристалл или агрегат из микрокристаллов; поверхность ядра обладает запасом свободной энергии и избирательно адсорбирует ионы из окружающей среды.
Правило Панета-Фаянса: на поверхности твердого тела предпочтительно адсорбируются ионы, способные достраивать его кристаллическую решетку или образующие с ионами, входящими в состав кристаллической решетки наиболее труднорастворимые соединения. Определяется это избытком тех или иных ионов.
- ядро вместе с потенциалопределяющими ионами образуют агрегат (2);
- после возникновения заряда агрегат начинает притягивать из раствора ионы с противоположным знаком (противоионы) – образуется двойной электрический слой;
- при этом, некоторые ионы очень прочно притягиваются к агрегату, образуя адсорбционный (плотный) слой противоионов. Агрегат вместе с противоионами плотного слоя составляет гранулу или частицу (3). Частица характеризуется двойным электрическим слоем, состоящим из потенциалопределяющих ионов и противоионов плотного слоя, алгебраическая сумма которых определяет заряд системы;
- противоионы не входящие в плотный слой и находящиеся на более далеком расстоянии от ядра образуют диффузный слой противоионов. Все вместе составляет мицеллу (4), электрический заряд которой равен нулю.
Электрокинетические явления.
Это явления, связанные с движением дисперсной фазы и дисперсионной среды.
К электрокинетическим явлениям относятся явления электрофореза и электроосмоса, а также потенциал седиментации и потенциал течения.
Наличие у частиц дисперсных систем электрического заряда было открыто еще в 1808 году профессором Московского университета Ф.Ф. Рейссом при исследовании электролиза воды.
Рейсс поставил два эксперимента. В одном он использовал U-образную трубку, в другом погрузил в глину 2 стеклянные трубки.
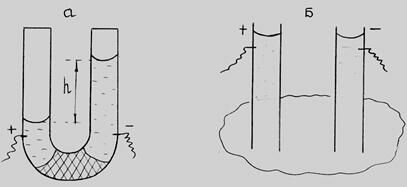
Рис. 4.3. Схемы опытов Рейсса.
При пропускании постоянного тока через прибор, состоящий из U-образной трубки, средняя часть которой заполнена кварцевым песком (рис. 4.3а), вода в колене с отрицательно заряженным электродом (катодом) поднималась, что свидетельствовало о положительном заряде воды. Вода заряжалась при контакте с частицами кварца. Без диафрагмы из песка движение жидкости отсутствовало.
Явление перемещения жидкости в пористых телах под действием электрического поля называется электроосмосом.
Явление электроосмоса используется в промышленности при опреснении воды, при электроосушении пористых тел (бетонов, болот и др.), при очистке лекарственных препаратов, при дублении кожи и т.д.
При создании разности потенциалов в трубках, погруженных в глину (рис. 4.3б), жидкость в трубке с положительным полюсом мутнеет – частицы глины переносятся в электрическом поле к положительному полюсу.
Позднее было установлено, что частицы движутся в электрическом поле с постоянной скоростью.
Скорость тем больше, чем выше разность потенциалов и диэлектрическая постоянная среды, и тем меньше, чем больше вязкость среды.
Перемещение частиц дисперсной фазы в электрическом поле называется электрофорезом (катафорезом).
Электрофорез используется для обезвоживания нефти и нефтепродуктов (ЭЛОУ – электроочистительные установки), при очистке газообразных отходов производства (электрофильтры), при изготовлении изделий из латекса (дисперсий полимера), в медицине – для введения в организм коллоидных лекарств и др.
Вам также может быть полезна лекция "5 Философия и наука. Специфика научного и философского мышления".
Последующими исследованиями были обнаружены два явления, как бы обратные электрофорезу и электроосмосу.
Дорн в 1878 году обнаружил, что при оседании каких-либо частиц в жидкости (песка в воде) возникает электродвижущая сила между двумя электродами, введенными в разные места столба жидкости – явление получило название эффект Дорна или потенциал седиментации (оседания).
Квинке в 1859 году обнаружил, что при течении жидкости через пористое тело под влиянием перепада давлений возникает разность потенциалов. Это явление, обратное электроосмосу, названо потенциалом протекания или потенциалом течения. Возникновение разности потенциалов Квинке наблюдал при течении воды и водных растворов через разные пористые материалы (глина, песок, дерево, графит).
Таким образом, по причинно-следственным признакам электрокинетические явления делят на две группы.
К первой относят явления, при которых относительное движение фаз вызывается электрической разностью потенциалов – электрофорез и электроосмос.
Ко второй группе явлений относят потенциал течения и потенциал седиментации в которых электрическая разность потенциалов обусловливается относительным движением фаз.























