Изучение взаимодействия белка Est3, компонента теломеразного комплекса дрожжей Saccharomyces сerevisiae с G-квадруплексами (1110896), страница 3
Текст из файла (страница 3)
Взаимодействие белка Est3 дикого и мутантного типа с РНК G-квадруплексами
Было также решено проверить взаимодействие белка Est3 дикого и мутантного типа с РНК G-квадруплексами. Оказалось, что белок дикого типа лучше взаимодействует с РНК G-квадруплексами, чем с ДНК квадруплексами. При этом, константы диссоциации комплексов Р4 квадруплекса с белком дикого типа и с мутантной формой отличаются примерно в 10 раз. Можно предположить, что нарушение взаимодействия с РНК квадруплексами вносит основной вклад в сенессенс фенотип дрожжей с мутантной формой белка Est3.
Р4 c Est3
Р4 c Est3D164a
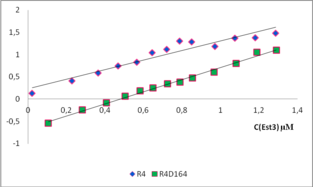
Взаимодействие Est3 одновременно с теломерной ДНК и РНК квадруплексами, позволяет предположить, что Est3 взаимодействует как с теломерами, так и с TERRA.
Материалы и методы
Методики, использованные в работе с лабораторным описанием
Выращивание культуры клеток с последующим выделением белка.
Для того, чтобы выделить необходимый белок была выращена культура клеток по приведенной методике:
Растили клетки при 37°C при постоянном качении до того момента, пока оптическая плотность при длине волны 600 нм не достигнет 0,5 оптических единиц (OD600=0,4-0,6). Добавили IPTG для начала индукции и последующей экспрессии белка. Через некоторое время клетки промыли буфером А и разрушили. Центрифугировали полученные лизаты при 15000 rpm 40 мин при 0°C. Отобрали супернатант и добавили его к Ni-sepharose. Связывание проводили в течении 1 часа. После, промывали смолу буфером с возрастающей концентрацией имидазола и в конце концов элюировали очищенный белок с поверхности сефарозы.
Разведение культуры клеток Est3 и D164A .
Эксперимент был проведен по следующей методике (все работы ведутся под ламинаром):
Пробирку с компетентными клетками 200 мкл размораживали во льду, добавляли 1–5 мкл раствора плазмидной ДНК (~ 0,1 мкг) в буферном растворе EB (Qiagen) или в дистиллированной воде или 2–6 мкл лигазной смеси, инкубировали 30 мин при 0°С. Затем прогревали смесь на водяной бане в течение 40–50 сек при 42°С, охлаждали до 0°С во льду, добавляли 400 мкл среды SOC и инкубировали 1 час при 37°С. Аликвоту 100–200 мкл (в случае плазмидной ДНК) или полный объем (в случае лигазной смеси) трансформационной смеси высевали на чашку Петри с твердой средой LB, содержавшей соответствующий антибиотик (LB агар с 50 мкг/мл канамицина либо амипицилина). Инкубировали чашку при 37°С в течение 16 ч.
Рецепты буферов А и Б (на 1 литр)
| Буфер А | Буфер Б | Примечания | ||
| Tris 1M | 50 mL | Tris 1M | 50 mL | На постоянное хранение |
| KCl | 38,25 g | KCl | 38,25 g | |
| TritonX-100 | 10 mL(EtOH) | Глицерин | 100 mL | |
| H2O mQ | 300 mL | H2O mQ | 300 mL | |
| DTE 0,5M | 2mL | DTE 0,5M | 2 mL | Добавлять перед использованием |
| PMSF 200 mM | 2,5mL | PMSF 200 mM | 5 mL | |
Метод анизотропии флуоресценции
Данный метод позволяет получить данные о форме, размере, скорости вращения молекул или комплексов. Анизотропия флуоресценции основана на том, что поляризованный свет возбуждает только те молекулы флуорофора, дипольные моменты перехода электронов которого параллельны вектору электрической составляющей поглощаемого света. Такое селективное возбуждение приводит к частично поляризованному испусканию флуоресценции. Угол между вектором момента перехода для поглощения и для испускания имеет фиксированную ориентацию и определяет максимальную анизотропию флуоресценции.
![]()
Также, при переходе электрона с более высокой орбитали на более низкую, происходит эмиссия света, который также поляризован. В общем случае измеряется интенсивность эмиссии испускаемого света, вектор электрической составляющей которого либо параллелен, либо перпендикулярен вектору электрической составляющей поглощаемого света. Таким образом вычисляется поляризация (P) и анизотропия (A) по формулам:
![]()
![]()
где ![]() - интенсивность эмиссии параллельно поляризованного света, а
- интенсивность эмиссии параллельно поляризованного света, а ![]() - перпендикулярно.
- перпендикулярно.
Некоторые факторы могут уменьшат анизотропию флуоресценции. Одним из наиболее важных является скорость вращения молекулы (которая, в частности, зависит от размера молекул), что позволяет использовать метод для изучения ДНК-белковых или белок-белковых взаимодействий. Скорость вращения молекулы связывают с таким эффектом, как вращательная диффузия, которая происходит за время жизни возбужденного состояния и смещает испускающий диполь флуорофора. Если этот фактор является единственным, то возможно вычисление анизотропии при помощи формулы:
![]()
где tK – это время корреляции для процесса диффузии, определяемая как произведение вязкости среды на объем вращающегося фрагмента, поделенное на константу Больцмана. Но данный фактор не используется в данной работе, а потому перейдем к другим факторам, влияющим на значение анизотропии флуоресценции.
Для наших исследований необходимо также было учитывать так называемый G-фактор, который фактически является поправкой для прибора и используемой буферной системы. Поэтому, изначально вычисляли данный фактор по формуле (для буферной системы и флуоресцеина):
![]()
где А – известная величина, взятая из справочных источников, ![]() и
и ![]() меряют на приборе. Исходя из этого уравнения, можно вычислить G-фактор.
меряют на приборе. Исходя из этого уравнения, можно вычислить G-фактор.
Далее проводили измерения для конкретных систем с белком и ДНК и вычисляли анизотропию по формуле:
![]()
где А – определяемая анизотропия флуоресценции, ![]() - интенсивность эмиссии параллельно поляризованного света, а
- интенсивность эмиссии параллельно поляризованного света, а ![]() - перпендикулярно, G – поправочный коэффициент.
- перпендикулярно, G – поправочный коэффициент.
После этого производили нормировку по концентрации ДНК в растворе и производили аппроксимацию уравнения
![]()
Где ![]() - анизотропия флуоресценции чистой ДНК,
- анизотропия флуоресценции чистой ДНК, ![]() - разница между максимальной анизотропией (фактически – для раствора, где существует только комплекс с белком) и
- разница между максимальной анизотропией (фактически – для раствора, где существует только комплекс с белком) и ![]() ,
, ![]() - нормированная концентрация белка, n – коэффициент Хилла,
- нормированная концентрация белка, n – коэффициент Хилла, ![]() - константа устойчивости комплекса.
- константа устойчивости комплекса.
Аппроксимация проводилась при помощи программы GraphPrism. Естественно, данный способ обработки данных дает наиболее точные результаты. Конечно, существует и другой метод оценки константы диссоциации и коэффициента Хилла, который позволяет определить все необходимые величины средствами программы Microsoft Excel, хотя данный метод дает менее точные результаты. В данной работе как раз таки решили отказаться от применения программ высокого уровня и воспользовались вполне доступной программой из вполне доступного на рынке пакета Microsoft Office.
Итак, суть метода заключается в том, что строится зависимость анизотропии флуоресценции от нормированной концентрации белка (по определенной концентрации белка).
![]()
Где ![]() - нормированная концентрация белка,
- нормированная концентрация белка, ![]() - концентрация ДНК, по которой проводят нормировку,
- концентрация ДНК, по которой проводят нормировку, ![]() - текущая концентрация белка,
- текущая концентрация белка, ![]() - текущая концентрация белка.
- текущая концентрация белка.
Далее проводят аппроксимацию полученной зависимости таким образом, чтобы при бесконечной нормированной концентрации белка насыщение стремилось к 1, а начальное значение было бы равно 0.
Затем проводят линеаризацию в соответствии с уравнением Хилла:
![]()
![]()
По полученным точкам проводят прямую, определяют тангенс угла наклона, который численно равен коэффициенту Хилла, и свободный член, который численно равен десятичному логарифму константы диссоциации.
Выводы
-
Est3 специфично взаимодействует с G-квадруплексами
-
Est3 взаимодействует с межмолекулярным, и не взаимодействует с мономолекулярным параллельным Д4 квадруплексом
-
Замена аминокислотного остатка Asp164 на Ala приводит к возникновению сенессенс-фенотипа
-
Нарушение взаимодействия белка Est3 с теломерными РНК- и ДНК- квадруплексами является вероятной причиной сенессенс-фенотипа.
Список литературы
1. Greider C.W., Blackburn E.H. (1987) Cell, 51, 887-98.
2. Mozdy A.D., Podell E.R., Cech T.R. (2008) Mol Cell Biol, 28, 4152-61.
3. Cristofari G., Lingner J. (2006) Embo J, 25, 565-74.
4. Shampay, J., Szostak, J.W., and Blackburn, E.H. (1984) DNA sequences of telomeres maintained in yeast. Nature 310: 154-157.
5. Wang, S.S., and Zakian, V.A. (1990) Sequencing of Saccharomyces telomeres cloned using T4 DNA polymerase reveals two domains. Mol. Cell Biol. 10: 4415-4419.
6. Chan, C.S., and Tye, B.K. (1983) A family of Saccharomyces cerevisiae repetitive autonomously replicating sequences that have very similar genomic environments. J.Mol. Biol. 168: 505-523.
7. Chan, C.S., and Tye, B.K. (1983) Organization of DNA sequences and replication origins at yeast telomeres. Сell 33: 563-573.
8.
9.
10. Porro, A., Feuerhahn, S., Reichenbach, P. and Lingner, J., submitted for publication TERRA biogenesis, turnover and implications for function (2010).
11. Azzalin, C.M., Reichenbach, P., Khoriauli, L., Giulotto, E. and Lingner, J. (2007) Telomeric repeat containing RNA and RNA surveillance factors at mammalian chromosome ends. Science 318, 798–801.

















