Формирование сети пунктов контроля качества поверхностных вод
31. Формирование сети пунктов контроля качества поверхностных вод
Первым этапом организации работ по наблюдению и контролю качества поверхностных вод является выбор местоположения пунктов контроля.
Пункты контроля организуют в первую очередь на водоемах и водотоках, имеющих большое хозяйственное значение, а также подверженных значительному загрязнению промышленными, хозяйственно-бытовыми и сельскохозяйственными сточными водами. На водоемах и водотоках или их участках, не загрязняемых сточными водами, создаются пункты для фоновых наблюдений.
Пункты контроля располагают с учетом существующего использования водоема или водотока для нужд хозяйства и перспективных планов развития хозяйства, на основании предварительных исследований, включающих в себя подбор и анализ сведений о водопользователях, источниках загрязнения вод, аварийных сбросах загрязняющих веществ, данные о режимных (водных, ледовых, термических), физико-географических признаках водоема или водотока и проведение обследований водоемов или водотоков или их участков.
Пункты контроля организуют на водоемах и водотоках в районах:
- расположения городов и крупных рабочих поселков, сточные воды которых сбрасываются в водоемы и водотоки;
- сброса сточных вод отдельно стоящими крупными промышленными предприятиями (заводами, рудниками, шахтами, нефтепромыслами, электростанциями и т.п.), территориально-производственными комплексами, организованного сброса сельскохозяйственных сточных вод;
- мест нереста и зимовья ценных и особо ценных видов промыс-| ловых организмов;
Рекомендуемые материалы
= пересечения реками государственной границы РФ и границ союзных республик СНГ;
=замыкающих створов больших и средних рек;
устьев загрязненных притоков больших водоемов и водотоков.
32 На водоемах с интенсивным водообменом (свыше 5,0) расположение створов аналогично расположению их на водотоках: один створ устанавливают примерно на 1 км выше источника загрязнения (вне влияния сточных вод), остальные створы — ниже источника загрязнения (не менее двух, на расстоянии 0,5 км от сброса сточных вод и непосредственно за границей зоны загрязненности). Границу зоны загрязненности (части водоема, в которой нарушены нормы качества воды по одному или нескольким показателям) устанавливают по размерам максимальной зоны загрязненности, определенной расчетным путем и уточненной при проведении обследования водоема.
На водоемах с умеренным (0,1...0,5) и замедленным (до 0,1) водообменами один створ устанавливают в части водоема, не подверженной загрязнению, другой — совмещают со створом сброса сточных вод, остальные створы располагают параллельно ему по обе стороны (не менее двух, на расстоянии 0,5 км от места сброса сточных вод и непосредственно за границей зоны загрязненности).
Количество горизонтов на вертикали определяется глубиной водоема или водотока в месте измерения: при глубине до 5 м устанавливается один горизонт (у поверхности льда зимой), при глубине от 5 до 10 м — два (у поверхности и в 0,5 м от дна), а при глубине более 10 м — три (дополнительно промежуточный, расположенный на половине глубины).
На глубоких водоемах горизонты устанавливаются у поверхности, на глубине 10; 20; 50 и 100 м и у дна (в разноплотностном водоеме назначается дополнительный горизонт, который располагается в слое скачка плотности).
33 Программы наблюдений за качеством воды
Все пункты наблюдений за качеством воды водоемов и водотоков делят на 4 категории, определяемые частотой и детальностью программ наблюдений. Назначение и расположение пунктов контроля определяются правилами наблюдений за качеством воды водоемов и водотоков.
Пункты первой категории располагают на средних и больших водоемах и водотоках, имеющих важное народнохозяйственное значение:
· в районах городов с населением свыше 1 млн. жителей;
- в местах нереста и зимовья особо ценных видов промысловых рыб;
- в районах повторяющихся аварийных сбросов загрязняющих веществ;
- в районах организованного сброса сточных вод, в результате которых наблюдается высокая загрязненность воды.
Пункты второй категории устраивают на водоемах и водотоках в пределах следующих участков:
- в районах городов с населением от 0,5 до 1 млн. жителей;
- в местах нереста и зимовья ценных видов промысловых рыб (организмов);
- на важных для рыбного хозяйства предплотинных участках рек;
- в местах организованного сброса дренажных сточных вод с орошаемых территорий и промышленных сточных вод;
- при пересечении реками Государственной границы;
- в районах со средней загрязненностью воды.
Пункты третьей категории располагают на водоемах и водотоках:
- в районах городов с населением менее 0,5 млн. жителей;
- на замыкающих участках больших и средних рек;
- в устьях загрязненных притоков больших рек и водоемов;
- в районах организованного сброса сточных вод, в результате чего наблюдается низкая загрязненность воды.
Пункты четвертой категории устанавливают:
- на незагрязненных участках водоемов и водотоков,
- на водоемах и водотоках, расположенных на территориях государственных заповедников и национальных парков.
34 Наблюдения за качеством воды ведут по определенным видам программ, которые выбирают в зависимости от категории пункта контроля. Периодичность проведения контроля по гидробиологическим и гидрохимическим показателям устанавливают в соответствии с категорией пункта наблюдений. При выборе программы контроля учитывают целевое использование водоема или водотока, состав сбрасываемых сточных вод, требования потребителей информации.
Параметры, определение которых предусмотрено обязательной программой наблюдений за качеством поверхностных вод по гидрохимическим и гидрологическим показателям, приведены в табл. Таблица
Параметры, определение которых предусмотрено обязательной программой наблюдений
| Параметры | Единицы измерения |
| 1 | 2 |
| Расход воды (на водотоках) | м3/с |
| Скорость течения воды (на водотоках) | м/с |
| Уровень воды (на водоемах) | М |
| Визуальные наблюдения | – |
| Температура | С |
| Цветность | градусы |
| Прозрачность | См |
| Запах | Баллы |
| Кислород | мг/дм3 |
| Диоксид углерода | мг/дм3 |
| Взвешенные вещества | мг/дм3 |
| Водородный показатель (рH) | – |
| Окислительно-восстановительный потенциал (Еh) | мВ |
| Хлориды (Cl-) | мг/дм3 |
| Сульфаты (SO42-) | мг/дм3 |
| Гидрокарбонаты (HCO3-) | мг/дм3 |
| Кальций (Ca2+) | мг/дм3 |
| Магний (Mg2+) | мг/дм3 |
| Натрий (Na+) | мг/дм3 |
| Калий (К+) | мг/дм3 |
| Сумма ионов (и) | мг/дм3 |
| Аммонийный азот (NH4+) | мг/дм3 |
| Нитритный азот (NO2-) | мг/дм3 |
| Нитратный азот (NO3-) | мг/дм3 |
| Минеральный фосфор (PO43-) | мг/дм3 |
| Железо общее | мг/дм3 |
| Кремний | мг/дм3 |
| БПК5 | мг О2/дм3 |
| ХПК | мг О/дм3 |
| Нефтепродукты | мг/дм3 |
| СПАВ | мг/дм3 |
| Фенолы (летучие) | мг/дм3 |
| Пестициды | мг/дм3 |
| Тяжелые металлы | мг/дм3 |
Наблюдения по обязательной программе на водотоках осуществляют, как правило, 7 раз в год в основные фазы водного режима: во время половодья – на подъеме, пике и спаде; во время летней межени – при наименьшем расходе и при прохождении дождевого паводка; осенью – перед ледоставом; во время зимней межени.
В водоемах качество воды исследуют при следующих гидрологических ситуациях: зимой при наиболее низком уровне и наибольшей толщине льда; в начале весеннего наполнения водоема; в период максимального наполнения; в летне-осенний период при наиболее низком уровне воды.
Сокращенную программу наблюдений за качеством поверхностных вод по гидрологическим и гидрохимическим показателям подразделяют на три вида:
- Первая программа предусматривает определение расхода воды (на водотоках), уровня воды (на водоемах), температуры, концентрации растворенного кислорода, удельной электропроводности, визуальные наблюдения.
- Вторая программа предусматривает определение расхода воды (на водотоках), уровня воды (на водоемах), температуры, рН, удельной электропроводности, концентрации взвешенных веществ, ХПК, БПК5, концентрации 2–3 загрязняющих веществ, основных для воды в данном пункте контроля, визуальные наблюдения.
- Третья программа предусматривает определение расхода воды, скорости течения (на водотоках), уровня воды (на водоемах), температуры, рН, концентрации взвешенных веществ, концентрации растворенного кислорода, БПК5, концентрации всех загрязняющих воду в данном пункте контроля веществ, визуальные наблюдения.
Гидрохимические показатели качества природных вод в пунктах контроля сопоставляют с установленными нормами качества воды.
Программы и периодичность наблюдений по гидрохимическим показателям для пунктов различных категорий приведены в табл.
Таблица.
Программы и периодичность наблюдений для пунктов различных категорий
| Периодичность проведения контроля | Категория пунктов наблюдений | |||
| I | II | III | IV | |
| Ежедневно | Сокращенная программа 1 | Визуальные наблюдения | – | – |
| Ежедекадно | Сокращенная программа 2 | Сокращенная программа 1 | – | – |
| Ежемесячно | Сокращенная программа 3 | – | ||
| В основные фазы водного режима | Обязательная программа |
Внедрение в систему наблюдений за качеством воды гидробиологических методов позволяет непосредственно выяснить состав и структуру сообществ гидробионтов.
Полная программа наблюдений за качеством поверхностных вод по гидробиологическим показателям предусматривает:
- исследование фитопланктона – общей численности клеток, числа видов, общей биомассы, численности основных групп, биомассы основных групп, числа видов в группе, массовых видов и видов-индикаторов сапробности;
- исследование зоопланктона – общей численности организмов, общего числа видов, общей биомассы, численности основных групп, биомассы основных групп, числа видов в группе, массовых видов и видов-индикаторов сапробности;
- исследование зообентоса – общей численности, общей биомассы, общего числа видов, числа групп по стандартной разработке, числа видов в группе, числа основных групп, биомассы основных групп, массовых видов и видов-индикаторов сапробности;
- исследование перифитона – общего числа видов, массовых видов, частоты встречаемости, сапробности;
- определение микробиологических показателей – общего числа бактерий, числа сапрофитных бактерий, отношения общего числа бактерий к числу сапрофитных бактерий;
- изучение фотосинтеза фитопланктона и деструкции органического вещества, определение отношения интенсивности фотосинтеза к деструкции органического вещества, содержания хлорофилла;
- исследование макрофитов – проективного покрытия опытной площадки, характера распространения растительности, общего числа видов, преобладающих видов (наименования, проективного покрытия, фенофазы, аномальных признаков).
Сокращенная программа наблюдений за качеством поверхностных вод по гидробиологическим показателям предусматривает исследование:
- фитопланктона – общей численности клеток, общего числа видов, массовых видов и видов-индикаторов сапробности;
- зоопланктона – общей численности организмов, общего числа видов, массовых видов и видов-индикаторов сапробности;
- зообентоса – общей численности групп по стандартной разработке, числа видов в группе, числа основных групп, массовых видов и видов-индикаторов сапробности;
- перифитона – общего числа видов, массовых видов, сапробности, частоты встречаемости.
Программы и периодичность наблюдений по гидробиологическим показателям для станций различных категорий приведены в табл.
Таблица
Периодичность проведения наблюдений по гидробиологическим показателям и виды программ
| Периодичность проведения наблюдений | Категория пункта наблюдений | |||
| I | II | III | IV | |
| Ежемесячно | Сокращенная программа | Сокращенная программа | Сокращенная программа (контроль в вегетационный период) | – |
| Ежеквартально | Полная программа |
38 ОТБОР ПРОБ ВОДЫ
Процедура отбора проб воды регламентируется требованиями ГОСТ Р 51592-2000 «Вода. Общие требования к отбору проб», ГОСТ Р 51593-2000 «Вода питьевая. Отбор проб» и др. Чаще всего на водоеме отбирают так называемые разовые пробы. Однако при обследовании водоема может возникнуть необходимость отбора серий проб — из поверхностного, глубинного, придонного слоев вод и т. д. Пробы могут быть отобраны также из подземных источников, водопровода и т. п. Усредненные данные о составе вод дают смешанные пробы.
Проба воды должна быть представительной (репрезентативной), т. е. в максимальной степени характеризовать качество воды по данному показателю, типичной и неискаженной вследствие концентрирования и других факторов. Различные виды водоемов (водоисточников) обусловливают некоторые особенности отбора проб в каждом случае.
При отборе проб воды можно решить две задачи: получить характеристику водоема (водотока); получить характеристику источника загрязнения и оценить его влияние на окружающую среду.
Если решается первая задача, то не рекомендуется отбирать пробы:
- в местах, подверженных влиянию притоков (для водотоков) и в устьевых районах (для водоемов);
- вблизи мест с активной антропогенной деятельностью (вблизи населенных пунктов, предприятий, пристаней);
- в местах слабого водообмена, заливах, заводях, зарослях макрофитов, в затонах, на мелководье.
Если решается вторая задача, то, напротив, следует стремиться к отбору проб вблизи источника загрязнения или в нем самом.
Пробы из рек и водных потоков отбирают для определения качества воды в бассейне реки, пригодности воды для пищевого использования, орошения, для водопоя скота, рыборазведения, купания и водного спорта, установления источников загрязнения.
Различают две основные пробы: разовую и среднюю. Разовую пробу получают путем отбора требуемого объема воды за один раз. Средняя проба получается смешением равных объемов проб, отобранных через равные промежутки времени. Средняя проба тем точнее, чем меньше интервала между отдельно взятыми составляющими ее пробами.
Воду на анализ отбирают в чистую посуду, предварительно 2-3 раза ополоснув ее исследуемой водой. С открытых водоемов пробы отбирают с фарватере реки с глубины 50 см. Бутыль с грузом опускают на глубину, после чего пробку открывают с помощью прикрепленного к ней держателя. Лучше для этой цели использовать специальные приборы- батометры, которые позволяют применять посуду разной формы и емкости. Батометр состоит из зажима, плотно обхватывающего посуду, и приспособления для открывания пробки на нужной глубине.
Хранение проб воды, в том числе содержащих следовые количества исследуемых веществ, осложнено потерями ее из-за сорбции на стенках сосудов и разрушения в растворителях и на поверхностях носителей под действием кислорода, света и других факторов внешней среды.
В воде протекают процессы окисления-восстановления, биохимические процессы с участием бактерий и других живущих в ней объектов, а также физические и физико-химические процессы сорбции, седиментации и др. В водных растворах, например,
|
|
Рис. 1. батометр
нитраты в присутствии органики могут восстанавливаться до нитритов или даже до ионов аммония (в отсутствие органики эти процессы могут идти в обратную сторону из-за наличия в воде растворенного кислорода), а сульфаты — до сульфитов. Растворенный кислород может расходоваться на окисление органических веществ. Могут изменяться и органолептические свойства воды — запах, цвет, мутность, вкус.
Некоторые элементы и их соединения способны довольно легко адсорбироваться на стенках сосудов (Fe, А1, Си, Cd, Mn, Cr, Zn, PC>4~ и др.). Из стекла (особенно темного) или пластмассы бутылей, напротив, ряд микроэлементов и следы веществ могут выщелачиваться (В, Si, Na, К). Указанные процессы иногда довольно значительно сказываются на достоверности и точности анализа, поэтому очень важно соблюдать предписанные технологические процедуры хранения и стабилизации проб.
Для обычных, наиболее часто загрязняющих воду веществ применяют довольно простые и проверенные способы консервации и хранения проб. Однако при добавлении к водным пробам стабилизаторов всегда необходимо всесторонне учитывать те осложнения, которые могут возникнуть при анализе из-за их применения.
Универсального консервирующего средства не существует, поэтому пробы для анализа отбирают в несколько бутылей. В каждый из них на месте отбора пробу консервируют, добавляя различные реагенты.
Подготовка воды непосредственно перед анализом заключается в следующем:
- конскрвированные пробы при необходимости нейтрализуют, а охлажденные нагревают до комнатной температуры;
- если определению мешают мутность и цветность, то проводят специальную подготовку: пробы фильтруют отстаивают или коагулируют.
Коагуляцию проводят добавлением 5 см3 суспензии гидроксида алюминия на 1 дм3 воды, после чего смесь хорошо взбалтывают и дают отстояться.
35 Выделяют 3 группы показателей, определяющих качество воды:
- показатели, характеризующие органолептические свойства;
- показатели характеризующие химический состав воды;
- показатели, характеризующие эпидемическую безопасность.
Минерализация
Суммарное содержание всех найденных при химическом анализе воды минеральных веществ; обычно выражается в мг/дм3 (до 1000 мг/дм3) и ‰ (промилле или тысячная доля при минерализации более 1000 мг/дм3).
Многие производства, сельское хозяйство, предприятия питьевого водоснабжения предъявляют определенные требования к качеству вод, в частности, к минерализации, так как воды, содержащие большое количество солей, отрицательно влияют на растительные и животные организмы, технологию производства и качество продукции, вызывают образование накипи на стенках котлов, коррозию, засоление почв.
Классификация природных вод по минерализации
| Категория вод | Минерализация, г/дм3 |
| Ультрапресные | <0,2 |
| Пресные | 0,2–0,5 |
| Воды с относительно повышенной минерализацией | 0,5–1,0 |
| Солоноватые | 1,0–3,0 |
| Соленые | 3–10 |
| Воды повышенной солености | 10–35 |
| Рассолы | >35 |
|
Температура
Температура воды в водоеме является результатом нескольких одновременно протекающих процессов, таких как солнечная радиация, испарение, теплообмен с атмосферой, перенос тепла течениями, турбулентным перемешиванием вод и др. Обычно прогревание воды происходит сверху вниз. Годовые и суточные изменения температуры воды на поверхности и глубинах определяется количеством тепла, поступающего на поверхность, а также интенсивностью и глубиной перемешивания. Суточные колебания температуры могут составлять несколько градусов и обычно наблюдаются на небольшой глубине. На мелководье амплитуда колебаний температуры воды близка к перепаду температуры воздуха.
| В требованиях к качеству воды водоемов, используемых для купания, спорта и отдыха, указано, что летняя температура воды в результате спуска сточных вод не должна повышаться более, чем на 3°С по сравнению со среднемесячной температурой самого жаркого месяца за последние 10 лет. В водоемах рыбохозяйственного назначения допускается повышение температуры воды в результате спуска сточных вод не более, чем на 5°С по сравнению с естественной температурой. |
Температура воды – важнейший фактор, влияющий на протекающие в водоеме физические, химические, биохимические и биологические процессы, от которого в значительной мере зависят кислородный режим и интенсивность процессов самоочищения. Значения температуры используют для вычисления степени насыщения воды кислородом, различных форм щелочности, состояния карбонатно-кальциевой системы, при многих гидрохимических, гидробиологических, особенно лимнологических исследованиях, при изучении тепловых загрязнений.
Взвешенные вещества (грубодисперсные примеси)
Взвешенные твердые вещества, присутствующие в природных водах, состоят из частиц глины, песка, ила, суспендированных органических и неорганических веществ, планктона и различных микроорганизмов. Концентрация взвешенных частиц связана с сезонными факторами и режимом стока, зависит от пород, слагающих русло, а также от антропогенных факторов, таких как сельское хозяйство, горные разработки и т.п.
Взвешенные частицы влияют на прозрачность воды и на проникновение в нее света, на температуру, состав растворенных компонентов поверхностных вод, адсорбцию токсичных веществ, а также на состав и распределение отложений и на скорость осадкообразования. Вода, в которой много взвешенных частиц, не подходит для рекреационного использования по эстетическим соображениям.
| В соответствии с требованиями к составу и свойствам воды водных объектов у пунктов хозяйственно-питьевого и культурно-бытового назначения содержание взвешенных веществ в результате спуска сточных вод не должно увеличиваться соответственно более, чем на 0,25 мг/дм3 и 0,75 мг/дм3. Для водоемов, содержащих в межень более 30 мг/дм3 природных минеральных веществ, допускается увеличение концентрации взвешенных веществ в пределах 5%. |
Определение количества взвешенных частиц важно проводить при контроле процессов биологической и физико-химической обработки сточных вод и при оценке состояния природных водоемов.
Грубодисперсные примеси определяют гравиметрическим методом после их отделения путем фильтрования через фильтр "синяя лента" (преимущественно для проб с прозрачностью менее 10 см).
Запах
Свойство воды вызывать у человека и животных специфическое раздражение слизистой оболочки носовых ходов. Запах воды характеризуется интенсивностью, которую измеряют в баллах. Запах воды вызывают летучие пахнущие вещества, поступающие в воду в результате процессов жизнедеятельности водных организмов, при биохимическом разложении органических веществ, при химическом взаимодействии содержащихся в воде компонентов, а также с промышленными, сельскохозяйственными и хозяйственно-бытовыми сточными водами.
На запах воды оказывают влияние состав содержащихся в ней веществ, температура, значения рН, степень загрязненности водного объекта, биологическая обстановка, гидрологические условия и т.д.
Мутность
Мутность природных вод вызвана присутствием тонкодисперсных примесей, обусловленных нерастворимыми или коллоидными неорганическими и органическими веществами различного происхождения. Качественное определение проводят описательно: слабая опалесценция, опалесценция, слабая, заметная и сильная муть.
В соответствии с гигиеническими требованиями к качеству питьевой воды мутность не должна превышать 1,5 мг/дм3 по каолину.
Цветность
Показатель качества воды, характеризующий интенсивность окраски воды и обусловленный содержанием окрашенных соединений; выражается в градусах платиново-кобальтовой шкалы. Определяется путем сравнения окраски испытуемой воды с эталонами.
Цветность природных вод обусловлена главным образом присутствием гумусовых веществ и соединений трехвалентного железа. Количество этих веществ зависит от геологических условий, водоносных горизонтов, характера почв, наличия болот и торфяников в бассейне реки и т.п. Сточные воды некоторых предприятий также могут создавать довольно интенсивную окраску воды.
| Предельно допустимая величина цветности в водах, используемых для питьевых целей, составляет 35 градусов по платиново-кобальтовой шкале. В соответствии с требованиями к качеству воды в зонах рекреации окраска воды не должна обнаруживаться визуально в столбике высотой 10 см. |
Высокая цветность воды ухудшает ее органолептические свойства и оказывает отрицательное влияние на развитие водных растительных и животных организмов в результате резкого снижения концентрации растворенного кислорода в воде, который расходуется на окисление соединений железа и гумусовых веществ.
Прозрачность
Прозрачность (или светопропускание) природных вод обусловлена их цветом и мутностью, т.е. содержанием в них различных окрашенных и взвешенных органических и минеральных веществ.
Воду в зависимости от степени прозрачности условно подразделяют на прозрачную, слабоопалесцирующую, опалесцирующую, слегка мутную, мутную, сильно мутную. Мерой прозрачности служит высота столба воды, при которой можно наблюдать опускаемую в водоем белую пластину определенных размеров (диск Секки) или различать на белой бумаге шрифт определенного размера и типа (как правило, шрифт средней жирности высотой 3,5 мм). Результаты выражаются в сантиметрах с указанием способа измерения.
Ослабление интенсивности света с глубиной в мутной воде приводит к большему поглощению солнечной энергии вблизи поверхности. Появление более теплой воды у поверхности уменьшает перенос кислорода из воздуха в воду, снижает плотность воды, стабилизирует стратификацию. Уменьшение потока света также снижает эффективность фотосинтеза и биологическую продуктивность водоема.
Определение прозрачности воды – обязательный компонент программ наблюдений за состоянием водных объектов. Увеличение количества грубодисперсных примесей и мутности характерно для загрязненных и эвтрофных водоемов.
Водородный показатель (рН)
Содержание ионов водорода (гидроксония – H3O+) в природных водах определяется в основном количественным соотношением концентраций угольной кислоты и ее ионов:
Величина pH воды – один из важнейших показателей качества вод. Величина концентрации ионов водорода имеет большое значение для химических и биологических процессов, происходящих в природных водах. От величины pH зависит развитие и жизнедеятельность водных растений, устойчивость различных форм миграции элементов, агрессивное действие воды на металлы и бетон. Величина pH воды также влияет на процессы превращения различных форм биогенных элементов, изменяет токсичность загрязняющих веществ.
В водоеме можно выделить несколько этапов процесса его закисления. На первом этапе рН практически не меняется (ионы бикарбоната успевают полностью нейтрализовать ионы Н+). Так продолжается до тех пор, пока общая щелочность в водоеме не упадет примерно в 10 раз до величины менее 0,1 моль/дм3.
На втором этапе закисления водоема рН воды обычно не поднимается выше 5,5 в течение всего года. О таких водоемах говорят как об умеренно кислых. На этом этапе закисления происходят значительные изменения в видовом составе живых организмов.
На третьем этапе закисления водоема рН стабилизируется на значениях рН<5 (обычно рН 4,5), даже если атмосферные осадки имеют более высокие значения рН. Это связано с присутствием гумусовых веществ и соединений алюминия в водоеме и почвенном слое.
| Значение pH в речных водах обычно варьирует в пределах 6,5–8,5, в атмосферных осадках 4,6–6,1, в болотах 5,5–6,0, в морских водах 7,9–8,3. Концентрация ионов водорода подвержена сезонным колебаниям. Зимой величина pH для большинства речных вод составляет 6,8–7,4, летом 7,4–8,2. Величина pH природных вод определяется в некоторой степени геологией водосборного бассейна. |
| В соответствии с требованиями к составу и свойствам воды водоемов у пунктов питьевого водопользования, воды водных объектов в зонах рекреации, а также воды водоемов рыбохозяйственного назначения, величина pH не должна выходить за пределы интервала значений 6,5–8,5. |
Природные воды в зависимости от рН рационально делить на семь групп
Группы природных вод в зависимости от рН
| Группа | рН | Примечание |
| Сильнокислые воды | <3 | результат гидролиза солей тяжелых металлов (шахтные и рудничные воды) |
| Кислые воды | 3–5 | поступление в воду угольной кислоты, фульвокислот и других органических кислот в результате разложения органических веществ |
| Слабокислые воды | 5–6,5 | присутствие гумусовых кислот в почве и болотных водах (воды лесной зоны) |
| Нейтральные воды | 6,5–7,5 | наличие в водах Ca(HCO3)2, Mg(HCO3)2 |
| Слабощелочные воды | 7,5–8,5 | наличие в водах Ca(HCO3)2, Mg(HCO3)2 |
| Щелочные воды | 8,5–9,5 | присутствие Na2CO3 или NaHCO3 |
| Сильнощелочные воды | 9,5 | присутствие Na2CO3 или NaHCO3 |
Кислотность
Кислотность природных и сточных вод определяется их способностью связывать гидроксид-ионы. Расход гидроксида отражает общую кислотность воды. В обычных природных водах кислотность в большинстве случаев зависит только от содержания свободного диоксида углерода. Естественную часть кислотности создают также гуминовые и другие слабые органические кислоты и катионы слабых оснований (ионы аммония, железа, алюминия, органических оснований). В этих случаях pH воды не бывает ниже 4,5
В загрязненных водоемах может содержаться большое количество сильных кислот или их солей за счет сброса промышленных сточных вод. В этих случаях pH может быть ниже 4,5. Часть общей кислотности, снижающей pH до величин <4,5, называется свободной.
Растворенный кислород
Растворенный кислород находится в природной воде в виде молекул O2. На его содержание в воде влияют две группы противоположно направленных процессов: одни увеличивают концентрацию кислорода, другие уменьшают ее. К первой группе процессов, обогащающих воду кислородом, следует отнести:
- процесс абсорбции кислорода из атмосферы;
- выделение кислорода водной растительностью в процессе фотосинтеза;
- поступление в водоемы с дождевыми и снеговыми водами, которые обычно пересыщены кислородом.
Абсорбция кислорода из атмосферы происходит на поверхности водного объекта. Скорость этого процесса повышается с понижением температуры, с повышением давления и понижением минерализации. Аэрация – обогащение глубинных слоев воды кислородом – происходит в результате перемешивания водных масс, в том числе ветрового, вертикальной температурной циркуляции и т.д.
Фотосинтетическое выделение кислорода происходит при ассимиляции диоксида углерода водной растительностью (прикрепленными, плавающими растениями и фитопланктоном). Процесс фотосинтеза протекает тем сильнее, чем выше температура воды, интенсивность солнечного освещения и больше биогенных (питательных) веществ (P, N и др.) в воде. Продуцирование кислорода происходит в поверхностном слое водоема, глубина которого зависит от прозрачности воды (для каждого водоема и сезона может быть различной, от нескольких сантиметров до нескольких десятков метров).
К группе процессов, уменьшающих содержание кислорода в воде, относятся реакции потребления его на окисление органических веществ: биологическое (дыхание организмов), биохимическое (дыхание бактерий, расход кислорода при разложении органических веществ) и химическое (окисление Fe2+, Mn2+, NO2-, NH4+, CH4, H2S). Скорость потребления кислорода увеличивается с повышением температуры, количества бактерий и других водных организмов и веществ, подвергающихся химическому и биохимическому окислению. Кроме того, уменьшение содержания кислорода в воде может происходить вследствие выделения его в атмосферу из поверхностных слоев и только в том случае, если вода при данных температуре и давлении окажется пересыщенной кислородом.
| В поверхностных водах содержание растворенного кислорода варьирует в широких пределах – от 0 до 14 мг/дм3 – и подвержено сезонным и суточным колебаниям. Суточные колебания зависят от интенсивности процессов его продуцирования и потребления и могут достигать 2,5 мг/дм3 растворенного кислорода. В зимний и летний периоды распределение кислорода носит характер стратификации. Дефицит кислорода чаще наблюдается в водных объектах с высокими концентрациями загрязняющих органических веществ и в эвтрофированных водоемах, содержащих большое количество биогенных и гумусовых веществ. |
Концентрация кислорода определяет величину окислительно-восстановительного потенциала и в значительной мере направление и скорость процессов химического и биохимического окисления органических и неорганических соединений. Кислородный режим оказывает глубокое влияние на жизнь водоема. Минимальное содержание растворенного кислорода, обеспечивающее нормальное развитие рыб, составляет около 5 мг/дм3. Понижение его до 2 мг/дм3 вызывает массовую гибель (замор) рыбы. Неблагоприятно сказывается на состоянии водного населения и пересыщение воды кислородом в результате процессов фотосинтеза при недостаточно интенсивном перемешивании слоев воды.
| В соответствии с требованиями к составу и свойствам воды водоемов у пунктов питьевого и санитарного водопользования содержание растворенного кислорода в пробе, отобранной до 12 часов дня, не должно быть ниже 4 мг/дм3 в любой период года; для водоемов рыбохозяйственного назначения концентрация растворенного в воде кислорода не должна быть ниже 4 мг/дм3 в зимний период (при ледоставе) и 6 мг/дм3 – в летний. |
Определение кислорода в поверхностных водах включено в программы наблюдений с целью оценки условий обитания гидробионтов, в том числе рыб, а также как косвенная характеристика оценки качества поверхностных вод и регулирования процесса очистки стоков. Содержание растворенного кислорода существенно для аэробного дыхания и является индикатором биологической активности (т.е. фотосинтеза) в водоеме.
Содержание кислорода в водоемах с различной степенью загрязненности
| Уровень загрязненности воды и класс качества | Растворенный кислород | ||
| лето, мг/дм3 | зима, мг/дм3 | % насыщения | |
| Очень чистые, I | 9 | 14–13 | 95 |
| Чистые, II | 8 | 12–11 | 80 |
| Умеренно загрязненные, III | 7–6 | 10–9 | 70 |
| Загрязненные, IV | 5–4 | 5–4 | 60 |
| Грязные, V | 3–2 | 5–1 | 30 |
| Очень грязные, VI | 0 | 0 | 0 |
Относительное содержание кислорода в воде, выраженное в процентах его нормального содержания, называется степенью насыщения кислородом. Эта величина зависит от температуры воды, атмосферного давления и солености. Вычисляется по формуле:
 ,где
,где
M – степень насыщения воды кислородом, %;
а – концентрация кислорода, мг/дм3;
Р – атмосферное давление в данной местности, Па;
N – нормальная концентрация кислорода при данной температуре, минерализации (солености) и общем давлении 101308 Па.
Окисляемость перманганатная и бихроматная (ХПК)
Величина, характеризующая содержание в воде органических и минеральных веществ, окисляемых одним из сильных химических окислителей при определенных условиях, называется окисляемостью. Существует несколько видов окисляемости воды: перманганатная, бихроматная, иодатная, цериевая. Наиболее высокая степень окисления достигается методами бихроматной и иодатной окисляемости воды.
Окисляемость выражается в миллиграммах кислорода, пошедшего на окисление органических веществ, содержащихся в 1 дм3 воды.
Состав органических веществ в природных водах формируется под влиянием многих факторов. К числу важнейших относятся внутриводоемные биохимические процессы продуцирования и трансформации, поступления из других водных объектов, с поверхностными и подземными стоками, с атмосферными осадками, с промышленными и хозяйственно-бытовыми сточными водами. Образующиеся в водоеме и поступающие в него извне органические вещества весьма разнообразны по своей природе и химическим свойствам, в том числе по устойчивости к действию разных окислителей. Соотношение содержащихся в воде легко- и трудноокисляемых веществ в значительной мере влияет на окисляемость воды в условиях того или иного метода ее определения.
В поверхностных водах органические вещества находятся в растворенном, взвешенном и коллоидном состояниях. Последние в рутинном анализе отдельно не учитываются, поэтому различают окисляемость фильтрованных (растворенное органическое вещество) и нефильтрованных (общее содержание органических веществ) проб.
| Величины окисляемости природных вод изменяются в пределах от долей миллиграммов до десятков миллиграммов в литре в зависимости от общей биологической продуктивности водоемов, степени загрязненности органическими веществами и соединениями биогенных элементов, а также от влияния органических веществ естественного происхождения, поступающих из болот, торфяников и т.п. Поверхностные воды имеют более высокую окисляемость по сравнению с подземными (десятые и сотые доли миллиграмма на 1 дм3), исключение составляют воды нефтяных месторождений и грунтовые воды, питающиеся за счет болот. Горные реки и озера характеризуются окисляемостью 2–3 мг О/дм3, реки равнинные – 5–12 мг О/дм3, реки с болотным питанием – десятки миллиграммов на 1 дм3. |
Окисляемость незагрязненных поверхностных вод проявляет довольно отчетливую физико-географическую зональность (табл. 3.5).
Таблица 3.5. Физико-географическая зональность природных вод
| Окисляемость | мг О/дм3 | Зона |
| Очень малая | 0–2 | Высокогорье |
| Малая | 2–5 | Горные районы |
| Средняя | 5–10 | Зоны широколиственных лесов, степи, полупустыни и пустыни, а также тундра |
| Повышенная | 15–20 | Северная и южная тайга |
Окисляемость подвержена закономерным сезонным колебаниям. Их характер определяется, с одной стороны, гидрологическим режимом и зависящим от него поступлением органических веществ с водосбора, с другой, – гидробиологическим режимом.
В водоемах и водотоках, подверженных сильному воздействию хозяйственной деятельности человека, изменение окисляемости выступает как характеристика, отражающая режим поступления сточных вод. Для природных малозагрязненных вод рекомендовано определять перманганатную окисляемость; в более загрязненных водах определяют, как правило, бихроматную окисляемость (ХПК).
| В соответствии с требованиями к составу и свойствам воды водоемов у пунктов питьевого водопользования величина ХПК не должна превышать 15 мг О/дм3; в зонах рекреации в водных объектах допускается величина ХПК до 30 мг О/дм3. |
В программах мониторинга ХПК используется в качестве меры содержания органического вещества в пробе, которое подвержено окислению сильным химическим окислителем. ХПК применяют для характеристики состояния водотоков и водоемов, поступления бытовых и промышленных сточных вод (в том числе, и степени их очистки), а также поверхностного стока.
Величины ХПК в водоемах с различной степенью загрязненности
| Степень загрязнения (классы водоемов) | ХПК, мг О/дм3 |
| Очень чистые | 1 |
| Чистые | 2 |
| Умеренно загрязненные | 3 |
| Загрязненные | 4 |
| Грязные | 5–15 |
| Очень грязные | >15 |
Для вычисления концентрации углерода, содержащегося в органических веществах, значение ХПК (мг О/дм3) умножается на 0,375 (коэффициент, равный отношению количества вещества эквивалента углерода к количеству вещества эквивалента кислорода).
Биохимическое потребление кислорода (БПК)
Степень загрязнения воды органическими соединениями определяют как количество кислорода, необходимое для их окисления микроорганизмами в аэробных условиях. Биохимическое окисление различных веществ происходит с различной скоростью. К легкоокисляющимся ("биологически мягким") веществам относят формальдегид, низшие алифатические спирты, фенол, фурфурол и др. Среднее положение занимают крезолы, нафтолы, ксиленолы, резорцин, пирокатехин, анионоактивные ПАВ и др. Медленно разрушаются "биологически жесткие" вещества, такие как гидрохинон, сульфонол, неионогенные ПАВ и др.
БПК5
В лабораторных условиях наряду с БПКп определяется БПК5 – биохимическая потребность в кислороде за 5 суток.
| В поверхностных водах величины БПК5 изменяются обычно в пределах 0,5–4 мг O2/дм3 и подвержены сезонным и суточным колебаниям. |
Сезонные колебания зависят в основном от изменения температуры и от исходной концентрации растворенного кислорода. Влияние температуры сказывается через ее воздействие на скорость процесса потребления, которая увеличивается в 2–3 раза при повышении температуры на 10oC. Влияние начальной концентрации кислорода на процесс биохимического потребления кислорода связано с тем, что значительная часть микроорганизмов имеет свой кислородный оптимум для развития в целом и для физиологической и биохимической активности.
Суточные колебания величин БПК5 также зависят от исходной концентрации растворенного кислорода, которая может в течение суток изменяться на 2,5 мг О2/дм3 в зависимости от соотношения интенсивности процессов его продуцирования и потребления. Весьма значительны изменения величин БПК5 в зависимости от степени загрязненности водоемов.
Величины БПК5 в водоемах с различной степенью загрязненности
| Степень загрязнения (классы водоемов) | БПК5, мг O2/дм3 |
| Очень чистые | 0,5–1,0 |
| Чистые | 1,1–1,9 |
| Умеренно загрязненные | 2,0–2,9 |
| Загрязненные | 3,0–3,9 |
| Грязные | 4,0–10,0 |
| Очень грязные | 10,0 |
Для водоемов, загрязненных преимущественно хозяйственно-бытовыми сточными водами, БПК5 составляет обычно около 70% БПКп.
| В зависимости от категории водоема величина БПК5 регламентируется следующим образом: не более 3 мг O2/дм3 для водоемов хозяйственно-питьевого водопользования и не более 6 мг O2/дм3 для водоемов хозяйственно-бытового и культурного водопользования. Для морей (I и II категории рыбохозяйственного водопользования) пятисуточная потребность в кислороде (БПК5) при 20оС не должна превышать 2 мг O2/дм3. |
Определение БПК5 в поверхностных водах используется с целью оценки содержания биохимически окисляемых органических веществ, условий обитания гидробионтов и в качестве интегрального показателя загрязненности воды. Необходимо использовать величины БПК5 при контролировании эффективности работы очистных сооружений.
БПКп
Полным биохимическим потреблением кислорода (БПКп) считается количество кислорода, требуемое для окисления органических примесей до начала процессов нитрификации. Количество кислорода, расходуемое для окисления аммонийного азота до нитритов и нитратов, при определении БПК не учитывается. Для бытовых сточных вод (без существенной примеси производственных) определяют БПК20, считая, что эта величина близка к БПКп.
| Полная биологическая потребность в кислороде БПКп для внутренних водоемов рыбохозяйственного назначения (I и II категории) при 20оС не должна превышать 3 мг O2/дм3. |
[an error occurred while processing this directive]
Жесткость
Жесткость воды представляет собой свойство природной воды, зависящее от наличия в ней главным образом растворенных солей кальция и магния. Суммарное содержание этих солей называют общей жесткостью. Общая жесткость подразделяется на карбонатную, обусловленную концентрацией гидрокарбонатов (и карбонатов при рН 8,3) кальция и магния, и некарбонатную – концентрацию в воде кальциевых и магниевых солей сильных кислот. Поскольку при кипячении воды гидрокарбонаты переходят в карбонаты, которые выпадают в осадок, карбонатную жесткость называют временной или устранимой. Остающаяся после кипячения жесткость называется постоянной. Результаты определения жесткости обычно выражают в мг-экв/дм3.
В естественных условиях ионы кальция, магния и других щелочноземельных металлов, обуславливающих жесткость, поступают в воду в результате взаимодействия растворенного диоксида углерода с карбонатными минералами и других процессов растворения и химического выветривания горных пород. Источником этих ионов являются также микробиологические процессы, протекающие в почвах на площади водосбора, в донных отложениях, а также сточные воды различных предприятий.
| Жесткость воды колеблется в широких пределах. Вода с жесткостью менее 4 мг-экв/дм3 считается мягкой, от 4 до 8 мг-экв/дм3 – средней жесткости, от 8 до 12 мг-экв/дм3 – жесткой и выше 12 мг-экв/дм3 – очень жесткой. Общая жесткость колеблется от единиц до десятков, иногда сотен мг-экв/дм3, причем карбонатная жесткость составляет до 70–80% от общей жесткости. |
Обычно преобладает жесткость, обусловленная ионами кальция (до 70%); однако в отдельных случаях магниевая жесткость может достигать 50–60%. Жесткость морской воды и океанов значительно выше (десятки и сотни мг-экв/дм3). Жесткость поверхностных вод подвержена заметным сезонным колебаниям, достигая обычно наибольшего значения в конце зимы и наименьшего в период половодья.
Высокая жесткость ухудшает органолептические свойства воды, придавая ей горьковатый вкус и оказывая действие на органы пищеварения.
| Величина общей жесткости в питьевой воде не должна превышать 10,0 мг-экв/дм3. Особые требования предъявляются к технической воде (из-за образования накипи). |
36 Кальций
Главными источниками поступления кальция в поверхностные воды являются процессы химического выветривания и растворения минералов, прежде всего известняков, доломитов, гипса, кальцийсодержащих силикатов и других осадочных и метаморфических пород.
CaCO3 + CO2 + H2O Са(HCO3)2 Ca2+ + 2HCO3-
Растворению способствуют микробиологические процессы разложения органических веществ, сопровождающиеся понижениемрН.
Большие количества кальция выносятся со сточными водами силикатной, металлургической, стекольной, химической промышленности и со стоками сельскохозяйственных угодий, особенно при использовании кальцийсодержащих минеральных удобрений.
Характерной особенностью кальция является склонность образовывать в поверхностных водах довольно устойчивые пересыщенные растворыCaCO3. Ионная форма (Ca2+) характерна только для маломинерализованных природных вод. Известны довольно устойчивые комплексные соединения кальция с органическими веществами, содержащимися в воде. В некоторых маломинерализованных окрашенных водах до 90-100% ионов кальция могут быть связаны гумусовыми кислотами.
В речных водах содержание кальция редко превышает 1 г/дм3. Обычно же его концентрации значительно ниже.
Концентрация кальция в поверхностных водах подвержена заметным сезонным колебаниям. В период понижения минерализации (весной) ионам кальция принадлежит преобладающая роль, что связано с легкостью выщелачивания растворимых солей кальция из поверхностного слоя почв и пород.
ПДКвр кальция составляет 180 мг/дм3.
Довольно жесткие требования к содержанию кальция предъявляются к водам, питающим паросиловые установки, поскольку в присутствии карбонатов, сульфатов и ряда других анионов кальций образует прочную накипь. Данные о содержании кальция в водах необходимы также при решении вопросов, связанных с формированием химического состава природных вод, их происхождением, а также при исследовании карбонатно-кальциевого равновесия.
Магний
В поверхностные воды магний поступает в основном за счет процессов химического выветривания и растворения доломитов, мергелей и других минералов. Значительные количества магния могут поступать в водные объекты со сточными водами металлургических, силикатных, текстильных и других предприятий.
В речных водах содержание магния обычно колеблется от нескольких единиц до десятков миллиграммов в 1 дм3.
Содержание магния в поверхностных водах подвержено заметным колебаниям: как правило, максимальные концентрации наблюдаются в меженный период, минимальные - в период половодья.
ПДКвр ионов Мg2+ составляет 40 мг/дм3.
Кремний
| |
|
| Степень загрязнения (классы водоемов) | Аммонийный азот, мг/дм3 |
| Очень чистые | 0,05 |
| Чистые | 0,1 |
| Умеренно загрязненные | 0,2-0,3 |
| Загрязненные | 0,4-1,0 |
| Грязные | 1,1-3,0 |
| Очень грязные | >3,0 |
|
| Культура | ПДКпр. | Культура | ПДКпр. |
| Листовые овощи | 2000 | Картофель | 250 |
| Перец сладкий | 200 | Капуста ранняя | 900 |
| Кабачки | 400 | Морковь | 250 |
| Дыни | 90 | Томаты | 150 |
| Арбузы | 60 | Огурцы | 150 |
| Виноград столовый | 60 | Свекла столовая | 1400 |
| Яблоки | 60 | Лук репчатый | 80 |
| Груши | 60 | Лук перо | 600 |
|
.
Сульфаты
Сульфаты присутствуют практически во всех поверхностных водах и являются одними из важнейших анионов.
Главным источником сульфатов в поверхностных водах являются процессы химического выветривания и растворения серосодержащих минералов, в основном гипса, а также окисления сульфидов и серы:
2FeS2 + 7O2+ 2H2O = 2FeSO4 + 2H2SO4;
2S + 3O2 + 2H2O = 2H2SO4.
Значительные количества сульфатов поступают в водоемы в процессе отмирания организмов, окисления наземных и водных веществ растительного и животного происхождения и с подземным стоком.
В больших количествах сульфаты содержатся в шахтных водах и в промышленных стоках производств, в которых используется серная кислота, например, окисление пирита. Сульфаты выносятся также со сточными водами коммунального хозяйства и сельскохозяйственного производства.
Ионная формаSO42- характерна только для маломинерализованных вод. При увеличении минерализации сульфатные ионы склонны к образованию устойчивых ассоциированных нейтральных пар типа CaSO4,MgSO4.
Содержание сульфатных ионов в растворе ограничивается сравнительно малой растворимостью сульфата кальция (произведение растворимости сульфата кальцияL=6,1·10-5). При низких концентрациях кальция, а также в присутствии посторонних солей концентрация сульфатов может значительно повышаться.
Сульфаты активно участвуют в сложном круговороте серы. При отсутствии кислорода под действием сульфатредуцирующих бактерий они восстанавливаются до сероводорода и сульфидов, которые при появлении в природной воде кислорода снова окисляются до сульфатов. Растения и другие автотрофные организмы извлекают растворенные в воде сульфаты для построения белкового вещества. После отмирания живых клеток гетеротрофные бактерии освобождают серу протеинов в виде сероводорода, легко окисляемого до сульфатов в присутствии кислорода.
Концентрация сульфата в природной воде лежит в широких пределах. В речных водах и в водах пресных озер содержание сульфатов часто колеблется от 5-10 до 60 мг/дм3, в дождевых водах - от 1 до 10 мг/дм3. В подземных водах содержание сульфатов нередко достигает значительно больших величин.
Концентрация сульфатов в поверхностных водах подвержена заметным сезонным колебаниям и обычно коррелирует с изменением общей минерализации воды. Важнейшим фактором, определяющим режим сульфатов, являются меняющиеся соотношения между поверхностным и подземным стоками. Заметное влияние оказывают окислительно-восстановительные процессы, биологическая обстановка в водном объекте и хозяйственная деятельность человека.
Вкусовой порог сульфата магния лежит в пределах от 400 до 600 мг/дм3, для сульфата кальция - от 250 до 800 мг/дм3. Наличие сульфата в промышленной и питьевой воде может быть как полезным, так и вредным.
ПДКв сульфатов составляет 500 мг/дм3, ПДКвр - 100 мг/дм3.
Не замечено, чтобы сульфат в питьевой воде влиял на процессы коррозии, но при использовании свинцовых труб концентрация сульфатов выше 200 мг/дм3 может привести к вымыванию в воду свинца.
Хлориды
В речных водах и водах пресных озер содержание хлоридов колеблется от долей миллиграмма до десятков, сотен, а иногда и тысяч миллиграммов на литр. В морских и подземных водах содержание хлоридов значительно выше - вплоть до пересыщенных растворов и рассолов.
Хлориды являются преобладающим анионом в высокоминерализованных водах. Концентрация хлоридов в поверхностных водах подвержена заметным сезонным колебаниям, коррелирующим с изменением общей минерализации воды.
Первичными источниками хлоридов являются магматические породы, в состав которых входят хлорсодержащие минералы (содалит, хлорапатит и др.), соленосные отложения, в основном галит. Значительные количества хлоридов поступают в воду в результате обмена с океаном через атмосферу, взаимодействия атмосферных осадков с почвами, особенно засоленными, а также при вулканических выбросах. Возрастающее значение приобретают промышленные и хозяйственно-бытовые сточные воды.
В отличие от сульфатных и карбонатных ионов хлориды не склонны к образованию ассоциированных ионных пар. Из всех анионов хлориды обладают наибольшей миграционной способностью, что объясняется их хорошей растворимостью, слабо выраженной способностью к сорбции взвешенными веществами и потреблением водными организмами. Повышенные содержания хлоридов ухудшают вкусовые качества воды, делают ее малопригодной для питьевого водоснабжения и ограничивают применение для многих технических и хозяйственных целей, а также для орошения сельскохозяйственных угодий. Если в питьевой воде есть ионы натрия, то концентрация хлорида выше 250 мг/дм3 придает воде соленый вкус. Концентрации хлоридов и их колебания, в том числе суточные, могут служить одним из критериев загрязненности водоема хозяйственно-бытовыми стоками.
Нет данных о том, что высокие концентрации хлоридов оказывают вредное влияние на человека. ПДКв составляет 350 мг/дм3, ПДКвр - 300 мг/дм3.
Марганец
В поверхностные воды марганец поступает в результате выщелачивания железомарганцевых руд и других минералов, содержащих марганец (пиролюзит, псиломелан, браунит, манганит, черная охра). Значительные количества марганца поступают в процессе разложения водных животных и растительных организмов, особенно сине-зеленых, диатомовых водорослей и высших водных растений. Соединения марганца выносятся в водоемы со сточными водами марганцевых обогатительных фабрик, металлургических заводов, предприятий химической промышленности и с шахтными водами.
Понижение концентрации ионов марганца в природных водах происходит в результате окисления Mn(II) доMnO2 и других высоковалентных оксидов, выпадающих в осадок. Основные параметры, определяющие реакцию окисления, - концентрация растворенного кислорода, величинарН и температура. Концентрация растворенных соединений марганца понижается вследствие утилизации их водорослями.
Главная форма миграции соединений марганца в поверхностных водах - взвеси, состав которых определяется в свою очередь составом пород, дренируемых водами, а также коллоидные гидроксиды тяжелых металлов и сорбированные соединения марганца. Существенное значение в миграции марганца в растворенной и коллоидной формах имеют органические вещества и процессы комплексообразования марганца с неорганическими и органическими лигандами.Mn(II) образует растворимые комплексы с бикарбонатами и сульфатами. Комплексы марганца с ионом хлора встречаются редко. Комплексные соединения Mn(II) с органическими веществами (аминами, органическими кислотами, аминокислотами и гумусовыми веществами) обычно менее прочны, чем аналогичные соединения с другими переходными металлами.Mn(III) в повышенных концентрациях может находиться в растворенном состоянии только в присутствии сильных комплексообразователей,Mn(VII) в природных водах не встречается.
В речных водах содержание марганца колеблется обычно от 1 до 160 мкг/дм3, среднее содержание в морских водах составляет 2 мкг/дм3, в подземных -n·102-n·103 мкг/дм3.
Концентрация марганца в поверхностных водах подвержена сезонным колебаниям.
Факторами, определяющими изменения концентраций марганца, являются соотношение между поверхностным и подземным стоком, интенсивность потребления его при фотосинтезе, разложение фитопланктона, микроорганизмов и высшей водной растительности, а также процессы осаждения его на дно водных объектов.
Роль марганца в жизни высших растений и водорослей водоемов весьма велика. Марганец способствует утилизацииCO2 растениями, чем повышает интенсивность фотосинтеза, участвует в процессах восстановления нитратов и ассимиляции азота растениями. Марганец способствует переходу активного Fe(II) в Fe(III), что предохраняет клетку от отравления, ускоряет рост организмов и т.д. Важная экологическая и физиологическая роль марганца вызывает необходимость изучения марганца и его распределения в природных водах.
Для марганца ПДКв (по иону марганца) установлена 0,1 мг/дм3 (лимитирующий показатель вредности - органолептический), ПДКвр - 0,01 мг/дм3 (лимитирующий показатель вредности - токсикологический).
Ртуть
В поверхностные воды соединения ртути могут поступать в результате выщелачивания пород в районе ртутных месторождений (киноварь, метациннабарит, ливингстонит), в процессе разложения водных организмов, накапливающих ртуть. Значительные количества поступают в водные объекты со сточными водами электролизных производств, предприятий, производящих красители, пестициды, фармацевтические препараты, некоторые взрывчатые вещества. Тепловые электростанции, работающие на угле, выбрасывают в атмосферу значительные количества соединений ртути, которые в результате мокрых и сухих выпадений попадают в водные объекты.
Понижение концентрации растворенных соединений ртути происходит в результате извлечения их многими морскими и пресноводными организмами, обладающими способностью накапливать ее в концентрациях, во много раз превышающих содержание ее в воде, а также в результате процессов адсорбции взвешенными веществами и донными отложениями.
В поверхностных водах соединения ртути находятся в растворенном и взвешенном состоянии. Соотношение между ними зависит от химического состава воды и значенийрН. Взвешенная ртуть представляет собой сорбированные соединения ртути. Растворенными формами являются недиссоциированные молекулы, комплексные органические и минеральные соединения. В воде водных объектов ртуть может находиться в виде метилртутных соединений.
Содержание ртути в речных незагрязненных и слабозагрязненных водах составляет несколько десятых долей микрограмма в 1 дм3, средняя концентрация в морской воде 0,03 мкг/дм3, в подземных водах 1-3 мкг/дм3.
Соединения ртути высоко токсичны, они поражают нервную систему человека, вызывают изменение слизистой оболочки, нарушение двигательной функции и секреции желудочно-кишечного тракта, изменения в крови и др. Бактериальные процессы метилирования направлены на образование метилртутных соединений, которые во много раз токсичнее минеральных солей ртути. Метилртутные соединения накапливаются в пищевых цепях (например, фитопланктон-зоопланктон-рыба) и могут попадать в организм человека.
ПДКв ртути составляет 0,0005 мг/дм3 (лимитирующий показатель вредности - санитарно-токсикологический), ПДКвр - 0,0001 мг/дм3 (лимитирующий показатель вредности - токсикологический).
37 Углеводороды (нефтепродукты)
Нефтепродукты относятся к числу наиболее распространенных и опасных веществ, загрязняющих поверхностные воды. Нефть и продукты ее переработки представляют собой чрезвычайно сложную, непостоянную и разнообразную смесь веществ (низко- и высокомолекулярные предельные, непредельные алифатические, нафтеновые, ароматические углеводороды, кислородные, азотистые, сернистые соединения, а также ненасыщенные гетероциклические соединения типа смол, асфальтенов, ангидридов, асфальтеновых кислот). Понятие "нефтепродукты" в гидрохимии условно ограничивается только углеводородной фракцией (алифатические, ароматические, алициклические углеводороды).
Большие количества нефтепродуктов поступают в поверхностные воды при перевозке нефти водным путем, со сточными водами предприятий нефтедобывающей, нефтеперерабатывающей, химической, металлургической и других отраслей промышленности, с хозяйственно-бытовыми водами. Некоторые количества углеводородов поступают в воду в результате прижизненных выделений растительными и животными организмами, а также в результате их посмертного разложения.
В результате протекающих в водоеме процессов испарения, сорбции, биохимического и химического окисления концентрация нефтепродуктов может существенно снижаться, при этом значительным изменениям может подвергаться их химический состав. Наиболее устойчивы ароматические углеводороды, наименее - н-алканы.
Нефтепродукты находятся в различных миграционных формах: растворенной, эмульгированной, сорбированной на твердых частицах взвесей и донных отложений, в виде пленки на поверхности воды. Обычно в момент поступления масса нефтепродуктов сосредоточена в пленке. По мере удаления от источника загрязнения происходит перераспределение между основными формами миграции, направленное в сторону повышения доли растворенных, эмульгированных, сорбированных нефтепродуктов. Количественное соотношение этих форм определяется комплексом факторов, важнейшими из которых являются условия поступления нефтепродуктов в водный объект, расстояние от места сброса, скорость течения и перемешивания водных масс, характер и степень загрязненности природных вод, а также состав нефтепродуктов, их вязкость, растворимость, плотность, температура кипения компонентов. При санитарно-химическом контроле определяют, как правило, сумму растворенных, эмульгированных и сорбированных форм нефти.
Содержание нефтепродуктов в речных, озерных, морских, подземных водах и атмосферных осадках колеблется в довольно широких пределах и обычно составляет сотые и десятые доли мг/дм3.
В незагрязненных нефтепродуктами водных объектах концентрация естественных углеводородов может колебаться в морских водах от 0,01 до 0,10 мг/дм3 и выше, в речных и озерных водах от 0,01 до 0,20 мг/дм3, иногда достигая 1-1,5 мг/дм3. Содержание естественных углеводородов определяется трофическим статусом водоема и в значительной мере зависит от биологической ситуации в водоеме.
Неблагоприятное воздействие нефтепродуктов сказывается различными способами на организме человека, животном мире, водной растительности, физическом, химическом и биологическом состоянии водоема. Входящие в состав нефтепродуктов низкомолекулярные алифатические, нафтеновые и особенно ароматические углеводороды оказывают токсическое и, в некоторой степени, наркотическое воздействие на организм, поражая сердечно-сосудистую и нервную системы. Наибольшую опасность представляют полициклические конденсированные углеводороды типа 3,4-бензапирена, обладающие канцерогенными свойствами. Нефтепродукты обволакивают оперение птиц, поверхность тела и органы других гидробионтов, вызывая заболевания и гибель.
Отрицательное влияние нефтепродуктов, особенно в концентрациях 0,001-10 мг/дм3, и присутствие их в виде пленки сказывается и на развитии высшей водной растительности и микрофитов.
В присутствии нефтепродуктов вода приобретает специфический вкус и запах, изменяется ее цвет,рН, ухудшается газообмен с атмосферой.
ПДКв нефтепродуктов составляет 0,3 мг/дм3 (лимитирующий показатель вредности - органолептический), ПДКвр - 0,05 мг/дм3 (лимитирующий показатель вредности - рыбохозяйственный). Присутствие канцерогенных углеводородов в воде недопустимо.
Синтетические поверхностно-активные вещества (СПАВ)
СПАВ представляют собой обширную группу соединений, различных по своей структуре, относящихся к разным классам. Эти вещества способны адсорбироваться на поверхности раздела фаз и понижать вследствие этого поверхностную энергию (поверхностное натяжение). В зависимости от свойств, проявляемых СПАВ при растворении в воде, их делят на анионоактивные вещества (активной частью является анион), катионоактивные (активной частью молекул является катион), амфолитные и неионогенные, которые совсем не ионизируются.
Анионоактивные СПАВ в водном растворе ионизируются с образованием отрицательно заряженных органических ионов. Из анионоактивных СПАВ широкое применение нашли соли сернокислых эфиров (сульфаты) и соли сульфокислот (сульфонаты). Радикал R может быть алкильным, алкиларильным, алкилнафтильным, иметь двойные связи и функциональные группы.
Катионоактивные СПАВ — вещества, которые ионизируются в водном растворе с образованием положительно заряженных органических ионов. К ним относятся четвертичные аммониевые соли, состоящие из: углеводородного радикала с прямой цепью, содержащей 12-18 атомов углерода; метильного, этильного или бензильного радикала; хлора, брома, иода или остатка метил- или этилсульфата.
Амфолитные СПАВ ионизируются в водном растворе различным образом в зависимости от условий среды: в кислом растворе проявляют катионоактивные свойства, а в щелочном — анионоактивные.
Неионогенные СПАВ представляют собой высокомолекулярные соединения, которые в водном растворе не образуют ионов.
В водные объекты СПАВ поступают в значительных количествах с хозяйственно-бытовыми (использование синтетических моющих средств в быту) и промышленными сточными водами (текстильная, нефтяная, химическая промышленность, производство синтетических каучуков), а также со стоком с сельскохозяйственных угодий (в качестве эмульгаторов входят в состав инсектицидов, фунгицидов, гербицидов и дефолиантов).
Главными факторами понижения их концентрации являются процессы биохимического окисления, сорбция взвешенными веществами и донными отложениями. Степень биохимического окисления СПАВ зависит от их химического строения и условий окружающей среды.
По биохимической устойчивости, определяемой структурой молекул, СПАВ делят на мягкие, промежуточные и жесткие с константами скорости биохимического окисления, соответственно не менее 0,3 сутки-1; 0,3-0,05 сутки-1; менее 0,05 сутки-1. К числу наиболее легко окисляющихся СПАВ относятся первичные и вторичные алкилсульфаты нормального строения. С увеличением разветвления цепи скорость окисления понижается, и наиболее трудно разрушаются алкилбензолсульфонаты, приготовленные на основе тетрамеров пропилена.
При понижении температуры скорость окисления СПАВ уменьшается и при 0-5°С протекает весьма медленно. Наиболее благоприятные для процесса самоочищения от СПАВ нейтральная или слабощелочная среды (рН 7-9).
С повышением содержания взвешенных веществ и значительным контактом водной массы с донными отложениями скорость снижения концентрации СПАВ в воде обычно повышается за счет сорбции и соосаждения. При значительном накоплении СПАВ в донных отложениях в аэробных условиях происходит окисление микрофлорой донного ила. В случае анаэробных условий СПАВ могут накапливаться в донных отложениях и становиться источником вторичного загрязнения водоема.
Максимальные количества кислорода (БПК), потребляемые 1 мг/дм3 различных ПАВ колеблется от 0 до 1,6 мг/дм3. При биохимическом окислении СПАВ, образуются различные промежуточные продукты распада: спирты, альдегиды, органические кислоты и др. В результате распада СПАВ, содержащих бензольное кольцо, образуются фенолы.
В поверхностных водах СПАВ находятся в растворенном и сорбированном состоянии, а также в поверхностной пленке воды водного объекта.
| В слабозагрязненных поверхностных водах концентрация СПАВ колеблется обычно в пределах тысячных и сотых долей миллиграмма в 1 дм3. В зонах загрязнения водных объектов концентрация повышается до десятых долей миллиграмма, вблизи источников загрязнения может достигать нескольких миллиграммов в 1 дм3. |
Попадая в водоемы и водотоки, СПАВ оказывают значительное влияние на их физико-биологическое состояние, ухудшая кислородный режим и органолептические свойства, и сохраняются там долгое время, так как разлагаются очень медленно. Отрицательным, с гигиенической точки зрения, свойством ПАВ является их высокая пенообразующая способность. Хотя СПАВ не являются высокотоксичными веществами, имеются сведения о косвенном их воздействии на гидробионтов. При концентрациях 5-15 мг/дм3 рыбы теряют слизистый покров, при более высоких концентрациях может наблюдаться кровотечение жабр.
| ПДКв СПАВ составляет 0,5 мг/дм3, ПДКвр — 0,1 мг/дм3. |
Неионогенные поверхностно-активные вещества (НПАВ)
Токсическое действие НПАВ определяется главным образом неполярной частью молекулы, при этом оно более выражено при наличии в последней ароматического кольца.
| ПДКв большинства НПАВ (препараты ОП-7, ОП-10, ОС-20, оксанол КШ-9, оксанол Л-7, проксамин 385, проксанол 186, синтамид, синтанолы, ВН-7 и др.) 0,1 мг/дм3, лимитирующий показатель вредности — органолептический (пенообразование). Поскольку указанные соединения имеют один норматив с одним и тем же показателем вредности, при санитарно-химическом контроле можно ограничиваться определением их суммарного содержания. |
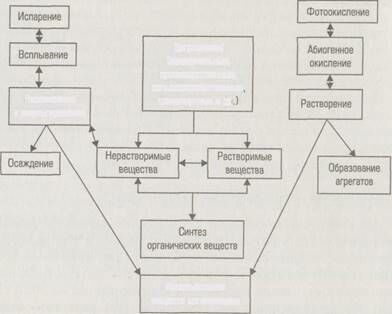
Самоочищение водоема — это совокупность всех природных процессов, направленных на восстановление первоначальных свойств и состава воды
|
|
| Загрязнения (коммунальные, производственные, сельскохозяйственные транспортные и др |
| Рассеивание и эмульгирование |
| Использование веществ организмами |
Самоочищение водоема — это совокупность всех природных процессов, направленных на восстановление первоначальных свойств
Основная роль в процессе самоочищения принадлежит биологическому фактору.
Процесс деструкции органических загрязнений осуществляется всем сообществом гидробионтов, образующих трофическую цепь
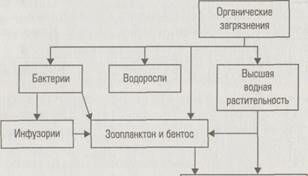
Рыбы, моллюски,
ракообразные и другие гидробионты
Трофическая цепь самоочищения водоема
Попавшее в водоем загрязнение вовлекается в комплекс физических, физико-химических, химических и биологических процессов трансформации. Прежде всего попавшие в водоем загряз нения подвергаются разбавлению (рассеиванию), часть из (например, нефтяные битумы) оседает на дно водоема (оседание загрязнений на дно водоема происходит с участием гидробионтов седиментаторов и фильтраторов), другая часть всплывает виде пленки или пены. Некоторые всплывшие загрязнения испаряются с поверхности водоема (летучая органика), другие подвергают ся разложению ультрафиолетовыми лучами. Важнейшим фактор самоочищения является гидролиз, в результате которого пocтупившие в водоем загрязнения подвергаются глубоким изменениям. Например, при гидролизе аммонийных солей, с образованием гидрата окиси аммония наблюдается снижение его концентрации в связи летучестью аммиака.
Главную роль в процессах самоочищения играют микроорганизмы, и прежде всего бактерии. Все бактерии водоема делятся на две группы: автохтонные — присущие данному водоему, и аллохтонные — попавшие в него извне. В случае благоприятных условий среды аллохтонные бактерии приживаются в водоеме, но чаще всего постепенно отмирают, что также является благоприятным фактором, поскольку многие из них относятся к патогенным. Современные исследователи выделяют три биологических фактора самоочищения водоема от патогенных микроорганизмов: антибиотический (антибиотические вещества фитопланктона, макрофитов, зоогидробионтов, микробов-антагонистов); паразитический (лизирующее действие бактериофагов, т.е. растворение или разрушение микробной клетки) и бактериотрофный (бактерио-трофная активность — поедание бактерий Protozoa и Metaioa).
Вместе с этой лекцией читают "Газетная периодика XVIII - нач. XX вв".
Первым трофическим уровнем, окисляющим органические загрязнения, являются бактерии; вторым — инфузории, поедающие бактерии; третьим — зоопланктон, питающийся инфузориями и бактериями. Рыбы и другие гидробионты поедают зоопланктон,водоросли и некоторые высшие водные растения. По данным А.С. Константинова, на Волгоградском водохранилище без учета дыхания водорослей и микрозообентоса за вегетационный период суммарная минерализация составляет 1590 г/м2 сухого органического вещества. Из этого количества 42% минерализуется бактери-опланктоном, 40% — бактериобентосом, 10% — планктонными инфузориями, 5% — моллюсками, 1,5% — ветвистоусыми рачками и менее 15% — остальными группами зоопланктонов.
Водоросли также способны непосредственно усваивать простые органические соединения, а также соединения азота и фосфора, что интенсифицирует процесс самоочищения водоема. Кроме того, водоросли способствуют насыщению воды кислородом. Однако чрезмерное развитие водорослей может привести к вторичному загрязнению водоема после их отмирания. Для водоемов характерно развитие диатомовых водорослей, зеленых одноклеточных (Chlorella, Scenedesmus, Ankistrodesmus).
Водоросли могут вызывать и так называемое цветение водоема, характерное для непроточных водоемов озер, прудов, водохранилищ. «Цветение» — явление сезонное и может быть вызвано различными водорослями. В начале весны наблюдается «цветение» диатомовыми водорослями (Asterionella, Synedra, Melosim), при этом вода приобретает желтовато-коричневый цвет; в середине лета часто наблюдается «цветение» сине-зелеными водорослями (Anabaena, Oscillatoria), придающее воде голубовато-зеленый цвет, неприятный привкус и запах.
Большую роль в процессе самоочищения водоемов играет высшая водная растительность— макрофиты, которые не только изымают биогенные элементы, соли тяжелых металлов, фенолы, нефтепродукты и другие загрязнения, но и снабжают водоем кислородом за счет фотосинтетического аэрирования. В местах развития высшей водной растительности практически не наблюдается «цветение» водоема, что объясняется изъятием основных биогенных элементов.
Например, тростник обыкновенный, при урожае 44 т/га по сухому веществу может изъять из воды 667 кг/га азота, 276 кг/га фосфора, 419 кг/га калия, 408 кг/га соединений хлора и 198 кг/га кальция. Рогоз узколистный изымает меньше азота, фосфора и соединений хлора, но кальция и особенно натрия он изымает в 2—3 раза больше, чем тростник.
Отмечена избирательная способность высших водных растений к изъятию отдельных химических элементов и их соединений, что используется в последнее время для создания биологических прудов с высшей водной растительностью. Кроме того, стебли мак-рофитов, находящиеся в воде, подвержены биообрастаниям, состоящим из микроорганизмов-минерализаторов, что также вносит значительный вклад в процессы самоочищения водоема.