Основные термодинамические процессы в газах, парах и их смесях
Глава четвертая. Основные термодинамические процессы в газах, парах и их смесях
4.1. ТЕРМОДИНАМИЧЕСКИЕ ПРОЦЕССЫ ИДЕАЛЬНЫХ ГАЗОВ В ЗАКРЫТЫХ СИСТЕМАХ
Основными процессами, весьма важными и в теоретическом, и в прикладном отношениях, являются: изохорный, протекающий при постоянном объеме; изобарный, протекающий при постоянном давлении; изотермический, происходящий при постоянной температуре; адиабатный — процесс, при котором отсутствует теплообмен с окружающей средой, и политропный, удовлетворяющий уравнению рvn = const.
Метод исследования процессов, не зависящий от их особенностей и являющийся общим, состоит в следующем:
выводится уравнение процесса, устанавливающее связь между начальными и конечными параметрами рабочего тела в данном процессе;
вычисляется работа изменения объема газа;
определяется количество теплоты, подведенной (или отведенной) к газу в процессе;
определяется изменение внутренней энергии системы в процессе;
определяется изменение энтропии системы в процессе.
Рекомендуемые материалы
Изохорный процесс. При изохорном процессе выполняется условие
dv = 0 или v = const. Из уравнения состояния идеального газа (1.3) следует, что p/T = R/v = const, т.е. давление газа прямо пропорционально его абсолютной температуре:
p2/p1 = T2/T1 (4.1)
На рис.1 представлен график процесса.
Работа расширения в этом процессе равна нулю, так как dv=0.
Количество теплоты, подведенной к рабочему телу в процессе 12 при
сv = const, определяется из соотношений (2.23):
q =  = cv (T2 – T1) (4.2)
= cv (T2 – T1) (4.2)
При переменной теплоемкости
q = cv ср|t2t1(t2 – t1) = cv ср|t20 t2 – cv ср|t10 t1, (4.3)
где cv ср|t2t1 – средняя массовая изохорная теплоемкость в интервале температур от t1 до t2 .
Так как l = 0, то в соответствии с первым законом термодинамики
Δu = q и
Δu = cv (Т2 – Т1 ) при cv = const;
Δu = cv ср| t2t1(t2 - t1) при cv = var. (4.4)
Поскольку внутренняя энергия идеального газа является функцией только его температуры, то формулы (4.4) справедливы для любого термодинамического процесса идеального газа.
Изменение энтропии в изохорном процессе определяется по формуле (3.6):
s2 – s1 = cv ln(p2/p1) = cv ln(T2/T1). (4.5)
т.е. зависимость энтропии от температуры на изохоре при сv = const имеет логарифмический характер (см. рис. 4.1).
Изобарный процесс. Из уравнения состояния идеального газа (1.3) при
р = const находим
v/T = R/p = const, или
v2 /v1 = T2/T1 (4.6)
т. е. в изобарном процессе объем газа пропорционален его абсолютной температуре (закон Гей-Люссака, 1802 г.). На рис. 4.2 изображен график процесса.
Из выражения (2.6) следует, что
l =  pdv = p(v2 - v1) (4.7)
pdv = p(v2 - v1) (4.7)
Так как pv1 = RT1 то одновременно
l = R(T2 - T1 ). (4.8)
Количество теплоты, сообщаемое газу при нагревании (или отдаваемое им при охлаждении), находим из уравнения (2.23):
q =  = cp ср|t2t1 (t2 - t1), (4.9)
= cp ср|t2t1 (t2 - t1), (4.9)
Где ср ср|t2t1 – средняя массовая изобарная теплоемкость в интервале температур от t1 до t2; при ср = const
q = cp (t2 - t1). (4.10)
Изменение энтропии при ср = const согласно (3.5) равно
s2 - s1 = cp ln (T2 /T1) (4.11)
т. е. температурная зависимость энтропии при изобарном процессе тоже имеет логарифмический характер, но поскольку cp>cv , то изобара в
Т, s-диаграмме идет более полого, чем изохора.
Изотермический процесс. При изотермическом процессе температура постоянна, следовательно, pv = RT = const, или
p2/p1 = v1/v2, (4.12)
т. е. давление и объем обратно пропорциональны друг другу, так что при изотермическом сжатии давление газа возрастает, а при расширении — падает (закон Бойля — Мариотта, 1662г.).
Графиком изотермического процесса в p, v – координатах, как показывает уравнение (4.12), является равнобокая гипербола для которой координатные оси служат асимптотами (рис. 4.3).
Работа процесса:
l =  (4.13)
(4.13)
Так как температура не меняется, то внутренняя энергия идеального газа в данном процессе остается постоянной (du = 0) и вся подводимая к газу теплота полностью превращается в работу расширения:
q = l (4.14)
При изотермическом сжатии от газа отводится теплота в количестве, равном затраченной на сжатие работе.
Из соотношений (3.3) и (4.12) следует, что изменение энтропии в изотермическом процессе выражается формулой
s2 – s1 =  R ln (v2/v1) = R ln (p2/p1) (4.15)
R ln (v2/v1) = R ln (p2/p1) (4.15)
Адиабатный процесс. Процесс, происходящий без теплообмена с окружающей средой, называется адиабатным, т. е. δq = 0. Для того чтобы осуществить такой процесс, следует либо теплоизолировать газ,
т. е. поместить его в адиабатную оболочку, либо провести процесс настолько быстро, чтобы изменение температуры газа, обусловленное его теплообменом с окружающей средой, было пренебрежимо мало по сравнению с изменением температуры, вызванным расширением или сжатием газа. Как правило, это возможно, ибо теплообмен происходит значительно медленнее, чем сжатие или расширение газа.
Уравнения первого закона термодинамика для адиабатного процесса принимают вид:
ср dT — vdp = 0; cvdT + pdv = 0 .
Поделив первое уравнение на второе, получим
 , или
, или 
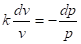
Интегрируя последнее уравнение при условии, что k = cp/cv = const, находим
 и k ln(v2/v1) = ln (p1/p2)
и k ln(v2/v1) = ln (p1/p2)
После потенцирования имеем
(v2/v1)k = p1/p2, или
р1v1k = p2v2k (4.16)
Это и есть уравнения адиабаты идеального газа при постоянном отношении теплоемкостей (k = const). Величина
k = cp/cv (4.17)
называется п о к а з а т е л е м а д и а б а т ы.
Подставив cp = сv + R, получим k =1-R/cv . Согласно классической кинетической теории теплоемкость газов не зависит от температуры (см. § 2.5), поэтому можно считать, что величина k также не зависит от температуры и определяется числом степеней свободы молекулы. Для одноатомного газа k =1,66, для двухатомного k=1,4, для трех-и многоатомных газов k=1,33.
Поскольку k > 1, то в координатах р, v (рис. 4.4) линия адиабаты идет круче линии изотермы: при адиабатном расширении давление понижается быстрее, чем при изотермическом, так как в процессе расширения уменьшается температура газа.
Определив из уравнения состояния, написанного для состояний 1 и 2, отношение объемов или давлений и подставив их в (4.16), получим уравнение адиабатного процесса в форме, выражающей зависимость температуры от объема или
давления:
T2/T1 = (v1/v2)k-1
T2/T1 = (p2/p1)(k-1)/k (4.18)
Работа расширения газа при адиабатическом процессе согласно первому закону термодинамики совершается за счет уменьшения внутренней энергии и может быть вычислена по одной из следующих формул:
l = - Δu = cv(T1 – T2) =  (4.19)
(4.19)
Так как p1v1 = RT1 и p2v2 = RT2, то
l =  (4.20)
(4.20)
В данном процессе теплообмен газа с окружающей средой исключается, поэтому q = 0. Выражение c = δq/dT показывает, что теплоемкость адиабатного процесса равна нулю.
Поскольку при адиабатном процессе δq = 0, энтропия рабочего тела не изменяется (ds = 0 и s = const). Следовательно, на Т, s-диаграмме адиабатный процесс изображается вертикалью.
Политропный процесс и его обобщающее значение. Любой произвольный процесс можно описать в р,v-координатах (по крайней мере на небольшом участке) уравнением
рvn = const, (4.21)
подбирая соответствующее значение п. Процесс, описываемый уравнением (4.21), называется политропным. Показатель политропы п может принимать любое численное значение в пределax от — ∞ до + ∞ (4.21),
но для данного процесса он является величиной постоянной.
Из уравнения (4.21) и уравнения Клапейрона нетрудно получить выражения, устанавливающие связь между p, v и T в любых двух точках на политропе, аналогично тому, как это было сделано для адиабаты:
р2/p1 = (v1/v2)n ; T2/T1 = (v1/v2)n-1; T2/T1 = (p2/p1)n-1/n (4.22)
Работа расширения газа в политропном процессе имеет вид
l = 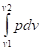
Так как для политропы в соответствии с (4.22)
р = p1(v1/v)n.
То

 =
=  (4.23)
(4.23)
Уравнения (4.23) можно преобразовать к виду :
l =
=  ;
;
l =  ;
;
l =  (4.24)
(4.24)
Количество подведенной (или отведенной) в процессе теплоты можно определить с помощью уравнения первого закона термодинамики:
q = (u2 – u1) + l
Поскольку
u2 - u1 = cv (T2 – T1), то
q =  (4.25)
(4.25)
где  (4.26)
(4.26)
представляет собой теплоемкость идеального газа в политропном процессе. При постоянных сv, k и п теплоемкость сn = const, поэтому политропный процесс иногда определяют как процесс с постоянной теплоемкостью.
Изменение энтропии

 (4.27)
(4.27)
Политропный процесс имеет обобщающее значение, ибо охватывает всю совокупность основных термодинамических процессов. Ниже приведены характеристики термодинамических процессов.
Процесс n cп
Изохорный + ∞ cv
Изобарный 0 cp
Изотермический 1 ∞
Адиабатный k 0
На рис. 4.5 показано взаимное расположение на р, v- и T, s-диаграммах политропных процессов с разными значениями показателя политропы. Все процессы начинаются в одной точке («в центре»).
Изохора (n = ± ∞ ) делит поле диаграммы на две области: процессы, находящиеся правее изохоры, характеризуются положительной работой, так как сопровождаются расширением рабочего тела; для процессов, расположенных левее изохоры, характерна отрицательная работа.
Процессы, расположенные правее и выше адиабаты, идут с подводом теплоты к рабочему телу; процессы, лежащие левее и ниже адиабаты, протекают с отводом теплоты.
Для процессов, расположенных над изотермой (n = 1), характерно увеличение внутренней энергии газа; процессы, расположенные под изотермой, сопровождаются уменьшением внутренней энергии.
Процессы, расположенные между адиабатой и изотермой, имеют отрицательную теплоемкость, так как δq и du (а следовательно, и dT), имеют в этой области противоположные знаки. В таких процессах l >q, поэтому на производство работы при расширении тратится не только подводимая теплота, но и часть внутренней энергии рабочего тела.
4.2. ТЕРМОДИНАМИЧЕСКИЕ ПРОЦЕССЫ РЕАЛЬНЫХ ГАЗОВ
В качестве реального газа рассмотрим водяной пар, который широко используется во многих отраслях техники, и прежде всего в теплоэнергетике, где он является основным рабочим телом. Поэтому исследование термодинамических свойств воды и водяного пара имеет большое практическое значение.
Процесс парообразования. Основные понятия и определения.
Рассмотрим процесс получения пара. Для этого 1 кг воды при температуре 0 °С поместим и цилиндр с подвижным поршнем. Приложим к поршню извне некоторую постоянную силу Р. Тогда при площади поршня F давление будет постоянным и равным p = P/F. Изобразим процесс парообразования, т. е. превращения вещества из жидкого состояния в газообразное, в р,v -диаграмме (рис. 4.6).
Начальное состояние воды, находящейся под давлением р и имеющей температуру 0 °С, изобразится на диаграмме точкой а0 . При подводе теплоты к воде ее температура постепенно повышается до тех пор, пока не достигнет температуры кипения ts , соответствующей данному давлению. При этом удельный объем жидкости сначала уменьшается, достигает минимального значения при t = 4 °С, а затем начинает возрастать. (Такой аномалией — увеличением плотности при нагревании в некотором диапазоне температур — обладают немногие жидкости. У большинства жидкостей удельный объем при нагревании увеличивается монотонно.) Состояние жидкости, доведенной до температуры кипения, изображается на диаграмме точкой а'.
При дальнейшем подводе теплоты начинается кипение воды с сильным увеличением объема. В цилиндре теперь находится двухфазная среда — смесь воды и пара, называемая в л а ж н ы м н а с ы щ е н н ы м
п а р о м. По мере подвода теплоты количество жидкой фазы уменьшается, а паровой — растет. Температура смеси при этом остается неизменной и равной ls, так как вся теплота расходуется на испарение жидкой фазы. Следовательно, процесс парообразования на этой стадии является изобарно-изотермическим. Наконец, последняя капля воды превращается в пар, и цилиндр оказывается заполненным только паром, который называется
с у х и м н а с ы щ е н н ы м. Состояние его изображается точкой а".
Насыщенным называется пар, находящийся в термическом и динамическом равновесии с жидкостью, из которой он образуется. Динамическое равновесие заключается в том, что количество молекул, вылетающих из воды в паровое пространство, равно количеству молекул, конденсирующихся на ее поверхности. В паровом пространстве при этом равновесном состоянии находится максимально возможное при данной температуре число молекул. При увеличении температуры количество молекул, обладающих энергией, достаточной для вылета в паровое пространство, увеличивается. Равновесие восстанавливается за счет возрастания давления пара, которое ведет к увеличению его плотности и, следовательно, количества молекул, в единицу времени конденсирующихся на поверхности воды. Отсюда следует, что давление насыщенного пара является монотонно возрастающей функцией его температуры, или, что то же самое, температура насыщенного пара есть монотонно возрастающая функция его давления.
При увеличении объема над поверхностью жидкости, имеющей температуру насыщения, некоторое количество жидкости переходит в пар, при уменьшении объема «излишний» пар снова переходит в жидкость, но в обоих случаях давление пара остается постоянным.
Насыщенный пар, в котором отсутствуют взвешенные частицы, жидкой фазы, называется с у х и м н а с ы щ е н н ы м паром. Его удельный объем и температура являются функциями давления. Поэтому состояние сухого пара можно задать любым из параметров — давлением, удельным объемом или температурой.
Двухфазная смесь, представляющая собой пар со взвешенными в нем капельками жидкости, называется влажным насыщенным паром. Массовая доля сухого насыщенного пара во влажном называется степенью сухости пара и обозначается буквой х. Массовая доля кипящей воды во влажном паре, равная 1—х, называется степенью влажности. Для кипящей жидкости х = 0, а для сухого насыщенного пара х = 1. Состояние влажного пара характеризуется двумя параметрами: давлением (или температурой насыщения ts, определяющей это давление) и степенью сухости пара.
При сообщении сухому пару теплоты при том же давлении его температура будет увеличиваться, пар будет перегреваться. Точка а изображает состояние перегретого пара и в зависимости от температуры пара может лежать на разных расстояниях от точки а". Таким образом, перегретым называется пар, температура которого превышает температуру насыщенного пара того же давления.
Так как удельный объем перегретого пара при том же давлении больше, чем насыщенного, то в единице объема перегретого пара содержится меньшее количество молекул, значит, он обладает меньшей плотностью. Состояние перегретого пара, как и любого газа, определяется двумя любыми независимыми параметрами.
Если рассмотреть процесс парообразования при более высоком давлении, то можно заметить следующие изменения. Точка а0, соответствующая состоянию 1 кг воды при 0 °С и новом давлении, остается почти на той же вертикали, так как вода практически несжимаема. Точка а' смещается вправо, ибо с ростом давления увеличивается температура кипения, а жидкость при повышении температуры расширяется. Что же касается пара (точка а"), то, несмотря на увеличение температуры кипения, удельный объем пара все-таки падает из-за более сильного влияния растущего давления.
Поскольку удельный объем жидкости растет, а пара падает, то при постоянном увеличении давления мы достигнем такой точки, в которой удельные объемы жидкости и пара сравняются. Эта точка называется к р и
т и ч е с к о й. В критической точке различия между жидкостью и паром исчезают. Для воды параметры критической точки К составляют:
ркр = 221,29 105 Па; tкр = 374,15 °С; vкр = = 0,00326 м3/кг.
Критическая температура — это максимально возможная температура сосуществования двух фаз: жидкости и насыщенного пара. При температурах, больших критической, возможно существование только одной фазы. Название этой фазы (жидкость или перегретый пар) в какой-то степени условно и определяется обычно ее температурой. Все газы являются сильно перегретыми сверх Tкр парами. Чем выше температура перегрева (при данном давлении), тем ближе пар по своим свойствам к идеальному газу.
Наименьшим давлением, при котором еще возможно равновесие воды и насыщенного пара, является давление, соответствующее т р о й н о й
т о ч к е. Под последней понимается то единственное состояние, в котором могут одновременно находиться в равновесии пар, вода и лед (точка А' на рис. 4.6). Параметры тройной точки для воды: р0 = 611 Па; tо = 0,01 °С; v0 = 0,00100 м3/кг. Процесс парообразования, происходящий при абсолютном давлении р0 = 611 Па, показан на диаграмме изобарой А'А", которая практически совпадает с осью абсцисс. При более низких давлениях пар может сосуществовать лишь в равновесии со льдом. Процесс образования пара непосредственно из льда называется сублимацией.
Если теперь соединить одноименные точки плавными кривыми, то получим нулевую изотерму 1, каждая точка которой соответствует состоянию 1 кг воды при О °С и давлении р, нижнюю пограничную к р и
в у ю 11, представляющую зависимость от давления удельного объема жидкости при температуре кипения, и верхнюю пограничную кривую 111, дающую зависимость удельного объема сухого насыщенного пара от давления.
Все точки горизонталей между кривыми 11 и 111 соответствуют состояниям влажного насыщенного пара, точки кривой 11 определяют состояние кипящей воды, точки кривой 111 — состояния сухого насыщенного пара. Влево от кривой 11 до нулевой изотермы лежит область, некипящей однофазной жидкости, вправо от кривой 111 — область перегретого пара. Таким образом, кривые 11 и 111 определяют область насыщенного пара, отделяя ее от области воды и перегретого пара, и поэтому называются пограничными. Выше точки К, где пограничных кривых нет, находится область однофазных состояний, в которой нельзя провести четкой границы между жидкостью и паром.
Определение параметров воды и пара. Термодинамические параметры кипящей воды и сухого насыщенного пара берутся из таблиц теплофизических свойств воды и водяного пара. В этих таблицах термодинамические величины со штрихом относятся к воде, нагретой до температуры кипения, а величины с двумя штрихами — к сухому насыщенному пару.
Поскольку для изобарного процесса в соответствии с (2.29) подведенная к жидкости теплота q =h2 — h1, то, применив это соотношение к процессу а'а", получим
q = r = h11 – h1 (4.28)
Величина r называется т е п л о т о й п а р о о б р а з о в а н и я и определяет количество теплоты, необходимое для превращения одного килограмма воды в сухой насыщенный пар той же температуры.
Приращение энтропии в процессе парообразования определяется формулой
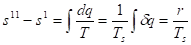
За нулевое состояние, от которого отсчитываются величины s', s", принято состояние воды в тройной точке. Так как состояние кипящей воды и сухого насыщенного пара определяется только одним параметром, то по известному давлению или температуре из таблиц воды и водяного пара берутся значения v', v", h', h", s', s", r.
Удельный объем vx, энтропия sx и энтальпия hx влажного насыщенного пара определяются по правилу аддитивности. Поскольку в 1 кг влажного пара содержится х кг сухого и (1 — х) кг кипящей воды, то
vx = xv11 + (1 – x)v1 = v11 + x (v11 – v1) (4.29)
Аналогично
sx = s1 + x (s11 – s1) = s1 + xr/Ts (4.30)
hx = h1 + x(h11 – h1) = h1 + xr (4.31)
Непосредственно из таблиц взять параметры влажного пара нельзя. Их определяют по приведенным выше формулам по заданному давлению (или температуре) и степени сухости.
Однофазные состояния некипящей воды и перегретого пара задаются двумя параметрами. По заданным давлению и температуре из таблиц воды и перегретого пара находят значения v, h, s.
Т, s-диаграмма водяного пара. Для исследования различных процессов с водяным паром кроме таблиц используется Т, s-диаграмма (рис. 4.7). Она строится путем переноса числовых данных таблиц водяного пара в
Т, s-координаты.
Состояние воды в тройной точке (s0 = 0; T0 = 273,16К) изображается в диаграмме точкой А'. Откладывая на диаграмме для разных температур значения s1 и s11, получим нижнюю и верхнюю пограничные кривые. Влево от нижней пограничной кривой располагается область жидкости, между пограничными кривыми — двухфазная область влажного насыщенного пара, вправо и вверх от верхней пограничной кривой — область перегретого пара.
На диаграмму наносят изобары, изохоры и линии постоянной степени сухости, для чего каждую изобару а'а" делят на одинаковое число частей и соединяют соответствующие точки линиями x = const. Область диаграммы, лежащая ниже нулевой изотермы, отвечает различным состояниям смеси пар+лед.
h, s - диаграмма водяного пара. Если за независимые параметры, определяющие состояние рабочего тела, принять энтропию s и энтальпию h, то каждое состояние можно изобразить точкой на h, s-диаграмме.
На рис. 4.8 изображена h, s-диаграмма для водяного пара, которая строится путем переноса числовых данных таблиц водяного пара в h, s-координаты.
За начало координат принято состояние воды в тройной точке. Откладывая на диаграмме для различных давлений значения s' и h' для воды при температуре кипения, а также s" и h" для сухого насыщенного пара, получаем нижнюю и верхнюю пограничные кривые.
Изобары в двухфазной области влажного пара представляют собой пучок расходящихся прямых. Действительно,
В процессе p = const
ds = δqp/T = dh/T,
или (ðh/ðs)p=T, т.е. тангенс угла наклона изобары в h, s-координатах численно равен абсолютной температуре данного состояния. Так как в области насыщения изобара совпадает с изотермой, тангенс угла наклона постоянен и изобара является прямой. Чем выше давление насыщения, тем выше температура, тем больше тангенс угла наклона изобары, поэтому в области насыщения прямые р = const расходятся. Чем больше давление, тем выше лежит изобара. Критическая точка К. лежит не на вершине, как это было в
р, v- и Т, s-диаграммах, а на левом склоне пограничной кривой.
В области перегрева температура пара (при постоянном давлении) растет с увеличением s примерно по логарифмической кривой и крутизна изобары увеличивается. Аналогичный характер имеют изобары и в области воды, но они идут так близко от пограничной кривой, что практически сливаются с ней. При низких давлениях и относительно высоких температурах перегретый пар по своим свойствам близок к идеальному газу. Так как в изотермическом процессе энтальпия идеального газа не изменяется, изотермы сильно перегретого пара идут горизонтально. При приближении к области насыщения, т.е. к верхней пограничной кривой, свойства перегретого пара значительно отклоняются от свойств идеального газа и изотермы искривляются.
В h, s-диаграмме водяного пара нанесены также линии v = const, идущие круче изобар.
Обычно всю диаграмму не выполняют, а строят только ее верхнюю часть, наиболее употребительную в практике расчетов. Это дает возможность изображать ее в более крупном масштабе.
Для любой точки на этой диаграмме можно найти р, v , t , h s, x. Большое достоинство диаграммы состоит в том, что количество теплоты в изобарном процессе равно разности ординат конечной и начальной точек процесса и изображается отрезком вертикальной прямой, а не площадью как в Т, s-диаграмме, поэтому h, s-диаграмма исключительно широко используется при проведении тепловых расчетов.
Основные термодинамические процессы водяного пара. Для анализа работы паросиловых установок, существенное значение имеют изохорный, изобарный, изотермический и адиабатный процессы. Расчет этих процессов можно выполнить либо с помощью таблицы воды и водяного пара, либо с помощью h, s-диаграммы. Первый способ более точен, но второй более прост и нагляден.
Общий метод расчета по h, s-диаграмме состоит в следующем. По известным параметрам наносится начальное состояние рабочего тела, затем проводится линия процесса и определяются его параметры в конечном состоянии. Далее вычисляется изменение внутренней энергии, определяются количества теплоты и работы в заданном процессе.
Изохорный процесс (рис. 4.9). Из диаграммы на рисунке видно, что нагреванием при постоянном объеме влажный пар можно перевести в сухой насыщенный и перегретый. Охлаждением его можно сконденсировать, но не до конца, так как при каком угодно низком давлении над жидкостью всегда находится некоторое количество насыщенного пара. Это означает, что изохора не пересекает нижнюю пограничную кривую.
Изменение внутренней энергии водяного пара при v = const
Δu = u2 – u1 = (h2 – p2v2) – (h1 – p1v1) (4.32)
Данная формула справедлива и для всех без исключения остальных термодинамических процессов.
В изохорном процессе работа l = 0, поэтому подведенная теплота расходуется (в соответствии с первым законом термодинамики) на увеличение внутренней энергии пара:
q = u2 — u1 (4.33)
Изобарный процесс (рис. 4.10). При подводе теплоты к влажному насыщенному пару его степень сухости увеличивается и он (при постоянной температуре) переходит в сухой, а при дальнейшем подводе теплоты — в перегретый пар (температура пара при этом растет). При отводе теплоты влажный пар конденсируется при Ts = const.
Полученная в процессе теплота равна разности энтальпий:
q = h2 – h1 (4.34)
Работа процесса подсчитывается по формуле
l = p(v2 – v1) (4.35)
Изотермический процесс (рис. 4.11). Внутренняя энергия водяного пара в процессе Т = const не остается постоянной (как у идеального газа), так как изменяется ее потенциальная составляющая. Величин Δu находится по формуле (4.32).
Количество полученной в изотермическом процессе теплоты равно
q = T(s2 - s1) (4.36)
Работа расширения определяется из первого закона термодинамики:
l = q – Δu (4.37)
Адиабатный процесс (рис. 4.12). При адиабатном расширении давление и температура пара уменьшаются и перегретый пар становится сначала сухим, а затем влажным. Работа адиабатного процесса определяется выражением
l = – Δu = u1 – u2 = (h1 – p1v1) – (h2 – p2v2) (4.38)
4.3. СМЕСИ ИДЕАЛЬНЫХ ГАЗОВ
Все зависимости, полученные выше для идеальных газов, справедливы и для их смесей, если в них подставлять газовую постоянную, молекулярную массу и теплоемкость смеси.
Закон Дальтона. В инженерной практике часто приходится иметь дело с газообразными веществами, близкими по свойствам к идеальным газам и представляющими собой механическую смесь отдельных компонентов различных газов, химически не реагирующих между собой. Это так называемые газовые смеси. В качестве примера можно назвать продукты сгорания топлива в двигателях внутреннего сгорания, топках печей и паровых котлов, влажный воздух в сушильных установках и т. п.
Основным законом, определяющим поведение газовой смеси, является закон Дальтона: полное давление смеси идеальных газов равно сумме парциальных давлений всех входящих в нее компонентов:

 p =
p =  (4.39)
(4.39)
П а р ц и а л ь н о е д а в л е н и е рi — давление, которое имел бы газ, если бы он один при той же температуре занимал весь объем смеси.
Способы задания смеси. Состав газовой смеси может быть задан массовыми, объемными или мольными долями.
М а с с о в о й д о л е й называется отношение массы отдельного компонента Mi к массе смеси M
gi = Mi / M (4.40)
Очевидно, что M =  Mi и
Mi и  gi = 1
gi = 1
Массовые доли часто задаются в процентах. Например, для сухого воздуха gn2  77%; go2
77%; go2  23%.
23%.
О б ъ е м н а я д о л я представляет собой отношение приведенного объема газа Vi к полному объему смеси V:
ri = Vi / V (4.41)
П р и в е д е н н ы м называется объем, который занимал бы компонент газа, если бы его давление и температура равнялись давлению и температуре смеси.
Для вычисления приведенного объема запишем два уравнения состояния
i - го компонента:
pV = MiRiT; (4.42)
pVi = MiRiT. (4.43)
Первое уравнение относится к состоянию компонента газа в смеси, когда он имеет парциальное давление рi и занимает полный объем смеси, а второе уравнение — к приведенному состоянию, когда давление и температура компонента равны, как и для смеси, р и Т. Из уравнений следует, что
V—Vpi / p. (4.44)
Просуммировав соотношение (4.44) для всех компонентов смеси, получим
с учетом закона Дальтона  Vi = V , откуда
Vi = V , откуда  ri = 1. Объемные доли также
ri = 1. Объемные доли также
часто задаются в процентах. Для воздуха ro2 = 21%, rN2 = 79%.
Иногда бывает удобнее задать состав смеси мольными долями. Мольной долей называется отношение количества молей Ni : рассматриваемого компонента к общему количеству молей смеси N.
Пусть газовая смесь состоит из N1 молей первого компонента, N2 молей второго компонента и т. д. Число молей смеcи N = Ni , а мольная доля компонента будет равна Ni /N.
Ni , а мольная доля компонента будет равна Ni /N.
В соответствии с законом Авогадро объемы моля любого газа при одинаковых р и Т, в частности при температуре и давлении смеси, в идеально газовом состоянии одинаковы. Поэтому приведенный объем любого компонента может быть вычислен как произведение объема моля Vμ на число молей этого компонента, т. е.
Vi = Vμ Ni.
а объем смеси — по формуле
V = Vμ N.
Тогда
Vi /V = ri = Ni /N,
и, следовательно, задание смеси идеальных газов мольными долями равнозначно заданию ее объемными долями.
Газовая постоянная смеси газов. Просуммировав уравнения (4.42) для всех компонентов смеси, получим
V  pi =
pi =  gi M Ri T.
gi M Ri T.
Учитывая (4.39), можно записать
pV = M RсмТ, (4.45)
где
Rсм =  gi Ri (4.46)
gi Ri (4.46)
Из уравнения (4.45) следует, что смесь идеальных газов также подчиняется уравнению Клапейрона.
Поскольку в соответствии с (1.6) Ri = 8314, то из (4.46) следует, что газовая постоянная смеси [Дж/(кг К)] имеет вид
Rсм = 8314 gi /μi (4.47)
gi /μi (4.47)
Кажущаяся молекулярная масса смеси.
Выразим формально газовую постоянную смеси Rсм по формуле (1.6), введя кажущуюся молекулярную массу смеси μсм:
Rсм = 8314 / μсм. (4.48)
Сравнивая правые части соотношений (4.47) и (4.48), найдем
μсм =  (4.49)
(4.49)
Из определения массовых долей следует, что
gi = Mi / M = μiNi /(μсмN) = μiri / μсм .
Просуммировав это соотношение для всех компонентов и учитывая,
что  = 1, получим выражение для кажущейся молекулярной массы смеси, заданной объемными долями:
= 1, получим выражение для кажущейся молекулярной массы смеси, заданной объемными долями:
μсм =  (4.50)
(4.50)
Соотношение между объемными и массовыми долями. Учитывая (4.50), получаем
gi = μiri / (4.51)
(4.51)
Поскольку ri = V1 /V = N1 /N = Ni /  , то
, то
ri = 
Разделив числитель и знаменатель этой формулы на массу смеси M, получим
ri =  (4.52)
(4.52)
Теплоемкость смесей идеальных газов. Если смесь газов задана массовыми долями, то ее массовая теплоемкость с определяется как сумма произведений массовых долей на массовую теплоемкость каждого компонента, т. е.
Cv =  ; cp =
; cp =  . (4.53)
. (4.53)
При задании смеси объемными долями объемная теплоемкость смеси
c'v =  ; cp1 =
; cp1 =  . (4.54)
. (4.54)
Аналогично мольная теплоемкость смеси равна произведению объемных долей на мольные теплоемкости составляющих смесь газов:
μcv =  ; μcp =
; μcp =  ; (4.55)
; (4.55)
4.4. ВЛАЖНЫЙ ВОЗДУХ
В сушильной технике в качестве рабочего тела широко используют влажный воздух, представляющий собой смесь сухого воздуха и водяного пара.
Содержание водяного пара в атмосферном воздухе зависит от метеорологических условий, а также от наличия источников испарения воды и колеблется в широких пределах: от малых долей до 4 % (по массе). Смесь сухого воздуха и насыщенного водяного пара называется н а с ы щ е н н ы м в л а ж н ы м в о з д у х о м. Смесь сухого воздуха и перегретого водяного пара называется н е н а с ы щ е н н ы м в л а ж н ы м в о з д у х о м. Температура, до которой необходимо охлаждать ненасыщенный влажный воздух, чтобы содержащийся в нем перегретый пар стал насыщенным, называется температурой точки росы. При дальнейшем охлаждении влажного воздуха (ниже температуры точки росы) происходит конденсация водяного пара. Поэтому температуру точки росы часто используют как меру содержания в воздухе воды в парообразном состоянии.
Обычно к влажному воздуху применяют уравнения для идеальных газовых смесей. Так как в процессах сушки количество водяного пара в воздухе может меняться, а количество сухого воздуха остается постоянным, то целесообразно относить все величины к 1 кг сухого воздуха (а не смеси).
Влагосодержание, абсолютная и относительная влажность. Масса пара в 1 м3 влажного воздуха, численно равная плотности пара ρп при парциальном давлении рп, называется а б с о л ю т н о й в л а ж н о с т ь ю. Отношение действительной абсолютной влажности воздуха ρп к максимально возможной абсолютной влажности ρs при той же температуре называют относительной влажностью и обозначают через φ:
φ = ρп / ρs = pп/ ps (4.56)
где рп — парциальное давление водяного пара во влажном воздухе; ps — максимально возможное парциальное давление водяного пара при данной температуре.
Величина φ выражается в процентах или относительных единицах.
Поскольку 0 ≤ рп ≤ рs, то 0 ≤ φ ≤ 100% (или соответственно ( 0 ≤ φ ≤ 1 ). Для сухого воздуха φ = 0, для насыщенного φ = 100 %.
Относительная влажность сама по себе полностью не характеризует содержание пара во влажном воздухе, нужно еще знать температуру влажного воздуха, однозначно определяющую величину рs.
Отношение массы водяного пара Мп, содержашегося во влажном воздухе, к массе сухого воздуха Мв называется в л а г о с о д е р ж а н и е м в о з д у х а и измеряется в килограммах на килограмм:
d = Mп/Мв (4.57)
Определяя массы сухого воздуха и водяного пара из уравнения состояния идеального газа, преобразуем выражение (4.57) к виду
 :
:  =
=  =
= 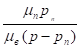
Если рп = φрs; μп = 18,06 кг/кмоль и μв = 28,95 кг/кмоль, то
d =  (4.58)
(4.58)
Максимально возможное влагосодержание достигается при полном насыщении воздуха водяными парами (φ = 1):
d макс = 0,622  (4.59)
(4.59)
Если давление насыщенного пара становится равным внешнему давлению р, что достигается при температуре кипения, то d = ∞.
Теплоемкость и энтальпия влажного воздуха. Изобарную теплоемкость влажного воздуха сp, обычно относят к 1 кг сухого воздуха, т. е. к (1 + d) кг влажного воздуха. Она равна сумме теплоемкостей 1 кг сухого воздуха и d кг пара:
cp = cрв + dcрп (4.60)
В приближенных термодинамических расчетах процессов с влажным воздухом в небольшом диапазоне температур можно применять удельную изобарную теплоемкость сухого воздуха срв= 1 кДж/(кг К) =const, удельную изобарную теплоемкость водяного пара срв  2 кДж/(кг К) = const. В этом случае, выражая теплоемкость в кДж/(кг К), получаем
2 кДж/(кг К) = const. В этом случае, выражая теплоемкость в кДж/(кг К), получаем
cp = l + 2d. (4.61)
Энтальпия влажного воздуха определяется как энтальпия газовой смеси, состоящей из 1 кг сухого воздуха и d кг водяного пара, т. е.
h = hв + d х hп (4.62)
В лекции "16 Санитарные требования к инвентарю и посуде" также много полезной информации.
Энтальпия 1 кг сухого воздуха, кДж/кг,
hв = срв t = 1 t (4.63)
Энтальпия 1 кг пара, кДж/кг, достаточно точно может быть вычислена по формуле, в которой теплота испарения воды при 0°С принята равной 2500 кДж/кг, а теплоемкость пара 2 кДж/(кг К):
hп = 2500 + 2t (4.64)
Тогда
h = t + (2500 + 2t)d (4.65)





















