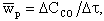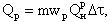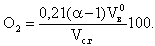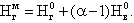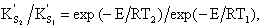Основы организации топочных процессов и материальные балансы процессов горения
| 4. Основы организации топочных процессов и материаль |
| ные балансы процессов горения |
4.1. Основы кинетики химических реакций
Процесс горения характеризуется быстрым протеканием реакций окисления горючих компонентов топлива кислородом воздуха, при котором имеет место значительное тепловыделение и создается высокий уровень температуры. Реакции с выделением теплоты называются экзотермическими. Преимущественное тепловыделение при горении топлив определяется содержанием в топливе углерода. Горение углерода в основном характеризуется протеканием трех химических реакций:
полное окисление углерода кислородом с образованием диоксида углерода
| С + О2 = СО2 + 409,1, МДж/моль; | 4.1 |
частичное окисление с выходом монооксида углерода
| 2С + О2 = 2СО + 2·123,3 МДж/моль; | Рекомендуемые материалыFREE Маран Программная инженерия Техническое задание -34% ЛЮБАЯ практика в Синергии! -17% Помощь в написании ВКР под ключ 4.2 |
доокисление монооксида до диоксида в объеме около поверхности горения
| 2СО + О2 = 2СО2 + 2·285,8 МДж/моль. | 4.3 |
Реакции по уравнениям (4.1) и (4.2) являются гетерогенными, так как в реакции участвуют горючее и окислитель, находящиеся в разном фазовом состоянии: твердое горючее и газообразный окислитель-кислород. Реакция по уравнению (4.3) относится к гомогенной, так как здесь оба вещества, вступающие в реакцию, являются газообразными (возможны гомогенные реакции веществ в жидком состоянии).
В условиях высоких температур в ядре факела могут протекать реакции с поглощением теплоты, которые являются эндотермическими. К эндотермическим реакциям, например, относится реакция образования оксидов азота
| N2 + О2 = 2NO - 180 кДж/моль, | 4.4 |
или восстановление диоксида углерода на раскаленной поверхности углерода при недостатке кислорода
| С + СО2 = 2СО - 162,5 МДж/моль. | 4.5 |
Реакция является химически обратимой, если может идти как в прямом, так и в обратном направлении, однако внешние условия для протекания реакции в том или другом направлении могут существенно различаться. Так, реакция образования оксидов азота имеет место только в зоне высоких температур, а обратная реакция их разложения на газообразные кислород и азот протекает в земной атмосфере под действием солнечной радиации. При горении топлива в топочных камерах скорость прямого процесса окисления горючих кислородом несоизмеримо больше скорости обратного, поэтому химическое равновесие этих реакций смещено в сторону образования конечных продуктов, и в указанных условиях эти реакции можно считать необратимыми.
Однако всегда по мере роста концентрации продуктов в реакции и температуры в зоне горения находится в равновесии с конечными продуктами какое-то количество исходных веществ. Этот процесс связан с термической диссоциацией части образовавшихся продуктов сгорания. В топочных камерах при температуре горения выше 1600 °С подвергаются термической диссоциации в заметном количестве диоксид углерода СО2 и водяные пары Н2О
|
| |
|
| 4.6 |
Таким образом, в зоне высоких температур горения всегда останется небольшое количество СО, Н2 и O2, догорание которых возможно при более низких температурах.
Интенсивность горения характеризуется скоростью реакции. Под скоростью гомогенной реакции понимается массовое количество вещества, реагирующее в единице объема и в единицу времени. Скорость реакции в этом случае измеряется по изменению концентрации одного из реагирующих веществ. Например, в реакции (4.3) средняя скорость реакции wр, моль/(м3·с), за промежуток времени Δτ, с, имеет выражение
|
| 4.7 |
где ΔCCO - изменение концентрации СО в объеме, моль/м3.
Скорость гетерогенных реакций (4.1) и (4.2) КS, г/(м2·с), выражается количеством углерода Δg, г, прореагировавшим с кислородом на единице поверхности контакта S, м2, в единицу времени Δτ, с:
|
| 4.8 |
Скорости реакций подчиняются закону действующих масс, согласно которому в однородной среде при постоянной температуре в каждый момент времени скорость реакции пропорциональна произведению концентраций реагирующих веществ с учетом числа молей. Так, для уравнения (4.3) скорость реакции составит
|
| 4.9 |
Здесь kР - константа скорости реакции, зависящая от температуры и химической природы реагирующих веществ.
В условиях гетерогенного горения концентрация горючего (твердого топлива) неизменна, поэтому скорость такой реакции на основе закона действующих масс будет зависеть только от концентрации окислителя (кислорода) у поверхности топлива
|
| 4.10 |
Здесь CПОВO2- концентрация кислорода у поверхности топлива. При неизменной концентрации реагирующих веществ во времени (постоянный подвод топлива и окислителя в зону горения) скорость реакции зависит от константы скорости реакции kР, 1/с, по закону Аррениуса
|
| 4.11 |
где k0 - предэкспоненциальный множитель, 1/с; Е - энергия активации, кДж/моль; R - универсальная газовая постоянная, кДж/(моль·К); Т - абсолютная температура процесса, К. Константа скорости реакции kр и энергия активации Е называются кинетическими константами реакции, которые определяют реакционные свойства топлива.
Химическая реакция может происходить при столкновении молекул, вступающих в реакцию веществ. Если бы все столкновения приводили к реакциям, то горение происходило бы с огромной скоростью и константа скорости равнялась бы k0. В действительности реакция может произойти только в том случае, когда за счет соударения произойдет разрушение старых молекулярных связей и образовавшиеся осколки молекул (заряженные радикалы) смогут перегруппироваться и создать молекулы новых веществ.
Энергия, достаточная для разрушения внутримолекулярных связей исходных веществ, называется энергией активации E. Так, при горении кокса по реакции (4.1) энергия активации зависит от вида кокса: для кокса бурого угля Е = 92…105 МДж/моль, для кокса каменных углей Е = 117…134 МДж/моль, для антрацита Е = 147 МДж/моль. В результате число молекул NE ,обладающих необходимым уровнем энергии Е, определяется статистическим законом Максвелла-Больцмана
|
| 4.12 |
где N0 - полное число молекул в единице объема. Энергия активации зависит не только от энергии межатомных связей в молекулах, но и от того, в каком состоянии находятся вступающие в реакцию вещества. При высоких температурах в зоне реакции за счет диссоциации молекул с более слабыми внутренними связями накапливается определенное количество заряженных частиц (радикалов) типа ОН-, Н+, О2-, которые легко вступают в промежуточные реакции с исходными молекулами (такие реакции имеют низкие значения Е) и способствуют ускорению реакций горения.
На рис. 4.1 показана зависимость константы скорости kР и скорости реакции wР от определяющих факторов. Рост скорости химической реакции с температурой на известном уровне тормозится аэродинамическим фактором - возможностью доставки в зону горения окислителя (кислорода), определяемым скоростью диффузионного массообмена kД, который слабо зависит от температуры (рис. 4.1, а). Повышение энергии активации требует больше энергетических затрат на каждый акт реакции, что ведет к торможению скорости (рис. 4.1, б).

Рис. 4.1. Кинетические характеристики процесса горения: а - зависимость константы реакции горения kр и диффузионного массообмена kд от температуры; б - изменение скорости реакции wр от энергии активации Е; в - изменение скорости реакции при повышении концентрации горючего вещества Сгор в смеси с воздухом; НП, ВП - нижний и верхний пределы концентрации, соответствующие горению
В топочных устройствах происходит постоянная подача топлива и окислителя в зону горения, и, следовательно, в ядре горения сохраняется практически постоянная концентрация реагирующих веществ во времени. В этих условиях максимальная скорость реакции может быть достигнута при соотношении концентраций исходных веществ, близком к стехиометрическому, когда в результате реакции не остается избытка любого из них (рис. 4.1, в). При избытке горючего (богатая смесь) или при малой его концентрации (бедная смесь) скорость реакции снижается из-за уменьшения тепловыделения на единицу объема. Как видно, существует нижний предел концентрации горючего (НП), ниже которого горение становится невозможным, и верхний предел (ВП), когда дальнейшее увеличение концентрации горючего в смеси также прекращает горение. Во всем диапазоне концентраций между этими пределами горение возможно.
При сгорании горючей смеси в замкнутом объеме и отсутствии отвода теплоты в процессе реакции тепловыделение передается продуктам сгорания и приводит к максимальному повышению их температуры.
Этим условиям отвечает понятие теоретической (адиабатной) температуры горения ТТЕОР =Та. Наивысшее ее значение достигается при подводе окислителя в строгом соответствии с химической формулой (при стехиометрическом соотношении горючего и окислителя). Эту температуру часто называют жаропроизводительностью топлива.
В топочных устройствах всегда имеет место отвод теплоты из зоны реакции к поверхностям нагрева. С повышением температуры в зоне основного горения увеличивается и отвод теплоты, далее по мере выгорания топлива тепловыделение снижается, а вместе с ним происходит спад температуры продуктов сгорания, так как теплоотвод сохраняется достаточно высоким (рис. 4.2).
|
| Рис. 4.2. Изменение температуры газов по высоте топки hт: hгор - высота расположения горелок |
Температура смеси, начиная с которой система способна к самоускорению реакции до устойчивого горения, называется температурой воспламенения. Эта температура не является постоянной для реагирующих веществ и зависит от условий отвода теплоты из зоны реакции. Тепловыделение в ходе реакции горения топлива (при постоянной концентрации реагирующих веществ) определяется скоростью реакции в данных условиях и теплотой горения топлива
|
| 4.13 |
где mwР - скорость реакции по сгорающему топливу, кг/(м3·с); QРН -теплота горения топлива, кДж/кг.
Из (4.13) следует, что тепловыделение QР определяется только изменением скорости реакции wР. Скорость реакции, в свою очередь, зависит от константы диффузионного массообмена kД и константы химической реакции kР на поверхности топлива. При этом в области низких температур скорость реакции wР ограничивается константой kР, а в области высоких температур условиями массообмена у поверхности топлива константой kД. В итоге на графике кривая wР = f(T) имеет два перегиба (см. рис. 4.3).
Теплоотвод из зоны реакции в окружающую среду (к тепловоспринимающим поверхностям) выражается формулой
|
| 4.14 |
где α - коэффициент теплоотдачи, кВт/(м2·К); FСТ - тепловоспринимающая поверхность, м2; ТР, TСТ - температуры в зоне реакции и у поверхности стен, К.
|
| Рис.4.3. Графическое определение температуры воспламенения ТВ, горения ТГ при разной интенсивности теплоотвода к стенам топки (Q02 > Q01): QР - тепловыделение в результате реакции горения; ТСТ - температура стен (экранов) топки. Из (4.14) следует, что при постоянстве условий отвода теплоты из зоны реакции (α = const) теплоотвод изменяется линейно в зависимости от разности температур TР - ТСТ. |
На рис.4.3 показан характер изменения значений QР и Q0 от температуры. Точка 1 касания кривой QР и линии теплоотвода Q0 соответствует температуре воспламенения ТВ, так как при любом отклонении от нее значение QР> Q0 и происходит саморазогрев горючей смеси и рост тепловыделения за счет реакций окисления. Точка пересечения 3 кривой QР и линии Q0 характеризует наивысшее устойчивое тепловыделение, а соответствующая температура - температура горения ТГ3. Как видно на рис. 4.3, чем интенсивнее теплоотвод из зоны горения (круче наклон линии отвода 2-4, выше ТСТ2, так как α2 > α1), тем выше температура воспламенения топлива ТВ2 и ниже температура горения ТГ4.
4.2.1. Горение газового топлива
Ранее были изложены основные законы кинетики (законы действующих масс и Аррениуса), позволяющие определять скорость химических реакций на основе стехиометрических соотношений молекул исходных и конечных продуктов. Экспериментально установлено, что скорости протекания реакций существенно превышают расчетные значения, полученные с применением закона действующих масс и закона Аррениуса.
В действительности реакции в веществах, находящихся в парогазовом состоянии, протекают чаще не между исходными молекулами горючего и окислителя, а через ряд промежуточных стадий, в которых вместе с молекулами участвуют активные осколки молекул - радикалы и атомы, имеющие свободные связи Н, ОН, О, СН и др. При этом переход от исходных веществ к конечным продуктам происходит через ряд промежуточных реакций, протекающих с большой скоростью, так как они обладают низкой энергией активации. Такие реакции, отличительной особенностью которых является огромная скорость их протекания, получили название цепных.
При горении газов протекают разветвленные реакции, в процессе которых один активный центр порождает два или большее число новых активных центров. Теорию цепных реакций разработал академик Н.Н. Семенов.
Согласно этой теории, цепная разветвленная реакция включает следующие процессы: зарождение цепей - образование активных частиц из исходного продукта; разветвление цепей - процесс, при котором одна активная частица, реагируя с исходными, вызывает образование двух или нескольких новых активных частиц; по мере убывания горючих компонентов реакция замедляется, наступает обрыв цепей и реакция вырождается - горение прекращается.
Началу реакции между веществами предшествует период накопления активных центров в виде заряженных частиц за счет разрушения части исходных молекул другими, обладающими большими энергиями движения и более высокой энергией связи атомов в молекуле. Этот период называют периодом индукции. При высокой температуре вступающих в реакцию веществ период индукции занимает от долей секунды до 1…2 с.
Рассмотрим механизм цепной разветвленной реакции на примере горения водорода (рис. 4.4). Из цикла цепной реакции следует, что наряду с образованием конечного продукта Н2О увеличивается число активных частиц - возбудителей цепи Н. На один вступивший в реакцию активный атом водорода после первого цикла образуется три атома водорода, после второго цикла - 9, после третьего - 27 и т.д. Это приводит к дальнейшему лавинообразному ускорению реакции. В реальных процессах одновременно с лавинообразным ускорением образования активных центров часть их по ряду причин при контакте со стенками сосуда, друг с другом теряет активность, что ведет к постепенному снижению скорости нарастания реакции и переходу ее в установившееся состояние, если имеет место постоянный подвод кислорода и водорода в зону реакции.
Горение газового топлива в смеси с воздухом происходит с большой скоростью (готовая смесь метана с воздухом объемом 10 м3 сгорает за 0,1 с).
|
| Рис. 4.4. Цикл цепной реакции горения водорода: H - возбудитель цепной реакции; H2O - конечный продукт |
Поэтому интенсивность сжигания природного газа в топках паровых котлов определяется скоростью его смешения с воздухом в горелочном устройстве и топке, т.е. скоростью подготовки горючей смеси.
В турбулентном потоке горючей смеси метана с воздухом скорость распространения пламени uПЛ, м/с, определяется турбулентной диффузией веществ и находится по приближенной формуле
|
| 4.15 |
где wГОР - скорость воздуха на выходе из горелки, м/с; ТГ, - расчетная температура газовой среды, К; n = 0,60…1,65 - показатель степени; изменяется в зависимости от состава горючей смеси и скорости потока. Для промышленных горелок, сжигающих природный газ, значение n близко к единице; εТ = 0,25…0,30 - степень турбулентности потока воздуха. В итоге скорость распространения газового пламени обычно составляет uПЛ = 8… 12 м/с.
Трудность обеспечения полного смешения расхода газа с воздухом за короткий промежуток времени связано с большим различием объемных расходов газа и воздуха - на сжигание 1 м3 газа требуется 10 м3 воздуха. Для полноты перемешивания приходится в поток воздуха внутри горелки вводить газ большим количеством мелких струй малого диаметра и с большой скоростью. Воздушный поток также сильно турбулизуется в специальных завихривающих устройствах.
4.2.2. Горение твердого топлива
Горение твердого топлива (угольной пыли) включает два периода: тепловую подготовку и собственно горение (рис. 4.5).
|
| Рис. 4.5. Температурный режим при горении отдельной частицы твердого топлива: 1 - температура газовой среды вокруг частицы; 2 - температура частицы; 3 - воспламенение коксового остатка; 4 - завершение горения коксового остатка; I - зона термической подготовки; II - зона горения летучих веществ; III - зона прогрева коксового остатка; IV - зона горения коксового остатка |
В процессе тепловой подготовки (рис. 4.5, зона I) частица прогревается, высушивается, и при температуре выше 110 °С начинается тепловое разложение исходного вещества топлива с выделением газообразных летучих веществ. Длительность этого периода зависит главным образом от влажности топлива, размера его частиц, условий теплообмена и составляет обычно десятые доли секунды. Протекание процессов в период тепловой подготовки связано с поглощением теплоты, главным образом, на прогрев, подсушку топлива и термическое разложение сложных молекулярных соединений, поэтому нагрев частицы в это время идет замедленно.
Собственно горение начинается с воспламенения летучих веществ (рис. 4.5, зона II) при температуре 400…600 °С, а выделяющаяся в процессе их горения теплота обеспечивает ускоренный прогрев и воспламенение твердого коксового остатка. Горение летучих веществ занимает 0,2…0,5 с. При большом выходе летучих (бурые и молодые каменные угли, сланцы, торф) выделяющейся теплоты их горения достаточно для воспламенения коксовой частицы, а при малом выходе летучих возникает необходимость дополнительного прогрева коксовой частицы от окружающих раскаленных газов (зона III).
Горение кокса (рис. 4.5, зона IV) начинается при температуре около 1000 °С и является наиболее длительным процессом. Это определяется тем, что часть кислорода в зоне у поверхности частицы израсходована на сжигание горючих летучих веществ и оставшаяся концентрация его снизилась, кроме того, гетерогенные реакции всегда уступают по скорости гомогенным для однородных по химической активности веществ.
В итоге общая длительность горения твердой частицы (1,0…2,5 с) в основном определяется горением коксового остатка (около 2/3 общего времени горения). Для топлив, имеющих большой выход летучих веществ, коксовый остаток составляет менее половины начальной массы частицы, поэтому их сжигание при разных начальных размерах происходит достаточно быстро и возможность недожога снижается. Старые по возрасту топлива имеют плотную коксовую частицу, горение которой занимает почти все время пребывания в топочной камере.
Коксовый остаток большинства твердых топлив в основном, а для ряда твердых топлив целиком, состоит из углерода (от 60 до 97% массы частицы). Учитывая, что углерод обеспечивает основное тепловыделение при сжигании топлива, рассмотрим динамику горения углеродной частицы с поверхности. Кислород подводится из окружающей среды к частице углерода за счет турбулентной диффузии - турбулентного массопереноса, имеющего достаточно высокую интенсивность, однако непосредственно у поверхности частицы сохраняется тонкий газовый слой (пограничный слой), перенос окислителя через который осуществляется по законам молекулярной диффузии (рис. 4.6). Этот слой в значительной мере тормозит подвод кислорода к поверхности. В нем происходит догорание горючих газовых компонентов, выделяющихся из частицы в ходе термического разложения. Количество кислорода, подводимого в единицу времени к единице поверхности частицы посредством турбулентной диффузии, определяется по формуле
| | 4.16 | ||
|
| Рис. 4.6. Схема горения углеродной частицы: 1 - поверхность углеродной частицы; 2 - ламинарный пограничный слой; 3 - зона турбулентного потока. Такое же количество кислорода поступает через пограничный слой δ за счет молекулярной диффузии
|
В (4.16) и (4.17) СПОТ- концентрация кислорода в окружающем частицу потоке; ССЛ - то же на внешней границе пограничного слоя; СПОВ - то же на поверхности топлива; δ - толщина пограничного слоя; D - коэффициент молекулярной диффузии через пограничный слой; А - коэффициент турбулентного массообмена.
Совместное решение уравнений (4.16) и (4.17) приводит к выражению
| | 4.18a |
или
| | 4.18б |
в котором
| | 4.19 |
- обобщенная константа скорости диффузии.
Из формулы (4.18) следует, что подвод кислорода к реагирующей поверхности твердого топлива определяется константой скорости диффузии и разностью концентраций кислорода в потоке и на реагирующей поверхности.
В установившемся процессе горения количество кислорода, подводимого диффузией к поверхности реагирования, равно количеству, прореагировавшему на поверхности в результате химической реакции. Отсюда скорость реакции горения углерода с поверхности Кs находится из равенства массовых скоростей двух процессов - диффузионного подвода и расхода кислорода на поверхности в результате химической реакции
| | 4.20 |
где дополнительно β - отношение расхода углерода и кислорода в химической реакции. Так, например, в реакции C+O2 = CO2 значение β = 12/32 = 0,375.
Из уравнения (4.20) можно получить приведенную константу скорости горения КГ, учитывающую условие диффузии, т.е. константу kД, и интенсивность химической реакции - константу kР
| | 4.21 |
В соответствии с законом Аррениуса определяющим параметром скорости химической реакции является температура процесса. Константа скорости диффузии kД слабо изменяется с ростом температуры (см. рис. 4.1, а), в то время как константа скорости реакции kр имеет экспоненциальную зависимость от температуры.
При относительно невысокой температуре (800…1000°С) химическая реакция протекает медленно, несмотря на избыток кислорода около твердой поверхности, так как kД >> kР. В этом случае горение тормозится кинетикой химической реакции, поэтому эту зону температур называют областью кинетического горения.
Наоборот, при высоких температурах горения (выше 1500°С) и сжигании угольной пыли значение kР >> kД и процесс горения тормозится условиями подвода (диффузии) кислорода к поверхности частицы. Этим условиям соответствует область диффузионного горения. Создание в этой зоне температур факела дополнительных условий для перемешивания горящей смеси (увеличение значения kД ) способствует ускорению и углублению выгорания топлива.
Аналогичный эффект в части интенсификации горения достигается уменьшением размера частиц пылевидного топлива. Частицы малых размеров имеют более развитый теплообмен с окружающей средой и, таким образом, более высокое значение kД . Повышение температуры приводит к смещению процесса окисления в область диффузионного горения.
Область чисто диффузионного горения пылевидного топлива характерна для ядра факела, отличающегося наиболее высокой температурой горения, и зоны догорания, где концентрации реагирующих веществ уже малы и их взаимодействие определяется законами диффузии. Воспламенение любого топлива начинается при относительно низких температурах, в условиях достаточного количества кислорода, т.е. в кинетической области. В этой области горения определяющую роль играет скорость химической реакции, зависящая от таких факторов, как реакционная способность топлива и уровень температуры. Влияние аэродинамических факторов в этой области горения незначительно.
4.2.3. Горение жидкого топлива
Температура воспламенения жидкого топлива (нефть, мазут) выше, чем температура его кипения. Поэтому при поступлении в зону высоких температур капля мазута вначале испаряется с поверхности за счет подводимой теплоты, а затем пары топлива смешиваются с воздухом, поступающим из окружающей среды, подогреваются до температуры воспламенения и горят в газообразном состоянии. В результате на некотором расстоянии от капли rСТЕХ достигается стехиометрическое соотношение между массой горючих газов и кислорода, и здесь устанавливается фронт горения (рис. 4.7), который для случая горения капли жидкого топлива в неподвижной окружающей среде представляет сферу вокруг капли. Расстояние rСТЕХ составляет обычно 4…10 радиусов капли. От капли к фронту горения идет интенсивное движение паров испаряющегося топлива, здесь практически нет кислорода. В зоне реакции имеет место химическое равновесие между количеством топлива и окислителя, а за ней идет догорание остатков топлива и отвод продуктов сгорания. Навстречу им к зоне реакции диффундирует окислитель.
Концентрации паров топлива СТ и окислителя (кислорода) Сок резко уменьшаются в пределах зоны горения в результате интенсивной реакции окисления, а температура среды Т здесь достигает максимума. Горение паров топлива протекает по законам цепных реакций (см. § 4.2).
Организация сжигания жидкого топлива предусматривает, прежде всего, его распыление в форсунке до мельчайших капель размером не более 1,0…1,5 мм (средний размер капель 0,3…0,5 мм) с одновременным по возможности равномерным распределением их в потоке горячего воздуха на выходе из горелки.
|
| Рис. 4.7. Механизм горения капли жидкого топлива: rк - радиус капли; rз.р - радиус зоны реакции; Ст, Сок - объемная концентрация топлива (пары) и окислителя (кислород). |
В процессе смешения с воздухом и при дальнейшем движении готовой смеси капли жидкого топлива быстро прогреваются за счет теплового излучения ядра факела и конвективного теплообмена с газовоздушной средой (начальная температура капли 120…140 °С, а окружающей ее среды 300…500°С). При достижении поверхностью капли температуры испарения наиболее низкокипящих фракций жидкого топлива (для мазута 200…320°С) начинается ее испарение.
Процесс смешения с воздухом и прогрев капель топлива до начала испарения определяет первый подготовительный этап сжигания жидкого топлива (рис. 4.8), занимает τПОД = 0,2…0,6 с в зависимости от крупности размеров капель и уровня
|
| Рис. 4.8. Схема сгорания капель мазута и изменение температуры газов Т по длине факела Lф: I - зона смешения с воздухом и прогрев капель; II - кинетическая зона горения мелких капель; III - диффузионное горение крупных капель; IV - зона догорания и охлаждения продуктов сгорания; Тг.в, Тв - температура горячего воздуха и воспламенения паров мазута; Тм, Т"ф - максимальная температура горящего факела и продуктов сгорания на выходе из камеры |
температур окружающей среды. Наиболее длительным является процесс испарения капли. Исследованиями установлено, что время испарения капли прямо пропорционально квадрату ее начального диаметра τисп = f(d02). Эту зависимость называют законом Срезневского.
При сжигании распыленного в форсунках мазута τИСП = 0,3…1,0 с в зависимости от начального размера капель. Процесс нагрева паров до температуры воспламенения (на 50…70°С выше температуры испарения) и процесс горения по законам цепной разветвленной реакции при наличии окислителя (кислорода) занимают ничтожно малое время по сравнению с испарением. Горение паров топлива происходит, как правило, по мере испарения капли. В итоге полное время сжигания капель жидкого топлива составляет τГОР = τПОД + τИСП.
В условиях присутствия в готовой смеси капель разного размера первыми прогреваются, испаряются и сгорают мелкие капли, обеспечивая более ускоренный прогрев за счет роста температуры капель больших размеров. Вместе с тем сжигание паров крупных капель происходит в среде с пониженной концентрацией кислорода, содержащей много продуктов сгорания (диффузионная область горения), что приводит к затягиванию языков факела в верх топки и при ограниченности времени пребывания газов в топке ведет к возможному появлению химического недожога и сажи.
4 .3. Развитие и воспламенение топливно-воздушной струи в топочном объеме
В энергетике основным типом топок мощных паровых котлов является камерная топка. Топливновоздушная смесь поступает в нее из горелочных устройств в виде прямоточных или завихренных струй, развитие которых в топочном объеме определяет условия воспламенения и последующую интенсивность горения.
Рассмотрим вначале механизм развития прямоточной струи, втекающей в топочный объем, заполненный горячими топочными газами (рис. 4.9).
Рис. 4.9. Структура развития свободной турбулентной струи: 1 - выходная часть сопла (горелки);
2 - ядро струи; 3 - пограничный слой;
4 - распределение температур в струе;
5 - распределение концентрации горящего вещества в струе; 6 - эпюра скоростей на выходе из горелки;
7 - эпюры скоростей на основном участке; 8 - внешний угол раскрытия струи; 9 - внутренний угол раскрытия струи
 Из амбразуры горелочного устройства вытекает струя, имеющая начальные значения скорости w0, температуры T0, концентрации горючего С0. На поверхности раздела струи с топочной средой за счет поперечной составляющей пульсационных скоростей происходит проникновение части массы струи в окружающий газовый объем и захват части массы из окружающего объема в струю. В зоне смешения, называемой пограничным слоем струи, взаимодействие масс подчиняется закону сохранения количества движения
Из амбразуры горелочного устройства вытекает струя, имеющая начальные значения скорости w0, температуры T0, концентрации горючего С0. На поверхности раздела струи с топочной средой за счет поперечной составляющей пульсационных скоростей происходит проникновение части массы струи в окружающий газовый объем и захват части массы из окружающего объема в струю. В зоне смешения, называемой пограничным слоем струи, взаимодействие масс подчиняется закону сохранения количества движения
|
| 4.22 |
где M0, MГ - масса основной струи и окружающей газовой среды; w0, wГ, - скорости струи и газовой среды, причем для данного условия wГ = 0.
В связи с этим средняя скорость поступательного движения смеси в пограничном слое определяется
|
| 4.23 |
По мере приближения к внешней границе струи доля вовлеченной в движение массы МГ увеличивается, а массы M0 - уменьшается и скорость wСМ падает.
За счет турбулентного переноса масс пограничный слой расширяется и внутрь струи, в результате ее потенциальное ядро, сохраняющее начальные значения w0, T0, C0(невозмущенная часть струи), постепенно уменьшается. Внешний угол раскрытия струи составляет 12…14 °, внутренний угол расширения пограничного слоя 6°. Сечение, в котором оканчивается потенциальное ядро, является переходным, расстояние до него от устья горелки представляет собой начальный участок струи S0. За переходным сечением пограничный слой распространяется на всю струю, и параметры на оси струи также начнут изменяться по мере удаления от переходного сечения - скорость будет падать, температура расти.
Длина начального участка струи
|
| 4.24 |
где r0 - начальный радиус круглой струи или половина эквивалентного диаметра струи прямоугольной формы; аC - экспериментальный коэффициент структуры струи, учитывающий ее начальную турбулентность и неравномерность поля входных скоростей.
В турбулентном потоке при числе Re > 2∙104 коэффициент аC =0,07…0,08, откуда длина начального участка S0 = (4,2…5,0)dЭ, где dЭ - эквивалентный диаметр струи. Для прямоугольной формы амбразуры горелки эквивалентный диаметр составляет
|
| 4.25 |
где a, b - ширина и высота выходного сечения горелки.В переходном сечении в зависимости от внешнего угла раскрытия струи αВНШ- полуширина струи составит
|
| 4.26 |
что примерно в 3 раза превышает начальный радиус струи.
Прогрев поступающего топлива до температуры воспламенения происходит за счет двух источников теплоты - теплового потока излучения из ядра факела и более интенсивно - путем конвективного нагрева за счет смешения воздуха с горячими топочными газами. В связи с этим горелочные устройства должны выполняться таким образом, чтобы максимально интенсифицировать вовлечение горячих газов в свежую струю на начальном участке и тем самым ускорять воспламенение топлива. Примером такого типа устройства является вихревая горелка с кольцевой закрученной струей (рис. 4.10). Степень закручивания такой струи в горелке определяется параметром крутки, значения которого обычно составляют nГ = 2…4.
Рис. 4.10. Структура кольцевой закрученной струи на выходе из горелки: а - общий вид движения потоков;
б - распределение аксиальных скоростей; S0 - длина начального участка; Sрц - длина зоны рециркуляции газов.


Параметр крутки приближенно можно выразить в виде
| nГ ≈ 4wt / wa | 4.27 |
где wt, максимальная тангенциальная составляющая скорости потока на выходе из горелки; wa - то же аксиальная составляющая скорости.
Параметр крутки nГ может быть определен для данной горелки по ее конструктивным размерам (диаметр канала, тип, размеры, угол установки завихрителя и т.п.). С увеличением параметра nГ растет турбулентность струи, интенсивность вовлечения окружающих газов в струю и угол раскрытия струи.
В центральной (приосевой) зоне закрученной струи создается область пониженного давления, куда устремляются высокотемпературные газы из ядра горения. Создается осевая рециркуляция газов к корню струи. Длина зоны рециркуляции также зависит от степени крутки SРЦ = 1,4nГr0. Таким образом, основное отличие закрученной кольцевой струи от прямоточной состоит в повышенной турбулентности и наличии, кроме внешней, еще внутренней зоны вовлечения газов в струю, что ускоряет ее прогрев.
Воспламенение горючей смеси топлива с воздухом возможно при соблюдении двух условий: температура горючей смеси должна быть не ниже температуры воспламенения, концентрация горючего должна превышать нижний предел воспламенения. У внешней границы струи, где температура tСМ наибольшая, находится незначительное количество топлива, недостаточное для воспламенения. В центральной зоне струи температура недостаточна для воспламенения, поэтому начало горения становится возможным в довольно узкой, близкой к периферии полосе струи, где выполняются оба указанных условия.
Фронт горения отличается повышенной турбулентностью за счет резкого увеличения объема газов (благодаря росту температуры). Фронт горения будет устойчивым, если постоянно обеспечивается подвод свежих порций топлива и воздуха. Горение происходит всегда на определенном удалении от среза горелки, поскольку вблизи горелки в струе нет необходимого уровня температур. Фронт горения устанавливается в том месте, где поступательная скорость потока оказывается равной скорости распространения турбулентного пламени (см. § 4.2.1).
Начальный этап горения топлива происходит в условиях высокой концентрации горючего и окислителя и при повышенной турбулентности потока, созданной горелкой. Зону топочной камеры, в пределах которой идет интенсивное горение топлива до степени выгорания 0,85…0,90, называют зоной ядра факела, отличающейся высоким температурным уровнем и значительным тепловым излучением на окружающие экранные поверхности нагревания топлива (рис. 4.11). По своим размерам зона ядра факела занимает 1/3…1/5 объема топочной камеры. Остальную часть топки составляет зона догорания топлива и охлаждения газов.
Степень выгорания топлива в топочной камере обычно относят к длине факела lФ, которую отсчитывают по условной линии от устья горелки до оси топки по горизонтали, затем от уровня горелок до уровня середины горизонтального газохода по вертикали и далее по горизонтали до выхода из топки.
Исследования сжигания различных видов топлив показывают, что в основном (на 85…90%) сгорание твердого топлива завершается на относительной длине факела lГОР/lФ = 0,35…0,40, жидкого топлива (мазута) на длине 0,25, природного газа - на длине 0,15, что соответствует практически горизонтальной части длины факела на уровне горелки.
 Рис. 4.11. Зоны горения топлива в топочной камере: I - зона ядра факела; 2 - зона догорания топлива и охлаждения газов; 3 - условная длина факела; Нг.г - высота горизонтального газохода.
Рис. 4.11. Зоны горения топлива в топочной камере: I - зона ядра факела; 2 - зона догорания топлива и охлаждения газов; 3 - условная длина факела; Нг.г - высота горизонтального газохода.
4.4. Продукты сгорания топлива
Состав продуктов сгорания при сжигании 1 кг твердого или жидкого топлива или 1 м3 газового топлива можно записать в следующем виде
|
| 4.28 |
Здесь VВ - объем воздуха, использованного для сжигания 1 кг (м3) топлива; VCO2 , VSO2 и др. - объемы отдельных газов в продуктах сгорания, м3/кг (или м3/м3).
Под цифрой 1 в (4.28) объединены объемы продуктов полного окисления горючих элементов топлива. Объемы продуктов полного сгорания состоят из объема трехатомных сухих газов VRO2
|
| 4.29 |
и объема водяных паров VH2O в результате окисления водорода топлива. В составе VRO2 всегда VCO2>>VSO2, поскольку содержание серы в топливах мало. Под цифрой 2 в (4.28) объединены объемы азота и кислорода, представляющие собой остаток сухого воздуха после горения топлива, и водяные пары. Здесь VN2>>VO2 как кислород в значительной мере израсходован на окисление. Объем водяных паров VВП включает в себя испарившуюся влагу топлива и влажность самого воздуха. Для сильновлажных бурых углей значение VВП соизмеримо или превышает VCO2. Под цифрой 3 объединены объемы продуктов неполного окисления горючих элементов топлива, при этом VCO>VH2>VCH4 . Соотношение между объемами VCO и VH2 в среднем составляет 3:1. Наличие в продуктах неполного сгорания объема CH4 говорит о грубых отклонениях режима горения от нормы.
Рассмотрим полное сгорание топлива в стехиометрических соотношениях и при условии, когда в продуктах сгорания VCO = 0; VH2= 0; VCH4 = 0 и нет остаточного кислорода VO2= 0.
Объем воздуха, необходимый для полного сгорания 1 кг (м3) топлива при условии безостаточного использования кислорода, называется теоретически необходимым объемом воздуха V0В ,а объем газов после сгорания - теоретическим объемом продуктов сгорания V0Г
|
| 4.30 |
Теоретический объем сухих газов
|
| 4.31 |
и полный объем газов
|
| 4.32 |
Объем V0H2O включает полный объем водяных паров в продуктах сгорания 
 Объем V0N2 состоит в основном из азота воздуха с небольшим дополнением объема азота из топлива. Для обозначения объемов, соответствующих теоретическим условиям горения, вводится индекс 0.
Объем V0N2 состоит в основном из азота воздуха с небольшим дополнением объема азота из топлива. Для обозначения объемов, соответствующих теоретическим условиям горения, вводится индекс 0.
Теоретические объемы воздуха и продуктов сгорания определяются составом сжигаемого топлива и приведены в табл. 4.1.
Объем сухих трехатомных газов VRO2 в формулах (4.30) и (4.31) одинаков и не зависит от того, подан на горение теоретический объем воздуха V0В или большее его количество, поскольку содержание CO2 и SO2 в атмосферном воздухе мало и не учитывается в расчетах. Объем других составляющих продуктов сгорания при подводе VВ > V0В будет изменяться. При этом увеличение объема продуктов сгорания сверх V0Г определяется только избыточным количеством воздуха ΔVВ = VВ - V0В и водяными парами, содержащимися в нем: 
В действительных условиях невозможно довести топливо до полного сгорания при теоретически необходимом объеме воздуха из-за несовершенства перемешивания топлива с воздухом в большом топочном объеме за короткое время пребывания газов в нем (2…3 с). Поэтому для обеспечения полноты сгорания топлива, удовлетворяющего экономическим показателям работы парового котла, действительный объем воздуха в зоне горения всегда поддерживают несколько больше теоретического. Отношение этих объемов называют коэффициентом избытка воздуха в продуктах сгорания
| Α = VВ / VВ0 | 4.33 |
Коэффициент избытка воздуха на выходе из топочной камеры обозначается αТ. Доля избыточного воздуха в топке зависит от сорта топлива, способа его сжигания и конструкции топочного устройства. Твердое топливо, отличающееся большим выходом летучих веществ, легче воспламеняется и быстрее сгорает и относится по условиям горения к реакционным топливам.
Эффективное перемешивание топлива с воздухом и быстрое сжигание достигаются при использовании газового топлива и мазута, поэтому они требуют наименьшего избытка воздуха в зоне горения. Разный избыток воздуха нужен при сжигании одного и того же топлива, но в разных топочных устройствах (например, в прямоточной или вихревой топочной камере), отличающихся эффективностью перемешивания.
Расчетный коэффициент избытка воздуха на выходе из топки αТ принимают для разных топлив в следующих пределах: для твердых αТ = 1,15…1,25; для жидких αТ = 1,02…1,10; для газовых αТ = 1,05…1,10.
Уменьшение избытка воздуха дает экономию расхода энергии на тягодутьевых устройствах и повышает КПД котла. Однако его снижение ниже расчетного значения αТ ведет к росту недожога топлива и снижению экономичности котла.
При работе парового котла под наддувом избыток воздуха на выходе из топки αТ равен его значению в горелке αГОР и сохраняется неизменным по всему газовому тракту, так как все его газоходы в этом случае имеют небольшое избыточное давление и выполнены газоплотными; исключение составляет регенеративный воздухоподогреватель.
При работе котла под разрежением, создаваемым дымососами, происходит подсос в газовый тракт холодного воздуха из окружающей среды через неплотности ограждения, чаще всего в местах сопряжения отдельных элементов котла.
За счет присоса воздуха объем продуктов сгорания по газовому тракту постепенно увеличивается, снижается температура газов. Присосы определяются в долях от теоретически необходимого объема воздуха
|
| 4.34 |
где ΔVi - объем присосанного воздуха в пределах i-ой поверхности парового котла.
Тогда избыток воздуха за i-ой по порядку поверхностью нагрева после топки определяется как
|
| 4.35 |
В топочной камере также имеют место присосы воздуха ΔαТ. С учетом этого избыток воздуха в зоне горения будет составлять
|
| 4.36 |
Объем уходящих газов, определяемый за последней поверхностью котла,
|
| 4.37 |
состоит из объема продуктов полного сгорания топлива V0Г, и объема избыточного воздуха ΔVизб
|
| 4.38 |
где (αТ - 1) - избыток воздуха в зоне горения.
Первое слагаемое в формуле (4.38) характеризует организованный избыток воздуха, необходимый для обеспечения достаточно полного сжигания топлива. Второе слагаемое - вредные присосы холодного воздуха.
Первоначально определение избытка воздуха в потоке газов осуществлялось косвенным способом - путем определения процентного содержания RO2=CO2+SO2 в сухих газах при известном для данного вида топлива максимально возможном RO2МАКС. Максимальное содержание сухих трехатомных газов в продуктах сгорания (при α = 1 и O2 = 0)
|
| 4.39 |
где βТ. - топливная характеристика, зависящая при сжигании в воздухе от состава топлива,
|
| 4.40 |
Для различных видов топлив RO2МАКС составляет: для твердых топлив RO2МАКС = 10-20%; для мазута RO2МАКС = 16-17%; для природного газа RO2МАКС = 11-13%.
Для определения избытка воздуха используется углекислотная формула
|
| 4.41 |
В составе газа RO2 определяется ручным газоанализатором либо хроматографом. Косвенным методом при сжигании твердых топлив нельзя пользоваться, когда топливо в своем составе имеет карбонаты, разлагающиеся в зоне горения с выделением СО2 (например, сланцы).
Расчет характеристики βТ для газового топлива, а также расчеты при совместном сжигании газа с мазутом или твердым топливом требуют пересчета объемных характеристик топлива на массовые. Так, масса 1 м3 сухого газового топлива, кг/м3,
|
| 4.42 |
где ρГ - плотность сухого обеззоленного газового топлива, кг/м3; dГ, аГ - влагосодержание и содержание минеральной пыли в топливе, г/м3.
Пересчет состава газового топлива на элементный состав условного твердого топлива (в процентах) производится по специальным формулам и RO2МАКС по (4.39) однозначно связано с топливной характеристикой βТ. При любом незафиксированном изменении состава топлива это значение также меняется, что ведет к ошибке в определении α.
Кроме того, в реальных условиях в продуктах сгорания имеется избыточный кислород и возможен химический недожог топлива. Тогда значение RO2МАКС становится переменным, и для его определения необходим полный химический анализ газов
|
| 4.43 |
При этом использование формулы (4.39), в которой RO2МАКС получено только по составу топлива, ведет к дополнительной ошибке. Поэтому указанная углекислотная формула определения α по (4.41) является приближенной. В последнее время наиболее широко контроль избытка воздуха в газовом тракте котла обеспечивают с помощью кислородомера. При постоянном протоке через прибор небольшой доли дымовых газов из заданного места газового тракта из них выделяется кислород, обладающий специфическими магнитными свойствами. Прибор показывает количество O2 в процентах от объема осушенных газов.
Остаточный кислород в продуктах сгорания, в процентах от объема сухих газов, можно выразить следующим образом:
|
| 4.44 |
С учетом ранее сказанного объем VС.Г = αV0В, тогда
|
| 4.45 |
и окончательно искомый избыток воздуха
|
| 4.46a |
Если в дымовых газах содержатся продукты неполного сгорания (СО, Н2), то нельзя весь оставшийся кислород считать избыточным, часть его должна быть израсходована на окисление этих продуктов. Тогда формула (4.46а) примет вид
|
| 4.46б |
где СО, Н2 - процентное содержание в газах продуктов недожога. Их количество определяется методами газовой хроматографии.
Кислородная формула (4.46) точна, когда теоретические объемы воздуха и сухих газов одинаковы. Реально V0С.Г > V0В и определение α будет иметь небольшую ошибку, но в допустимых пределах для технических измерений при эксплуатации.
Контроль избытка воздуха на котле обычно осуществляют в двух точках газового тракта - в поворотной камере (или за конвективным пароперегревателем высокого давления) и за воздухоподогревателем (в уходящих из котла газах). Разность этих показателей характеризует долю присосов холодного воздуха в поверхностях конвективной шахты, а значение O2 в поворотной камере показывает, выдерживаются ли условия оптимального избытка воздуха в топочной камере, поскольку присосы в горизонтальном газоходе стабильны и незначительны. Прямое определение избытка воздуха в топке технически затруднительно и неудовлетворительно по точности из-за высокой температуры газов и неустойчивой аэродинамики потока.
4.5. Расчет энтальпий продуктов сгорания
Расчет энтальпий продуктов сгорания необходим для определения тепловосприятия поверхностей нагрева и изменения теплосодержания газового потока. При теплотехнических расчетах принято удельную энтальпию продуктов сгорания определять для объема газов, получающегося при сгорании 1 кг или 1 м3 топлива, и удельную энтальпию воздуха также относить к его объему, необходимому для сжигания 1 кг или 1 м3 топлива. Обычно это значение энтальпии обозначается буквой Н и выражается в кДж/м3. Так как теплоемкости отдельных газов в составе продуктов сгорания различны, то энтальпии компонентов дымовых газов подсчитываются отдельно и затем суммируются. Так, энтальпия теоретического объема продуктов сгорания при температуре газов θ,° С, составляет
|
| 4.47 |
где cRO2,cN2 ,cH2O- объемные теплоемкости отдельных компонентов дымовых газов, взятые при расчетной температуре газов θ, кДж/(м3К).
Энтальпия газового потока при избытке воздуха α > 1 определяется как
|
| 4.48 |
Здесь H0В - энтальпия теоретического объема воздуха,
|
| 4.49 |
где сВ - объемная теплоемкость воздуха, кДж/(м3 · К). Последний член HЗЛ уравнения (4.48) учитывает энтальпию золовых частиц в потоке
|
| 4.50 |
где (сθ)ЗЛ - энтальпия 1 кг золовых частиц при температуре газов, кДж/кг; аУН - доля золы, уносимой газовым потоком, обычно аУН = 0,90…0,95. Энтальпия золы учитывается только при сжигании высокозольных топлив, когда
|
|
Энтальпия H0Г при одинаковой температуре всегда выше, чем энтальпия H0В, поскольку объем газов V0Г> V0В, а объемные теплоемкости трехатомных газов сRO2, cН»О больше теплоемкости воздуха сВ. При работе котла с уравновешенной тягой и наличии присосов по газовому тракту энтальпии НГ в каждой поверхности нагрева зависят от рабочей температуры газов и избытка воздуха. Присосы воздуха в поверхности нагрева изменяют объем и энтальпию газов на выходе из нее.
Теплота, отданная газовым потоком при прохождении поверхности нагрева, определяется по формуле
|
| 4.51 |
Здесь H'Г - энтальпия газов на входе в поверхность, кДж/кг, определяется по (4.48) при α' для предыдущей поверхности; H"Г - то же на выходе из поверхности, определяется по α' с учетом присоса воздуха в поверхности - α" = α' + Δαi;  - энтальпия теоретического объема присосанного холодного воздуха, кДж/кг.
- энтальпия теоретического объема присосанного холодного воздуха, кДж/кг.
Если тепловосприятие поверхности нагрева определено по рабочей среде, то из уравнения (4.51) может быть найдена энтальпия газового потока до или за поверхностью. Температуру газов по известной их энтальпии можно установить, используя H, θ -таблицу продуктов сгорания топлива для опорных температур (через каждые 100°С) либо определить по формуле
|
| 4.52 |
где  - относительная энтальпия газов, определенная по отношению к максимальному значению энтальпии при 2200 °С и при избытке воздуха, соответствующем его избытку в данном расчетном месте
- относительная энтальпия газов, определенная по отношению к максимальному значению энтальпии при 2200 °С и при избытке воздуха, соответствующем его избытку в данном расчетном месте
|
| 4.53 |
Энтальпии H0Г и H0В определяются при θ = 2200°С.
Примеры
Примеры 1. Определить, насколько возрастает скорость горения коксовой частицы по уравнению С + O2 = СО2 при увеличении температуры горения с t1 = 1230°С до t2 = 1730°С при значении энергии активации Е =125 МДж/моль.
Решение
На основании формул (4.10) и (4.11) при постоянстве в зоне горения средней концентрации кислорода и принятия в первом приближении константы k0 = const отношение скоростей реакций составит
|
|
Если Вам понравилась эта лекция, то понравится и эта - 22 Диета № 10И.
Универсальная газовая постоянная R = 8,3 кДж/(моль∙К), в результате
|
|
В то же время за счет увеличения температуры возрастают скорости движения молекул и частота соударений молекул. Поэтому при температуре T2 константа k0 увеличится в соотношении
|
|
В итоге общее увеличение скорости горения коксовой частицы составит
|
|