Квантовомеханические особенности строения биомолекул
1.1 Квантовомеханические особенности строения биомолекул
Живые системы на 99% состоят из атомов водорода, углерода, азота и кислорода. Большую роль в биохимических процессах играют также атомы фосфора и серы. Для атомов С, N, О, S и Р характерно наличие “неподелённой пары электронов” и способность легко образовывать кратные связи.
Состояние электронов в атоме описывается волновыми функциями – атомными орбиталями (АО), которые классифицируются в зависимости от значения орбитального квантового числа (s-, р-, d-орбитали). АО, которые используются для образования связей, называются валентными орбиталями.
Орбитали рассчитывают по законам квантовой механики. Поэтому раздел биофизики, который посвящён изучению поведения электронов в биологических системах, называется квантовой биофизикой. Он получил импульс развития в работах Альберта Сент-Дьëрдьи, который называл эту область знаний биоэлектроникой и под таким названием опубликовал в 1969 году свою замечательную книгу. Она имела подзаголовок: “Исследование в области клеточной регуляции, защитных механизмов и рака”.
Электроны в атоме, орбитали которых имеют форму сферы, называются s-электронами (рис. 1.9, а). У р-электронов (рис. 3.9, б, в, г) орбитали гантелевидной формы (точнее, формы объёмных восьмерок), расположенные в трёх взаимно-перпендикулярных направлениях. Такие электроны отсутствуют у важнейшего элемента биологических систем водорода, но зато все другие элементы (С, N, O, P, S), составляющие вместе с атомом Н львиную долю биологических молекул, содержат р-электроны. Углерод имеет 2 неспаренных р-электрона на втором энергетическом уровне (2рх и 2рy-орбитали). У азота 3 неспаренных р-электрона на втором энергетическом уровне (2рх, 2рy, 2рz). У кислорода 2 спаренных (2рх) и два неспаренных (2рy и 2pz) р-электрона на втором энергетическом уровне. Фосфор и сера содержат р-электроны не только на втором, но и на третьем энергетических уровнях. Так, у фосфора 6 спаренных (2рх, 2рy, 2рz) р-электронов на втором энергетическом уровне и 3 неспаренных (3рх, 3рy, 3рz) р-электрона на третьем энергетическом уровне. Сера имеет 8 спаренных (2рх, 2рy, 2рz, 3pх) и 2 неспаренных (3рy, 3рz) р-электронов.
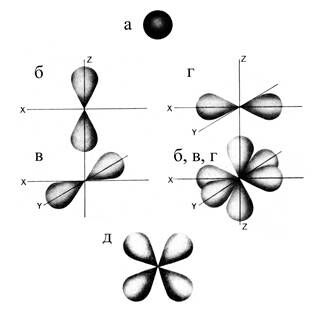
Рис. 1.9. Атомные орбитали: s- (а), p- (б, в, г), d- (д) – электронов
Более сложные орбитали у d- (рис. 1.9, д) и f-электронов в атоме, причём в основном состоянии ни один из перечисленных выше элементов (H, C, N, O, P, S) таких электронов не имеет.
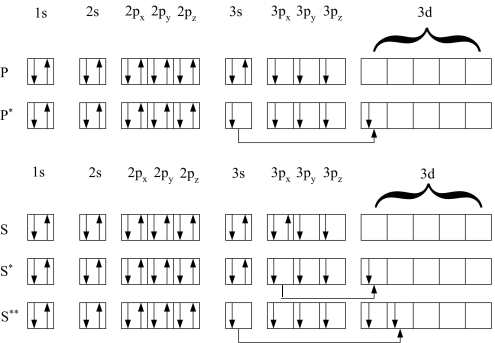
Однако при возбуждении (рис. 1.10, Р*) один из двух s-электронов фосфора с третьего энергетического уровня (3s) переходит на вакантную 3d-орбиталь и тогда у фосфора на третьем энергетическом уровне оказывается 5 неспаренных электронов: один s-электрон, три р-электрона, один d-электрон. В этом случае валентность фосфора равна не трём (как в покое), а пяти. Для возбуждения серы (рис. 1.10, S*, S**) также характерно заполнение вакантных 3d-орбиталей, причём как одной, так и двух. В первом случае (рис. 1.10, S*) один из двух электронов переходит с 3рх-орбитали на 3d-орбиталь, и сера из двухвалентной становится четырёхвалентной (с четырьмя неспаренными электронами на третьем уровне). Во втором варианте атома серы (рис. 1.10, S**) на 3d-орбиталь переходят два электрона: один – с 3рх (как и в первом варианте), а второй с 3s-орбитали, и такая сера шестивалентна (с шестью неспаренными электронами на третьем энергетическом уровне). Следовательно, за счёт распаривания электронов сера, в отличие от кислорода, может быть не только двух-, но также четырёх- и шестивалентной.
Рекомендуемые материалы
Рис. 1.10. Квантовые ячейки атомов фосфора (Р, Р*) и серы (S, S*, S**) в основном состоянии (P, S) и при возбуждении (P*, S*, S**)
Состояние электрона в молекуле также может быть описано с помощью волновой функции, именуемой в данном случае не атомной, а молекулярной орбиталью (МО). Волновые функции, описывающие состояние электронов в молекулах, подчиняются уравнению Шрёдингера, однако решение его оказывается чрезвычайно сложным. При учёте межэлектронного отталкивания невозможно разделить переменные в уравнении Шрёдингера ни в какой системе координат. Поэтому даже для двухэлектронной задачи не найдена точная волновая функция. На практике расчёт молекулярных орбиталей осуществляется различными приближенными методами, среди которых наиболее распространённым является метод ЛКАО (линейной комбинации атомных орбиталей). Этот метод основан на предположении, что на электрон, когда он находится в молекуле вблизи ядра какого-либо атома, в основном действуют силы со стороны данного ядра и других электронов, расположенных вблизи от этого ядра. По-видимому, эти силы не очень отличаются от сил, действующих на электрон в соответствующем атоме, и можно предположить, что МО электрона, находящегося вблизи ядра какого-либо атома в молекуле, должна напоминать АО электрона в данном атоме. Поэтому МО электрона можно представить в виде линейной комбинации атомных орбиталей.
Рассмотрим образование и свойства МО молекул, содержащих атомы С, N, О. Валентными орбиталями этих атомов являются орбитали 2s и 2р. Так как различные 2р-орбитали по-разному ориентированы в пространстве, необходимо выбрать систему координат. В качестве единой оси для всех молекул выбирается ось Z. В данной системе координат различают 2рх-, 2ру- и 2рz-орбитали, обладающие разными свойствами. Молекулярные орбитали будут получаться путём комбинации атомных орбиталей, способных перекрываться между собой. В зависимости от того, какие АО образуют данную МО, различают молекулярные s-орбитали и p-орбитали.
Молекулярные σ-орбитали создаются при перекрытии двух s-орбиталей (рис. 1.11, а), s – и р-орбиталей, двух р-орбиталей на оси Z, вдоль которой два атома взаимодействуют друг с другом (рис. 1.11, б)
Молекулярные π-орбитали возникают при взаимодействии р-орбиталей двух атомов вдоль осей Х или Y, перпендикулярных оси Z (рис. 1.11, в).
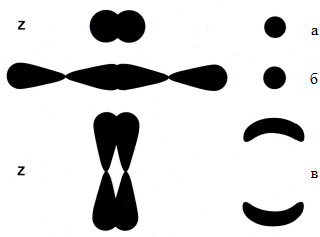
Рис. 1.11. Образование молекулярных орбиталей: s-орбиталей (а, б); p-орбиталей (в)
Молекулярная σ-орбиталь (рис. 1.11, а, б) имеет форму эллипсоида, который обхватывает ось Z и “покоится” на ней. Атомы, объединённые σ-связью, обладают свободой вращения вокруг неё (то есть относительно оси Z), поскольку облаку эллипсоидальной формы присуща осевая симметрия. В химических формулах σ-связь обозначается одной чертой (одиночная или ординарная связь).
Молекулярная π-орбиталь (рис. 1.11, в) представляет собой двойное двухдольное облако (в разрезе – форма фасоли), которое наподобие манжеты “парит” над осью Z. Заряд каждого π-электрона распределён симметрично вокруг оси, перпендикулярной направлению одиночной связи (оси Z). Поэтому π-электроны находятся всегда вне плоскости молекулы, образуя двойные связи между атомами и обусловливая высокую реакционную способность при химическом взаимодействии.
Молекуле, обладающей π-электронами, присущи нелокализованные многоцентровые орбитали, принадлежащие не отдельным атомам, а всей молекуле в целом. Единое облако π-электронов позволяет им мигрировать не только в пределах своей молекулы, но и переходить с молекулы на молекулу, если они структурно объединены в ансамбли. Явление межмолекулярного переноса было открыто Дж. Вейсом (J. Weiss) в 1942 г., а квантовомеханическая модель это процесса разрабатывалась Р. Малликеном (R.S. Mulliken) в 1952 – 1964 г.г.
Находясь в клетке, биомолекулы “живут”, обмениваясь энергией и зарядами, а значит, информацией, благодаря развитой системе делокализованных π-электронов. В клетках строгая упорядоченность молекул обеспечивается прежде всего биологическими мембранами.
Вместе с тем важнейшая миссия π-электронов в биологических процессах связана не только и не столько с их делокализацией, сколько с особенностями энергетического статуса: разность энергий основного и возбуждённого состояний значительно меньше, чем у σ-электронов (рис. 1.12), и, что особенно важно, примерно равна энергии фотона (hν) в видимой области электромагнитного спектра: ΔWπ ≈ hν. Поэтому молекулярным системам, обладающим π-электронами, присуще эффективное поглощение энергии солнечного излучения в видимом диапазоне.

Рис. 1.12. Энергетические уровни: s-электронов (в покое – s и при возбуждении – s*) и p-электронов (в покое – p и при возбуждении – p*)
Благодаря этому именно π-электроны способны аккумулировать (конвертировать) солнечную энергию, за счёт чего с ними связано всё энергообеспечение биологических систем. Поэтому π-электроны принято называть “электронами жизни”.
Определение энергий π-электронов в исследуемой системе – важнейшая задача квантовомеханических расчётов молекулярных орбиталей. В этих расчётах устанавливают также характер распределения плотности заряда по скелету молекулы и распределение орбитали в пространстве и во времени.
Выше было сказано, что для атомов О, N, S, Р характерно наличие неподелённых пар электронов. Дело в том, что электроны, спаренные на одной орбитали, не имеют возможности образовывать связи с электронами других атомов, и валентность атома определяется числом его неспаренных электронов. Однако электронные пары, которые в изолированном атоме занимают орбитали в той же оболочке или подоболочке, что и валентные электроны, сильно влияют на образование связей и свойства молекул. Такие электронные пары называются неподелёнными парами. Азот и фосфор имеют по одной неподелённой паре, кислород и сера – по две.
Делокализация электронов в сопряжённых системах. Все многоатомные молекулы могут быть разделены на две большие группы: несопряжённые системы и сопряжённые системы.
Несопряжённые системы содержат только ординарные связи или же в них имеются изолированные кратные связи, отделённые друг от друга или от атомов с неподелённой парой электронов, по крайней мере, одним атомом с насыщенной валентностью. Такие молекулы можно рассматривать как составленные из примыкающих друг к другу и почти не зависящих друг от друга связей, каждая из которых описывается локализованной двухцентровой МО, аналогичной МО в двухатомной молекуле. Свойства образующих молекулу связей (энергии связей, длины связей и т. д.) постоянны, и для одной и той же связи, входящей в разные молекулы, изменяются незначительно.
Сопряжённые системы представляют собой молекулы, содержащие несколько кратных связей, в которых участвуют соседние атомы или же молекулы, в состав которых входят атомы с неподелёнными электронными парами, расположенные рядом с кратной связью. Для таких систем характерны нелокализованные многоцентровые МО, относящиеся к молекуле в целом или, по крайней мере, к большей её части. Рассмотрим более подробно сопряжённую систему на примере молекулы бутадиена: СН2 = СН – СН = СН2. В этой молекуле ординарные связи С – С и С – Н расположены компланарно (рис. 1.13, а), тогда как 2рх-орбитали атомов углерода ориентированы параллельно друг другу и перпендикулярно к плоскости молекулы (рис. 1.13, б).
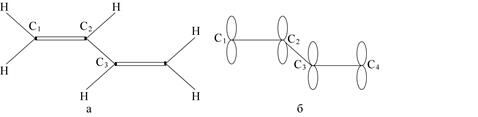
Рис. 1.13. Структурная формула молекулы бутадиена (а) и расположение 2рх-орбиталей атомов углерода в молекуле бутадиена (б)
Такая ориентация способствует максимальному перекрыванию орбиталей и обеспечивает наибольшую устойчивость всей системы. 2рх-орбиталь атома С2 может одинаково хорошо перекрываться с 2рх-орбиталью как атома С1, так и атома Сз. Вследствие этого нельзя считать, что р-электрон атома С2 образует связь лишь с р-электронами атома C1 или атома С3, то есть нельзя говорить о строгой локализации р-электронов между двумя соседними атомами. Это означает, что нельзя говорить о существовании изолированных двойных связей; двойные связи в данном случае делокализованы. Четыре 2рх-орбитали образуют единое облако π-электронов, определённым образом распределённое по всей молекулярной структуре. Следовательно, все электроны бутадиена можно разделить на 2 группы: s-электроны, которые образуют скелет локализованных связей, и p-электроны, образующие единую подвижную систему, простирающуюся вдоль всего скелета s-связей.
Если молекула с сопряжёнными связями содержит атомы, обладающие неподелёнными электронными парами, то электроны этих пар могут включаться в общую систему p-электронов.
Существование делокализованных p-электронов является важнейшим свойством молекул с сопряжёнными связями. Основные химические, физико-химические и биохимические свойства таких систем определяются p-электронами, так как они гораздо подвижнее s-электронов и с большей лёгкостью вступают в химические реакции.
Все наиболее важные биомолекулы, с которыми связаны основные функции живой материи, представляют собой полностью или частично сопряжённые системы. Так, наиболее важными составляющими частями нуклеиновых кислот являются сопряжённые гетероциклы – пуриновые и пиримидиновые основания. Белки содержат изолированные сопряженные участки (пептидные связи), но, возможно, что их вторичная и третичная структуры предрасполагают к общей делокализации электронов. Большинство ферментов проявляет каталитическую активность только в сочетании с коферментами, которые практически все представляют собой сопряжённые системы. В богатых энергией фосфатах подвижные электроны концевой фосфатной группы взаимодействуют с электронами других фосфатных групп и с электронами органического радикала.
Делокализация электронов придает молекуле дополнительную стабильность, например, устойчивость к действию излучений, и обеспечивает возможность протекания таких реакций, которые не характерны для молекул других типов, а именно, возможность переноса электронов и энергии между молекулами, объединёнными в ансамбли (прежде всего, в биологических мембранах).
Приведём пример, иллюстрирующий значение строения молекулы для её биологической функции. Нуклеотиды, входящие в состав молекулы ДНК, могут существовать в различных формах, отличающихся стереоструктурой – положением водорода в молекуле. Такие формы называются таутомерами, а переход из одной формы в другую – таутомерным переходом. Так, для гуанина переход 1 ® 2 (Г – Г*) связан с переносом протона от атома азота к атому кислорода (рис. 1.14).
Обе таутомерные формы устойчивы, что отображает энергетическая диаграмма. Уровни энергии протона в обеих формах лежат в соответствующих потенциальных “ямах”. Для изменения своего положения в молекуле гуанина протоны должны посредством туннельного перехода преодолеть потенциальный барьер, высота и форма которого сильно зависят от состояния системы p-электронов.
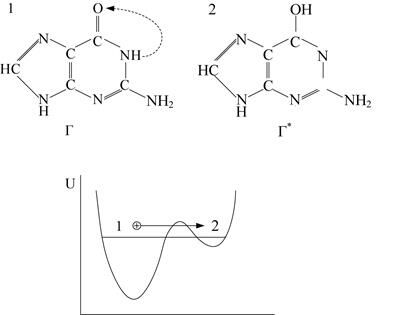
Рис. 1.14. Схема, иллюстрирующая таутомерный переход (1 ® 2) с переносом протона от атома азота к атому кислорода в молекуле гуанина
В молекуле ДНК соблюдается строгая комплементарность: гуанин связан с цитозином и аденин – с тимином. Если произойдёт таутомерный переход в молекуле гуанина, то она будет комплементарно сочленяться уже не с цитозином, а с тимином (рис. 1.15). Следовательно, наличие у молекулы ДНК делокализованной системы p-электронов, а также её состояние могут играть важную роль в возникновении мутаций. Так, действие ионизирующей радиации, которое, как известно, увеличивает вероятность мутаций, изменяет состояние электронов в молекуле ДНК, что и приводит к выраженному биологическому эффекту.
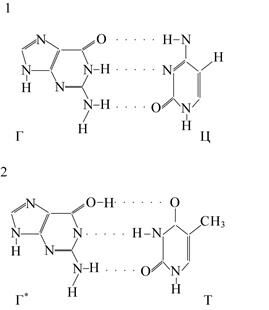
Рис. 1.15. Сочетание нуклеотидных оснований в молекуле ДНК: 1 – до таутомерного перехода в гуанине (гуанин – цитозин, Г – Ц), 2 – после таутомерного перехода в гуанине (гуанин* – тимин, Г* – Т)
Следует отметить также, что протон, находящийся в потенциальной «яме», способен изменять свою энергию при действии различных излучений, что тоже сказывается на частоте мутаций. Такими факторами могут являться электромагнитные поля радиочастотного диапазона, ультрафиолетовое и рентгеновское излучения.
Существование в молекуле ДНК подвижной системы p-электронов играет важную роль и в механизмах передачи генетической информации – в репликации ДНК. Этот процесс начинается с того, что комплементарные нуклеотидные основания одной из пар расходятся, что невозможно без затрат свободной энергии. Один из возможных источников – энергия электростатического отталкивания облака электронов, поляризованного под действием электрического поля среды, окружающей молекулу ДНК. Вероятность подобного механизма увеличивается при возбуждении p-электронов и при ионизации нуклеотидов. Поэтому репликация ДНК может начаться под действием тех же факторов, которые вызывают мутации.
Спектры поглощения сложных молекул. Важнейшим источником информации о структуре сложных молекул являются их спектры поглощения. Изучение спектров поглощения в ультрафиолетовой и видимой областях позволяет получить сведения о системе электронных энергетических уровней молекулы и о вероятности переходов между ними. В основном состоянии молекулы все её электроны распределены по низшим молекулярным орбиталям (МО), выше которых располагается ряд свободных орбиталей с более высокой энергией. Низшее возбуждённое состояние соответствует переходу электрона с высшей заполненной на низшую свободную орбиталь. Классификация электронных переходов в сложных молекулах связана с типами МО, между которыми происходит переход. Система МО сложных органических и биологически важных молекул состоит из локализованных s-орбиталей, локализованных и делокализованных p-орбиталей, а также n-орбиталей, на которых находятся электроны неподелённых пар атомов О, N, S. Заполненные орбитали обозначаются символами s, p, n, а свободные – символами s* и p*. Порядок возрастания энергии орбиталей обычно бывает таким: s < p < n < p* < s* (рис. 1.16). В биологически важных макромолекулах возможен целый ряд переходов, обозначаемых символами s ® s*, p ® p*, n ® p*, n ® s*. Среди этих переходов наибольший интерес представляют p ® p* переходы. Соответствующие этим переходам полосы в спектрах поглощения обычно имеют довольно большую интенсивность и лежат в ближней ультрафиолетовой или видимой областях спектра. Полосы, соответствующие s® s*-переходам, обычно лежат в далекой ультрафиолетовой части спектра. При n ® p*- или n ® s*-переходах один из электронов неподелённой пары переходит соответственно на p*- или s*-орбиталь. Полосы, соответствующие этим переходам, имеют, как правило, малую интенсивность.
Для p®p*-переходов характерно то, что при наличии системы сопряжённых связей поглощённая энергия кванта света передается не отдельному электрону, а всей коллективизированной p-электронной системе. Поэтому наличие у молекул делокализованных p-электронов может быть обнаружено по присутствию характерных полос в спектрах поглощения этих молекул. Рассмотрим два примера.
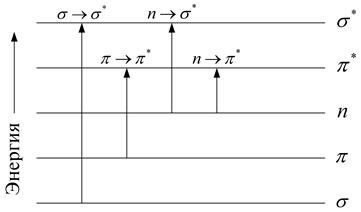
Рис. 1.16 Типы электронных переходов в сложной органической молекуле
В состав белков входят остатки таких аминокислот: триптофан, тирозин, фенилаланин, которые поглощают энергию в ультрафиолетовой части спектра. Несмотря на довольно значительные различия в структуре, спектры этих молекул сходны между собой. Наличие у всех этих молекул развитой системы делокализованных p-электронов приводит к появлению в их спектрах широкой полосы поглощения в области 260 – 280 нм, обусловленной p ® p*-переходами (рис. 1.17).
Вам также может быть полезна лекция "3. Негативные факторы в техносфере, классификация, характеристика".
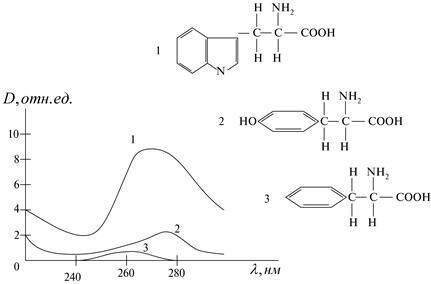
Рис. 1.17. Структурные формулы и спектры поглощения ароматических аминокислот:1 – триптофана, 2 – тирозина, 3 – фенилаланина
Резюмируя сказанное, можно отметить, что существование делокализованных p-орбиталей является, по-видимому, важнейшим свойством биологических молекул. Чрезвычайная подвижность p-электронов обусловливает большую реакционную способность таких молекул и делает возможным перенос энергии и заряда по цепи сопряжённых связей. Поэтому можно сказать, что молекулы в клетке “живут”, обмениваясь энергией и зарядом, а сделать это им позволяет наличие развитой системы делокализованных p-электронов. На существовании сопряжённых связей в биологически важных молекулах базируется динамичность жизненных процессов.
Молекула ДНК содержит 4 нуклеотидных основания – аденин, тимин, гуанин и цитозин, которые различаются по структуре. Однако в спектрах поглощения этих оснований много общего (рис. 1.18). Все они имеют максимум, близкий к 260 нм, поскольку за поглощение ультрафиолетового излучения у них ответственна в основном система p-электронов.
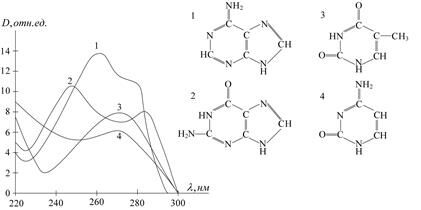
Рис. 1.18. Структурные формулы и спектры поглощения пуриновых и пиримидиновых оснований: 1 – аденина, 2 – гуанина, 3 – Тимина, 4 – цитозина























