Корпускулярно-волновые свойства микромира
1.2. Корпускулярно-волновые свойства микромира.
Двойственная природа микромира была впервые установлена для света. С одной стороны, для света характерны такие явления как интерференция и дифракция, которые могут быть объяснены только с позиций его волновой природы. С другой стороны, явление фотоэффекта с позиций этой теории описать невозможно. Это можно сделать, предположив для света корпускулярную (от лат. corpusculum – частица) природу. В 1905 г. Эйнштейн высказал мысль, согласно которой свет испускается в виде частиц, названных фотонами или квантами. Каждый фотон обладает энергией, определяемой уравнением
E = hν (1.3),
где ν – частота колебаний, h – постоянная Планка.
Из корпускулярной природы света следовало, что фотоны должны обладать определенной массой. Масса покоя фотона равна нулю, а при движении фотон приобретает динамическую массу. Для вычисления этой массы Эйнштейн предложил уравнение эквивалентности массы и энергии:
E = mc2 (1.4)
Объединяя уравнения (1.3) и (1.4) получим:
mc2= hν.
Подставляя в это равенство с/λ вместо частоты ν и учитывая, что для фотона скорость движения v равна скорости света с, получим основное уравнение волновой механики (уравнение де Бройля):
Рекомендуемые материалы
λ = h/mv (1.5).
В 1924 г. французский физик де Бройль исходя из представления о двойственной природе микромира, предположил, что электрон, как и другие частицы микромира обладает корпускулярно-волновой двойственностью, т.е. частице с массой m, движущейся со скоростью v, соответствует движение волны длиной λ = h/mv.
Предположение де Бройля в 1927 году было экспериментально подтверждено опытами Девисона и Джермера (США). Они наблюдали дифракцию электронов на кристаллах хлорида натрия.
В теорию Бора принцип квантования был введен произвольно. В ней в основном использовались законы классической механики. Открытие волновых свойств электрона, фотоэффект, опыты с абсолютно черным телом привели к созданию нового раздела физики – квантовой механики. Большую роль в ее создании сыграли Э. Шредингер и В. Гейзенберг.
В квантовой механике для описания поведения электрона в атоме исходными являются два положения:
1) движение электрона носит волновой характер;
2) наши знания о поведении электрона имеют вероятностный (или статистический) характер.
В соответствии с принципом неопределенности Гейзенберга никогда нельзя точно установить место нахождения частицы. Лучшее, что можно сделать в этом случае, это указать вероятность, с которой частица будет находиться в области пространства ∆V = ∆x ∆y ∆z.
В 1926 г. Шредингер предложил уравнение, в которое для описания поведения электрона в атоме была введена волновая функция ψ. Для одноэлектронного атома водорода уравнение Шредингера может быть выражено так:
∆2 ψ + 8π2m/h2(E-V) ψ = 0 (1.6),
где E – полная энергия электрона, V – потенциальная энергия электрона, m – масса электрона, h – постоянная Планка, ψ – волновая функция, ∆2 – оператор Гамильтона. Гамильтониан показывает, какие математические операции нужно произвести с волновой функцией, чтобы решить уравнение относительно энергии. Физический смысл волновой функции определить трудно, а вот квадрат модуля ее | ψ |2 определяет вероятность нахождения электрона в данной области пространства.
Уравнение Шредингера точно решается для водорода и водородоподобных атомов (т. е. для систем, состоящих из ядра и одного электрона). Из решения этого уравнения для атома водорода вытекало, что поведение электрона в атоме описывается четырьмя квантовыми числами.
Квантовые числа
1. n – главное квантовое число, принимает значения целых чисел от 1 до ∞. Однако невозбужденные атомы известных в настоящее время элементов не содержат электроны, для описания которых необходимы n>7.
Состояние электрона, характеризующееся определенным значением главного квантового числа, называют энергетическим уровнем электрона в атоме.
Пример. При n=1 электрон находится на первом энергетическом уровне, при n=2 – на втором.
Главное квантовое число определяет общую энергию электрона на данном уровне.
Наименьшей энергией электрон обладает на первом уровне, с увеличением n энергия электрона возрастает.
Главное квантовое число отражает также удаленность электрона от ядра и определяет размер электронного облака.
При этом, чем больше n, тем дальше от ядра находится в атоме электрон.
Поскольку электронное облако не имеет четко очерченных в пространстве границ, за размеры электронного облака принимаются размеры граничной поверхности, проведенной так, чтобы она включала 90% заряда и массы электрона.
2. l – орбитальное квантовое число. При данном n l принимает значения целых чисел от 0 до (n-1).
Состояние электрона, соответствующее определенному значению l, называется энергетическим подуровнем.
Т.о., энергетические уровни подразделяются на подуровни. Число подуровней равно номеру уровня.
Например,
n = 1 l = 0
n = 2 l = 0, 1
n = 3 l = 0, 1, 2
n = 4 l = 0, 1, 2, 3
s p d f
Для численных значений l приняты буквенные обозначения: s(l=0), p(l=1), d(l=2), f(l=3).
Орбитальное квантовое число определяет энергию электрона на подуровне и форму электронного облака.
3. ml – магнитное квантовое число. При данном l ml принимает значения всех целых чисел от –l через нуль до +l.
Магнитное квантовое число определяет ориентацию электронного облака в пространстве.
Данному значению l соответствует (2l+1) способов расположения электронного облака в пространстве.
s (l=0) ml=0 2l+1=1
p (l=1) ml=-1,0,1 2l+1=3
d (l=2) ml=-2,-1,0,1,2 2l+1=5
f (l=3) ml=-3,-2,-1,0,1,2,3 2l+1=7
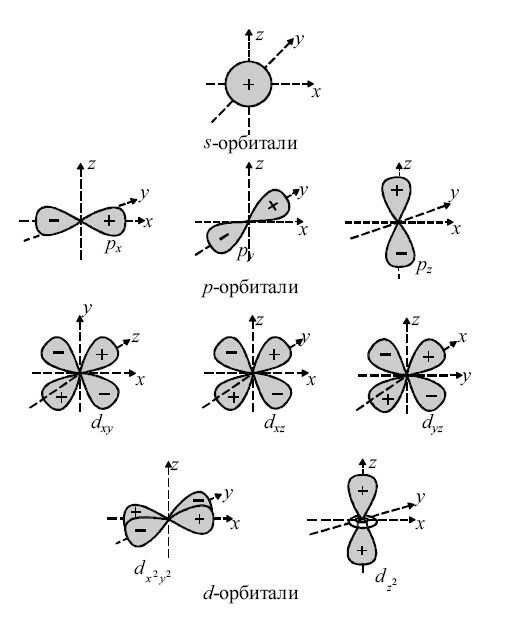
Состояние электрона в атоме, характеризующееся определенными значениями n, l, ml (т.е. определенными размерами, формой и ориентацией в пространстве электронного облака) получило название атомной электронной орбитали (квантовой ячейки, энергетического состояния).
Как мы уже показали, s-состоянию всегда отвечает только одна орбиталь, р-состоянию – три орбитали, d-состоянию - пять орбиталей, f-состоянию – семь орбиталей.
Люди также интересуются этой лекцией: 4 Вопросы.
Рис.1.1. Пространственные конфигурации s-, p- и d-орбиталей.
4. ms – спиновое квантовое число.
Изучение тонкой структуры атомных спектров показало, что электроны в атомах отличаются еще одной характеристикой – собственным моментом количества движения, называемым спином.
Этот момент порождается, как показали Уленбек и Гаудсмит, особым движением электрона, которое только очень условно можно описать как движение вокруг собственной оси. Спин, как и другие характеристики движения микрочастиц, не имеет подлинных механических аналогий и принципиально не может быть связан с какой-либо наглядной моделью.
Вращение электрона вокруг своей оси следует понимать лишь в том смысле, что электрон имеет собственный момент. Этот собственный момент описывается спиновым квантовым числом. Значение спинового момента количества движения равно ±h/2π, т.е. ±½ в единицах h/2π. Поэтому спиновое квантовое число может иметь только два значения: +½ (↑) и -½(↓). Полуцелый спин электронов является столь же фундаментальным свойством электронов, как их масса и электрический заряд.
Т.о., четыре квантовых числа полностью характеризуют движение электрона в атоме, и никаких других характеристик, независимых от этих квантовых чисел, быть не может.






















