Определение калорических параметров идеального газа
Лекция 2.
Определение калорических параметров идеального газа.
Замкнутое математическое описание процессов в рабочем теле можно построить, если установлена зависимость внутренней энергии газа от термических параметров. Аналитическое выражение, устанавливающее эту связь называют калорическим уравнением состояния.
Вид калорического уравнения однозначно определяется термическим уравнением состояния.
Вспомним понятие теплоемкости
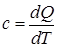
Q – количество тепла, поглощенное рабочим телом
T – температура рабочего тела
Чаще используют понятие удельной теплоемкости c.
Рекомендуемые материалы
Величины теплоемкости зависят от характера термодинамического процесса; важными термодинамическими величинами являются теплоемкость при постоянном объеме ( ) и теплоемкость при постоянном давлении (
) и теплоемкость при постоянном давлении (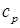 ). Величины этих теплоемкостейзависят от температуры и удельного объема газа. По мере уменьшения плотности зависимость теплоемкости от удельного объема уменьшается. В состоянии сильного разряжения (в идеальном газе) теплоемкости (
). Величины этих теплоемкостейзависят от температуры и удельного объема газа. По мере уменьшения плотности зависимость теплоемкости от удельного объема уменьшается. В состоянии сильного разряжения (в идеальном газе) теплоемкости ( и
и 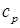 ) зависят только от температуры.
) зависят только от температуры.
Установим зависимость для внутренней энергии функцией от термических параметров для идеального газа.
Согласно 1му закону термодинамики, количество теплоты, полученное 1 кг газа расходуется на изменение внутренней энергии и совершении механической работы.
 (1.10)
(1.10)
Если dq сообщить рабочему телу при постоянном объеме, то:
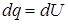
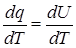
 (1.11)
(1.11)
Пологая, что уравнение подчиняется уравнению Клайперона, обычно одновременно пренебрегают зависимостью теплоемкостей  и
и 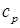 от температуры и считают их постоянными величинами. Если при этом положить, что T=0 и U=0, то получим формулу:
от температуры и считают их постоянными величинами. Если при этом положить, что T=0 и U=0, то получим формулу:
 (1.12)
(1.12)
Если теплота сообщается рабочему телу при постоянном давлении:
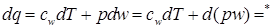
т.к. газ считается идеальным:
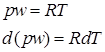
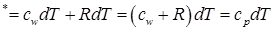
 (1.13)
(1.13)
 (1.13.а)
(1.13.а)
Отношение теплоемкостей
 (1.14)
(1.14)
Для идеального газа  .
.
Величина  для любого газа можно определить априорно.
для любого газа можно определить априорно.
 для однородного газа определяется числом атомов в молекуле.
для однородного газа определяется числом атомов в молекуле.
- для одноатомного газа 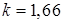
- для двухатомного газа 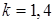
- для трех и более атомных газов 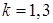
Из (1.14) и (1.13) получим формулы, определения  и
и 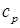
 (1.15)
(1.15)
 (1.15.а)
(1.15.а)
Из формул (1.15), (1.15.а) и (1.12) получаем
 (1.16)
(1.16)
Вам также может быть полезна лекция "28 Линейные однородные дифференциальные уравнения с постоянными коэффициентами".
 (1.17)
(1.17)
Если рабочим телом является смесь идеальных газов, то
 (1.18)
(1.18)
В термодинамике даются общие зависимости, позволяющие при известном термодинамическом уравнении состояния получить аналитические выражения для удельных теплоемкостей ( и
и 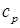 ), удельной энтальпии.
), удельной энтальпии.
Приведем без вывода зависимости, определяющие удельную внутреннюю энергию и дельную энтальпию для газа Ван-Дер Вальса:
 (1.19)
(1.19)






















