Группа веществ, изолируемых из биологического материала экстракцией и сорбцией
5. Группа веществ, изолируемых из биологического материала экстракцией и сорбцией
(ЛЕКАРСТВЕННЫЕ И НАРКОТИЧЕСКИЕ ВЕЩЕСТВА)
В главе рассмотрена общая характеристика группы, номенклатура и классификация веществ, относящихся к данной группе.
Рассмотрены методы изолирование лекарственных соединений из биологических объектов; факторы, определяющие эффективность выделения токсических веществ из биологических объектов; способы и методы очистки извлечений и экстрактов.
Рассмотрены методы изолирования данных веществ при проведении общего (ненаправленного) анализа (изолирование подкисленным этанолом (метод Стаса – Отто); изолирование водой, подкисленной щавелевой кислотой (метод Васильевой); изолирование нейтральным ацетоном (метод Карташова В.А.); твердофазная экстракция)), а также частные методы изолирования веществ кислотного характера (Метод Е. Грусц-Харди – изолирование смесью спирта и хлороформа; изолирование барбитуратов подщелоченной водой (метод П. Валова), метод изолирования алкалоидов водой, подкисленной серной кислотой (по В.Ф. Крамаренко), исследование биологических жидкостей (жидкость – жидкостная экстракция).
Оговорены достоинства и недостатки вышеперечисленных методов.
Рассмотрен аналитический скрининг лекарственных веществ, имеющих токсикологическое значение: хроматографические и скрининговые методы (тонкослойная хроматография (ТСХ); высокоэффективная тонкослойная хроматография (ВЭТСХ), спектральные скрининговые методы); абсорбционная спектроскопия; иммунохимические методы в скрининге лекарственных веществ; иммунохимический анализ (ИХА).
Показано определение и токсикологическое значение некоторых веществ, экстрагируемых из кислых водных растворов (барбитураты, салициловая кислота, антипирин, амидопирин, кофеин, теобромин, теофиллин).
Рекомендуемые материалы
Показано определение и токсикологическое значение некоторых алкалоидов (атропин, скополамин, кокаин, новокаин, дикаин, платифиллин, хинин, резерпин, стрихнин, морфин, кодеин, этилморфин, апоморфин, промедол, папаверин, но – шпа (дротаверин), наркотин, кониин, ареколин, никотин, анабазин, вератрин, эфедрин, производные фенотиазана, производные 1,4 – бензодиазепина. Типы основных реакций, химизм. Пределы обнаружения и специфичность.
Особенное значение в данной главе уделено аналитической диагностики наркотических и других одурманивающих веществ. Дана классификация веществ, вызывающих одурманивание. Показаны особенности химико-токсикологического анализа на содержание одурманивающих средств; экспрессное тестирование наркотических и одурманивающих веществ; интерпретация результатов анализа биологических объектов на содержание веществ, вызывающих одурманивание. Показаны правила отбора проб на обнаружение наркотических средств, психотропных и других токсических веществ.
5.1.ОБЩАЯ ХАРАКТЕРИСТИКА ГРУППЫ. НОМЕНКЛАТУРА И КЛАССИФИКАЦИЯ ВЕЩЕСТВ
Группа веществ, изолируемых из объектов экстракцией и сорбцией, включает в себя органические вещества различной химической структуры, прежде всего, наркотики, лекарственные средства и пестициды.
Широко используемые в медицине, сельском хозяйстве и в обыденной жизни (как средства одурманивания) алкалоиды, синтетические вещества кислого, слабоосновного и основного характера часто становятся предметом поиска в химико–токсикологическом исследовании.
К группе веществ, изолируемых из биологического материала экстракцией и сорбцией (их ещё называют «нелетучие» яды), относятся соединения кислотного, нейтрального и основного характера, различные по своему химическому строению. Номенклатура их очень велика и постоянно расширяется по мере синтеза новых соединений. Наибольшее токсикологическое значение в настоящее время имеют:
Вещества кислотного характера:
1. Органические кислоты: бензойная, салициловая, ацетилсалициловая, пикриновая.
2. Барбитураты: барбитал, фенобарбитал, барбамил, этаминал–Na, бутобарбитал, гексенал, бензонал, бензобамил, циклобарбитал и др.
Вещества нейтрального характера:
1. Небарбитуровые снотворные: ноксирон, тетридин.
2. Сердечные гликозиды.
3. Многоатомные фенолы: гидрохинон, пирогаллол.
4. Полинитропроизводные: м–динитробензол, динитротолуолы, тринитротолуол.
5. Производные анилина и п–аминофенола: фенацетин, п–фенилендиамин.
Вещества основного характера:
1. Алкалоиды: производные пиридина и пиперидина (жидкие алкалоиды); тропана (атропин, кокаин и др.); хинолина (хинин); изохинолина (опийные); индола (стрихнин, бруцин, резерпин); пурина (кофеин, теобромин, теофиллин); пирролизидина (платифиллин, саррацин); ациклические (эфедрин); стероидоподобные (вератрин); неустановленного строения (аконитин).
2. Синтетические вещества основного характера: производные пиразола (антипирин, амидопирин); производное пиперидина (промедол); производные аминокислот ароматического ряда (новокаин и дикаин); изониазид; производные фенотиазина (аминазин и др.); производные бензодиазепина и т.д.
При полном (общем, ненаправленном) судебно-химическом анализе обязательному исследованию в лабораториях БСМЭ подлежат, согласно Приказа МЗ СССР № 1021 от 25.12.73, следующие вещества:
Из веществ кислотного характера - производные барбитуровой кислоты.
Из веществ основного характера - алкалоиды: производные пиридина и пиперидина (никотин, пахикарпин), тропана, изохинолина (опийные алкалоиды), индола (стрихнин), производные фенотиазина, промедол.
5.2. МЕТОДЫ ИЗОЛИРОВАНИЯ ВЕЩЕСТВ И ИХ ТЕОРЕТИЧЕСКИЕ ОСНОВЫ
Большинство «нелетучих» ядов, являясь слабыми кислотами или слабыми основаниями, способны существовать в водном растворе в виде ионизированных или неионизированных (молекулярных) форм в зависимости от рН среды. Степень ионизации вещества (слабой кислоты или слабого основания) и необходимое для этого значение рН могут быть определены из уравнения степени ионизации (уравнение Гендерсона):
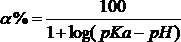
для кислот
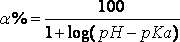
для оснований
где рКa – показатель ионизации вещества (– lgK), численно равный значению рН, при котором в растворе в равновесной концентрации присутствуют ионизированная и неионизированная (молекулярная) формы (т.е. вещество ионизировано на 50 %). Эта величина постоянная для данного вещества.
Для большинства слабых кислот и слабых оснований рКа приведены в монографии Альберта и Сержента «Константы ионизации кислот и оснований». Сильные кислоты (НNОз и др.) и сильные основания (NaOH) ионизированы на 100 % в широком интервале рН.
На основании уравнения Гендерсона, зная рН раствора, всегда можно вычислить степень ионизации вещества и, наоборот, если необходимо достичь определённой степени ионизации, всегда можно рассчитать необходимое для этого значение рН.
Степень ионизации вещества всегда приходится учитывать при изолировании ядов из биологического материала, так как растворимость ионизированных и неионизированных форм различна в воде и органических растворителях.
Ионизированные формы, которым соответствуют соли кислот и оснований, как правило, хорошо растворимы в воде и ограниченно растворимы в неполярных органических растворителях (хлороформ и эфир).
Неионизированные (молекулярные) формы, которым соответствуют свободная кислота и основание, наоборот, хорошо растворимы в неполярных растворителях и ограниченно растворимы в воде.
Пользуясь различной растворимостью ионизированных и молекулярных форм «нелетучих» ядов в воде и органических растворителях легко сформулировать принцип их изолирования, из биологического материала.
Изолирование «нелетучих» ядов из биологического материала основано на различной растворимости их ионизированной и молекулярной форм в воде и органических растворителях и на коэффициенте распределения молекулярной формы между водной и органической фазами.
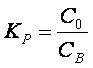
где :
Кр – коэффициент распределения молекулярной формы;
Со и Св – концентрации вещества в водной и органической фазах соответственно.
Очевидно, что, чем больше Кр, тем эффективнее идет экстракция.
В процессе изолирования «нелетучих» ядов из биологического материала взаимодействуют 3 компонента: яд, биологический материал и экстрагент.
При исследовании тканевого материала (внутренние органы трупа) изолирование состоит из двух стадий: извлечение яда из твердой фазы (объект) в водную, и извлечение яда из водной фазы в органический растворитель.
Схематично это может быть представлено следующим образом:
I стадия экстракции II стадия экстракции
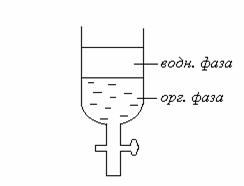
В лабораторных условиях экстракцию обычно проводят с помощью делительной воронки. В воронку помещают исследуемый раствор, содержащий растворенное вещество, подлежащее экстрагированию, и не смешивающийся с водой органический растворитель, которым извлекается экстрагируемое вещество из водного раствора. Воронка энергично встряхивается (обычно 2-5 мин). При этом обе жидкие фазы диспергируются друг в друга, образуя капли различного размера. Экстрагируемое вещество через границу раздела водной и органической фаз переходит из водной фазы в органическую до тех пор, пока в системе не наступит межфазное равновесие, при котором достигаются равновесные концентрации экстрагируемого вещества в водной и в органической фазах. При достижении межфазного равновесия скорость перехода растворенного вещества из водной фазы в органическую становится равной скорости перехода того же вещества из органической фазы в водную, т.е. осуществляется состояние динамического равновесия. После прекращения встряхивания обе жидкие фазы расслаиваются, причем тем быстрее, чем больше разница в плотности воды (водного раствора) и применяемого органического растворителя, плотность которого может быть как выше, так и ниже плотности воды.
При исследовании биологических жидкостей (кровь, моча, промывные воды) необходимость в первой стадии изолирования отпадает и сразу проводится экстракция в органический растворитель.
5.2.1. Факторы, влияющие на эффективность изолирования «нелетучих» ядов из биоматериала
Эффективность изолирования веществ на I и II стадиях определяется рядом факторов.
На первой стадии на эффективность изолирования вещества будут влиять такие факторы, как:
1. Растворимость яда в используемом экстрагенте.
Поскольку на первой стадии используются полярные растворители (вода), яд должен находиться в водорастворимом (ионизированном) состоянии, т.е. кислоты и основания должны присутствовать в виде своих солей, а степень ионизации а > 100 %.
Необходимое для этого значение рН может быть рассчитано из уравнения степени ионизации Гендерсона. На практике пользуются более простым правилом. Для того, чтобы полностью перевести вещество в ионизированное состояние, необходимо создать
рН = рКа + 2 (3) – для кислот и рН = рКа – 2 (3) – для оснований.
Отсюда очевидно, что для переведения кислот в ионизированное состояние (т.е. в их соли) нужна щелочная реакция среды. Так, если для барбитуратов рКа = 7 – 8, то
рН = рКа + 2 (3) = (7 – 8) + 2 (3) = 10 и выше.
Для оснований же требуется кислая реакция среды. Так, для атропина
рК = рКа – 2 (3) = 9,6 – 3 = 6,6.
Слабоосновные алкалоиды полностью ионизированы уже в сильно кислой среде, например, для кофеина рН = 2,0 (рКа = 4,0).
Кислая реакция среды (рН = 2) приводит, кроме того, к разрушению комплексов алкалоидов с белками, в виде которых они находятся в биологическом материале, что увеличивает выход алкалоидов. Влияние рН на эффективность изолирования «нелетучих» ядов особенно выражено при использовании в качестве экстрагента воды, т.к. этанол в большинстве случаев является хорошим растворителем и для ионизированной, и для молекулярной форм кислот и оснований.
2. Экстрагент
Кроме реакции среды, на степень изолирования в значительной мере влияет природа экстрагента, его количество, время и кратность экстракции.
К экстрагенту предъявляются следующие основные требования:
· способность легко проникать в клетки тканей;
· высокая растворяющая способность (по отношению к яду);
· селективность (по отношению к анализируемым соединениям). Селективный растворитель в какой-то мере исключает загрязнение вытяжки балластными веществами – жирами, белками, пигментами и другими.
Растворители, которые обладали бы всеми этими свойствами в полной мере, встречаются редко. В химико-токсикологическом анализе наиболее часто используются следующие растворители: диэтиловый эфир, хлороформ, бензол, н-амилацетат, этилацетат, н-бутиловый, изоамиловый, изобутиловый спирты, н-гексан, н-гептан.
В большей мере этим требованиям отвечает вода, несколько в меньшей степени – этиловый спирт, который является почти универсальным растворителем для лекарственных веществ. Основным недостатком этанола является способность экстрагировать совместно с анализируемыми веществами нормальные компоненты биоматериала (белки, жиры, пигменты), что усложняет анализ, приводя к дополнительным методам очистки и потерям значительных количеств искомых веществ.
Количество экстрагента обычно берётся вдвое больше по отношению к весу органов (1 : 2). Большие количества экстрагента, хотя и увеличивают эффективность экстракции, приводят к разбавлению извлечения и усложнению последующих операций, связанных с концентрированием веществ в извлечении.
Время экстракции определяется моментом наступления равновесия в концентрациях вещества между твёрдой и жидкой фазами, что устанавливается экспериментально (по прекращению прироста концентрации вещества в экстрагенте). Для воды оно меньше (около 2 часов) по сравнению с этанолом (более 4 – 6 часов).
Кратность экстракции приводит к увеличению выхода вещества за счёт поступления новых порций растворителя. Для извлечения искомых соединений из внутренних органов возможны такие способы, как однократная и многократная экстракция, т.к. непрерывная экстракция требует специальной аппаратуры.
При использовании метода экстракции отсутствует химическое превращение разделяемых веществ и не образуются побочные продукты. Вещества, выделенные с помощью метода экстракции, как правило, не содержат примесей, связанных с процессами адсорбции и окклюзии. Этот метод может использоваться для разделения термолабильных веществ. Применение метода экстракции для концентрирования позволяет переводить вещества из сильноразбавленных растворов в небольшой объем органического растворителя.
3. Немаловажную роль в экстракции играет и степень измельчённости объекта, что обеспечивает максимальный доступ растворителя к искомому веществу (площадь соприкосновения твердой и жидкой фаз), но одновременно увеличивает количество соэкстрактивных веществ.
Вторая стадия изолирования «нелетучих» ядов заключается в выделении их из водного извлечения путём экстрагирования органическим растворителем, не смешивающимся с водой, при различных значениях рН среды. Этим достигается концентрирование вещества в извлечении и его частичная очистка от нормальных компонентов биоматериала (не растворимых в данном растворителе).
За счёт экстрагирования веществ вначале из кислого, а затем из щелочного водного раствора, их можно разделить на 2 подгруппы:
1. Вещества, экстрагируемые органическими растворителями из кислого раствора (вещества кислотного, нейтрального и частично слабоосновного характера).
2. Вещества, экстрагируемые из щелочного раствора (вещества основного и частично слабоосновного характера).
Вещества со слабо выраженными основными свойствами могут частично перераспределяться из одной подгруппы в другую. К ним относятся производные пурина: кофеин, теобромин, теофиллин; опийные алкалоиды: папаверин, наркотин; производные индола: бруцин, стрихнин; стероидоподобный алкалоид – вератрин; некоторые синтетические лекарственные средства: антипирин, амидопирин, промедол; производные фенотиазина – аминазин и др.
Для веществ нейтрального характера, не способных к ионизации, практически не требуется создания определённого значения рН, т.к. они экстрагируются органическим растворителем в молекулярной форме из любой среды. Разделение веществ на 2 подгруппы в значительной степени облегчает проведение последующего ненаправленного анализа с целью обнаружения неизвестного яда.
На второй стадии изолирования продолжают играть свою роль уже рассмотренные выше факторы, такие, как:
1) растворимость яда, которая определяется степенью ионизации а и регулируется величиной рН среды;
2) природа экстрагента, его объём, время и кратность экстракции.
Если на первой стадии изолирования веществ данной группы мы стремились перевести их в ионизированное состояние и сделать водорастворимыми, то на второй стадии наша задача заключается в том, чтобы перевести вещества в неионизированную (молекулярную) форму (а > 0), которая хорошо экстрагируется из водной фазы неполярным органическим растворителем. Необходимое для этого значение рН может быть рассчитано из уравнения, имеющего следующий вид:
рН = рКа – 2 (3) для кислот,
рН = рКа + 2 (3) для оснований.
Понятно, что для веществ кислого характера на этой стадии требуется создание кислой среды, а для основных – щелочной.
В качестве экстрагентов веществ из водной фазы подбирают неполярные органические растворители, которые:
а) не смешиваются с водой и по удельному весу (d) значительно отличаются от нее, что предотвращает образование эмульсий в процессе экстрагирования (d = 1,0);
б) имеют низкую температуру кипения, что облегчает их упаривание из экстракта;
в) хорошо растворяют изолируемое вещество и обеспечивают высокий коэффициент распределения его между водной и органической фазами
(Кр = Со/Св).
Коэффициент распределения можно увеличить, добавив в водную фазу электролит, который способствует вытеснению вещества из водной фазы в слой органического растворителя за счет понижения его растворимости в воде (разрушение сольватной оболочки молекул). В качестве электролита используют натрия сульфат, аммония сульфат, натрия хлорид. По данным проф. В.Ф. Крамаренко, наиболее подходящим электролитом при изолировании алкалоидов является аммония сульфат.
Наличие электролита в водной фазе приводит также к осаждению белков, что служит своеобразной очисткой полученного извлечения. Избыточное количество электролита, особенно при изолировании соединений кислотного характера, может привести к значительным потерям искомых веществ за счёт их осаждения.
Исходя из перечисленных выше требований, наиболее подходящим экстрагентом для веществ кислотного характера является эфир, а для веществ основного характера хлороформ.
4. Объём экстрагента, время и кратность экстракций.
Необходимый объём экстрагента при однократной экстракции можно рассчитать, исходя из уравнения степени экстракции (Е):
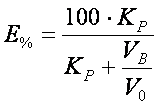
где:
КP – коэффициент распределения;
VВ – объём водной фазы;
V0 – объём органической фазы.
Время экстракции обычно не превышает 5 минут, т.к. экспериментально доказано, что за этот период времени большинство органических соединений переходит из водной в органическую фазу.
Кратность экстракции обычно составляет 2 – 3, что обеспечивает полноту извлечения вещества за счёт поступления свежих порций растворителя.
Влияние температуры на экстракцию. Изменение температуры влияет на константу распределения экстрагируемого вещества. Это объясняется тем, что при изменении температуры изменяется растворимость экстрагируемых веществ в каждой фазе, а также изменяется взаимная растворимость органической и водной фаз. Причем с изменением температуры растворимость вещества в каждой фазе изменяется неодинаково.
При изменении температуры может изменяться диссоциация и ассоциация вещества в соответствующей фазе. Поэтому при изменении температуры изменяется гидратация (сольватация) и экстрагируемость химических соединений.
Влияние электролитов на экстракцию. Понижение растворимости веществ в водных растворах под влиянием электролитов называется высаливанием, а повышение растворимости – всаливанием.
Высаливание является фактором, понижающим растворимость веществ в воде и повышающим их экстрагируемость органическими растворителями из водных растворов.
5.1.2. Очистка изолируемых веществ от сопутствующих компонентов
При изолировании ядовитых веществ из биоматериала совместно с ними экстрагируются т.н. соэкстрактивные вещества – примеси белков, продуктов их гидролиза – пептидов и аминокислот, липидов и ряда других соединений, которые являются естественными компонентами биоматериала.
Соэкстрактивные вещества в дальнейшем мешают проведению анализа:
1. Маскируют окраску при проведении реакций окрашивания (обугливание соэкстрактивных веществ под действием концентрированной серной кислоты).
2. Снижают чувствительность микрокристаллических реакций и приводят к образованию кристаллов неправильной формы, либо к их полиморфизму (многообразие форм).
3. Искажают спектры веществ при спектральном исследовании в УФ - и ИК-областях.
4. Дают искаженные результаты количественного определения веществ.
5. Многие продукты гнилостного разложения биоматериала дают такие же реакции, как и некоторые ядовитые вещества (например, трупные алкалоиды – путресцин, кадаверин – дают реакции с общеалкалоидными реактивами).
Для получения надежных результатов необходима очистка исследуемых веществ от соэкстрактивных веществ биоматериала. Очистка может быть проведена при подготовке объекта, в процессе изолирования или после него.
На 1 этапе изолирования возможна только грубая очистка, которая проводится путем:
1 – удаления механических загрязнений (мелких частиц биоматериала) фильтрованием, центрифугированием;
2 – осаждения примесей при добавлении соответствующих реагентов, например, осаждение белков абсолютным спиртом, ацетоном, трихлоруксусной кислотой, вольфрамовой, фосфорно-вольфрамовой, фосфорно-молибденовой кислотами, насыщение электролитами (Na2SO4, (NH4)2SO4, NaCI). При этом возможно соосаждение искомых веществ, что ведет к их частичной потере;
3 – изменения состава фаз, т.е. введения другого органического растворителя (связано с большими потерями веществ).
На 2 этапе изолирования или после него возможна более тонкая очистка, которая может осуществляться путем:
1 – реэкстракции, т.е. переведения веществ из одной жидкой фазы в другую при изменении рН раствора (например, очистка барбитуратов и алкалоидов за счет различной растворимости их солеобразных и молекулярных форм в воде и органических растворителях). При этом примеси отделяются от экстрагируемого вещества за счет нерастворимости в используемом экстрагенте. Либо, наоборот, экстрагирование примесей из раствора подходящим экстрагентом (эфир в методе В.Ф. Крамаренко).
2 – сублимации – для веществ, способных возгоняться без разложения при нагревании (салициловая, бензойная кислоты, барбитураты, жидкие алкалоиды).
3 – хроматографии – ионообменной, гель-хроматографии, адсорбционной хроматографии на колонках, тонкослойной хроматографии. Последний вид хроматографии используется часто, т.к. наряду с очисткой дает возможность разделить вещества (их метаболиты) при комбинированных отравлениях и провести их предварительную идентификацию по величинам Rf (хроматографический скрининг «нелетучих» ядов).
5.2.1.ОБЩИЕ И ЧАСТНЫЕ МЕТОДЫ ИЗОЛИРОВАНИЯ
В зависимости от поставленной перед экспертом–химиком задачи, судебно–химическое исследование может носить общий или частный характер, т.е. анализ может быть ненаправленным (общим) или направленным (частным).
Частное исследование предусматривает проведение анализа на какое–то определенное вещество или группу веществ. Например, на производные барбитуровой кислоты, на алкалоиды или даже на одно конкретное вещество. При частном исследовании метод изолирования подбирается с учётом физико–химических свойств того соединения (или группы соединений), на которое производится анализ.
Общий анализ включает исследование на несколько групп веществ (3 группы), подлежащих обязательному судебно–химическому исследованию, в том числе и на группу «нелетучих» ядов. В этом случае используются общие для всей группы веществ (универсальные) методы изолирования.
Общими методами изолирования «нелетучих» ядов являются:
1. Изолирование подкисленным этанолом.
2. Изолирование водой, подкисленной щавелевой кислотой.
Первые два метода вначале были разработаны для алкалоидов, а затем применены и к другим веществам.
3. Изолирование нейтральным ацетоном.
5.2.1.1. Изолирование подкисленным этанолом
Самый первый метод изолирования подкисленным спиртом, названный по имени авторов метода Стаса – Отто, применялся только для алкалоидов. В дальнейшем это метод претерпел серьёзные изменения и стал использоваться не только для алкалоидов, но и для многих других ядовитых и сильнодействующих веществ, имеющих токсикологическое значение.
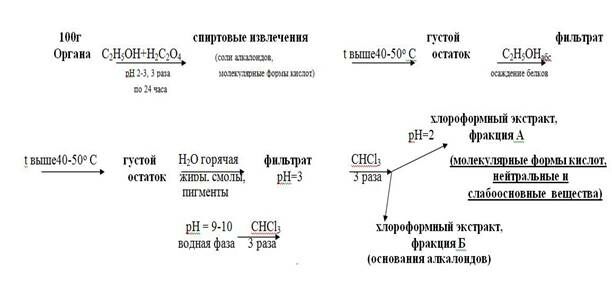
Современная модификация метода состоит из этапов:
• Настаивание измельчённого объекта с этиловым спиртом, подкисленным щавелевой кислотой до рН 2 – 3, в течение суток. Спирт берётся в количестве, необходимом для покрытия объекта до «зеркала». Спиртовое извлечение сливается и вся операция повторяется трехкратно.
• Упаривание объединённых спиртовых извлечений при температуре 40 – 50 0С до густого остатка, в который по каплям добавляют абсолютный этанол для коагуляции белков. Осадок отфильтровывают и всю операцию осаждения повторяют по мере необходимости до полного удаления белковых соединений.
• Упаривание фильтрата при той же температуре до густого остатка и разбавление горячей водой для удаления смолистых веществ, жиров и пигментов. Осадок отфильтровывают.
• Экстрагирование веществ кислого, нейтрального и слабоосновного характера из водного фильтрата хлороформом при рН = 2 (трёхкратная экстракция), отделение органической фазы и концентрирование полученного извлечения упариванием (фракция А, «кислое» извлечение).
• Подщелачивание оставшегося после разделения фаз водного слоя до рН 9 – 10, экстрагирование веществ сильноосновного характера (трёхкратная экстракция) хлороформом, отделение органической фазы и концентрирование упариванием (фракция Б, «щелочное» извлечение).
• Изолирование «нелетучих» ядов из биологического материала подкисленным спиртом (метод Стаса-Отто) проводится по следующей схеме:
Рисунок 1. Схема проведения анализа методом «Стаса-Отто»
Достоинства метода заключаются в следующем:
1. Метод универсален, т.к. этанол является хорошим растворителем для многих веществ этой группы (как ионизированных, так и молекулярных форм).
2. Метод предусматривает очистку извлечения от балластных веществ, в результате чего получаются чистые хлороформные извлечения, не дающие эмульсий при экстрагировании веществ из водной фазы хлороформом. Метод даёт возможность изолировать до 30 % барбитуратов и 20 – 25 % алкалоидов.
К недостаткам метода следует отнести:
1. Длительность (8 – 10 рабочих дней) и многостадийность. Большое количество операций, связанных с осаждением белков и фильтрованием, ведёт к значительным потерям искомых веществ (алкалоиды теряются на 25 – 50 %).
2. Сравнительная дороговизна метода (на 1 исследование тратится до 500 мл этанола).
Все это приводит к тому, что классический метод Стаса – Отто теряет своё былое значение и постепенно заменяется более быстрыми, эффективными и экономными методами извлечения подкисленной водой.
В настоящее время метод применяется, главным образом, для исследования гнилостно изменённого биологического материала.
5.2.1.2. Изолирование водой, подкисленной щавелевой кислотой
Идея изолирования подкисленной водой высказывалась разными исследователями. Так, ещё в 1856 году С. Макадам предложил для подкисления воды использовать щавелевую кислоту, в 1861 г. Усляр и Эрдман – соляную, а в 1865 г. Г. Драгендорф – серную. Вплоть до 1941 г. водный метод не получал широкого распространения. В 1942 – 1943 г.г. Степановым А.В. и Швайковой М.Д. был предложен метод изолирования алкалоидов из объектов растительного происхождения водой, подкисленной щавелевой кислотой (ускоренный метод). В 1947 – 49 г.г. этот метод был применён А.А. Васильевой к трупному материалу, после чего он вошёл в практику судебно–химического анализа в отечественных лабораториях.
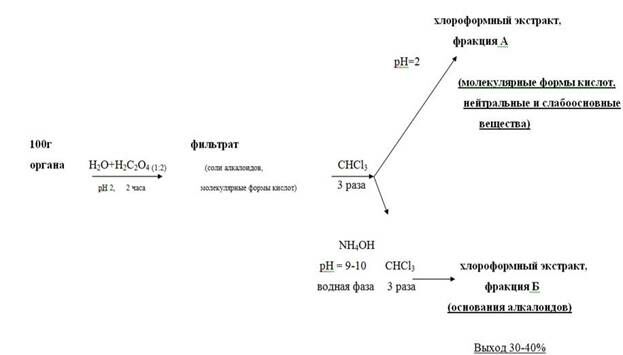
Схема изолирования по методу Васильевой заключается в следующем:
• Настаивание измельчённого объекта с водой, подкисленной щавелевой кислотой до рН = 2 – 3, в течение двух часов. Вода берётся в количестве 1 : 2 по отношению к навеске объекта. Водное извлечение фильтруется.
• Экстрагирование веществ кислого, нейтрального и слабоосновного характера из водного фильтрата хлороформом при рН = 2 (трёхкратная экстракция), отделение органической фазы и концентрирование полученного извлечения упариванием (фракция А, «кислое» извлечение).
Подщелачивание оставшегося после разделения фаз водного слоя раствором аммиака до рН 9 – 10, экстрагирование веществ основного характера трёхкратной экстракцией хлороформом, отделение органической фазы и концентрирование упариванием (фракция Б, «щелочное» извлечение).
По сравнению с изолированием подкисленным спиртом извлечение водой, подкисленной щавелевой кислотой, обладает рядом преимуществ:
1. Быстрота (анализ можно провести в течение одного рабочего дня).
2. Меньшее количество операций, меньшие потери искомых веществ (алкалоиды извлекаются на 30 – 40 %).
3. Экономичность и дешевизна, т.к. дорогой спирт заменён водой.
Недостатком метода является образование стойких эмульсий при экстрагировании веществ из водной фазы хлороформом, особенно при исследовании гнилостного биоматериала, т.к. метод не предусматривает очистки извлечений
Рисунок 2. Схема проведения анализа методом Васильевой
5.2.1.3. Изолирование нейтральным ацетоном
Метод предложен проф. Карташовым В.А. (г. Барнаул) в 1990 году.
Измельченную навеску биологического материала массой 5 г экстрагируют 10 мл ацетона в течение 10 минут, центрифугируют. Полученное извлечение сливают, операцию экстрагирования ацетоном повторяют ещё 2 раза по 5 мл. Извлечения объединяют.
К объединенному извлечению добавляют 20 мл 0,5 М. раствора хлористоводородной кислоты, перемешивают и экстрагируют гексаном дважды. Гексановые извлечения, содержащие примеси, отбрасывают.
Из очищенного водно-ацетонового извлечения (рН=1) эфиром экстрагируют вещества кислотного характера. Далее водно-ацетоновую фазу подщелачивают аммония гидроксидом до рН=9, добавляют 5 г натрия хлорида (высаливающий агент) и экстрагируют вещества основного характера эфиром.
Преимущество метода:
1. Высокий выход ядовитых веществ (до 60-70%). Это достигается за счет использования в качестве экстрагента нейтрального ацетона, который извлекает вещества кислотного и основного характера как в ионизированной, так и в молекулярной формах. Высокий выход веществ позволяет уменьшить массу навески до 5 граммов, что упрощает операции и снижает расход реактивов и времени пробоподготовки.
Недостатки метода:
Ацетон, извлекает из биоматериала большое количество примесей, что требует дополнительной очистки извлечения. К недостаткам метода относится и его многостадийность.
5.2.1.4. Твердофазная экстракция
Лекарственные и наркотические средства, поступающие на исследование, крайне редко являются индивидуальными соединениями. Нередко объектами исследования являются поступающие из незаконного оборота синтетические наркотические средства, которые производятся в подпольных лабораториях. В подавляющем большинстве случаев они имеют в своем составе различные наполнители и добавки (сахар, соли жирных кислот, крахмал, сода, тальк и др.), либо содержат загрязнения или промежуточные и побочные продукты синтеза, содержание же наркотически активного компонента в таких препаратах очень низкое.
При этом разделение, выделение, концентрирование и очистка целевых компонентов традиционными методами (например, жидкостной экстракцией) неэффективны, а иногда просто невозможны. Решение такого рода проблем возможно при применении на стадии пробоподготовки метода твердофазной экстракции, позволяющего осуществлять одновременное разделение, выделение и концентрирование целевых компонентов из биологических жидкостей и их экстрактов, лекарственных и нативных наркотических средств. Такой подход дает возможность получения веществ в чистом виде, что в дальнейшем позволяет проводить идентификацию методами ИК -, УФ – спектроскопии, ТСХ, ГЖХ, ВЭЖХ, методом хромато-масс-спектрометрии.
В основе метода твердофазной экстракции лежит принцип колоночной хроматографии, который основан на специфическом взаимодействии выделяемого из биоматериала компонента с сорбентом, находящимся в небольшом патроне. Патрон – картридж имеет полиэтиленовую оболочку, внутри которой находится сорбент, упакованный между двумя пористыми фильтрами. Патроны могут соединяться друг с другом, представляя более широкие возможности для их использования. Чаще всего для заполнения патронов применяют сорбенты на основе силикагеля и химически модифицированного силикагеля. Для модификации силикагеля используются вещества, содержащие различные функциональные группы (нитрильные, диольные, амино-, карбокси - и сульфогруппы), а также алифатические (С1 – С18) и ароматические (фенильные) группы. Выбор соответствующего типа патрона связан со свойствами определяемого вещества и осуществляется по типу подобия.
Часто в практике ХТА используются отечественные патроны фирмы “Диапак”, заполненные немодифицированным силикагелем (Диапак Силикагель) и силикагелем, модифицированным гексадецильными группами С16 (Диапак С16).
При использовании патронов Диапак для большинства веществ проводят следующие операции.
1. Активация – приведение патрона в рабочее состояние путем промывки этиловым или метиловым спиртом (2-10 мл). Скорость пропускания 2,5 мл/мин.
2. Кондиционирование – пропускание буферного раствора (ацетатного или аммиачного) в зависимости от исследуемых веществ. Объем буферного раствора – 10 мл. Скорость пропускания 2,5 мл/мин .
3. Сорбция – пропускание исследуемого раствора через патрон. Объем пробы обычно 100 мл. Скорость пропускания 2,5 мл/мин.
4. Десорбция – удаление исследуемого вещества с сорбента с помощью воздуха шприцем или вакуумным насосом.
5. Элюирование образца осуществляется реагентом, который применялся на стадии активации. Объем элюента – 50-100 мл.
Высокая эффективность выпускаемых патронов позволяет использовать их для пробоподготовки широкого круга объектов – от лекарственных препаратов сложного состава до “уличных наркотиков” и биологических жидкостей (моча, кровь, сыворотка и т. д.), а также экстрактов биологических жидкостей.
Частные методы изолирования веществ кислотного характера
• изолирование барбитуратов подщёлоченной водой (метод П. Валова);
• метод Е. Грусц-Харди.
5.2.1.5. Изолирование барбитуратов подщелоченной водой (метод П. Валова)
Изолирование барбитуратов подщелоченной водой схематично можно представить следующим образом:
• Настаивание измельчённого объекта с водой, подщелоченной 20% раствором натрия гидроксида до рН = 12 и более в течение 30 мин.
• Очистка водного извлечения путём насыщения натрия вольфраматом, фильтрование раствора.
• В кислой среде (серной кислотой до рН=2), экстрагирование эфиром, концентрирование эфирного извлечения упариванием.
Выход 50% и более
Выход составляет 50% и даже до 90%, в зависимости от вида барбитурата. Метод даёт достаточно чистые извлечения, т.к. включает стадию очистки (осаждение белков натрия вольфраматом), что повышает качество последующего анализа.
Недостатком метода является соосаждение барбитуратов с белками при обработке натрия вольфраматом. В последней модификации метода серная кислота заменена на натрия гидросульфат, что увеличивает выход искомых веществ.
Рисунок 3. Схема проведения анализа методом П. Валова

Измельченный биологический материал растирают с сульфатом аммония, подкисляют раствором хлористоводородной кислоты до рН=2, экстрагируют смесью этилового спирта и хлороформа (1:1). Экстракт отделяют, выпаривают, сухой остаток растворяют в горячей воде и фильтруют. Из фильтрата экстрагируют вещества кислотного характера эфиром.
Частные методы изолирования веществ основного характера
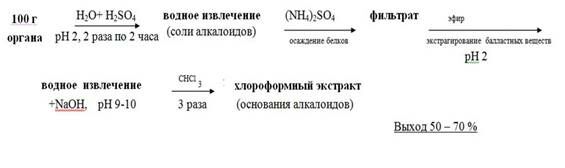
5.2.1.7. Частный метод изолирования алкалоидов водой, подкисленной серной кислотой (по В.Ф. Крамаренко)
Метод был разработан Львовской школой судебных химиков под руководством заведующего кафедрой аналитической и токсикологической химии Львовского медицинского института проф. В.Ф. Крамаренко. В 1956 – 62 г.г. целый ряд работ химиков этой школы был посвящён влиянию рН среды, природы экстрагента и присутствия в водной фазе электролита на эффективность изолирования алкалоидов из биоматериала.
Схематично метод можно представить из следующих этапов:
• Настаивание измельчённого объекта с водой, подкисленной 20% раствором кислоты серной до рН =2– 3, в течение двух часов. Вода берётся в количестве 1 : 2 по отношению к навеске объекта. Водное извлечение фильтруется. Операция повторяется двукратно.
• Очистка водного извлечения от белковых соединений путём насыщения его аммония сульфатом, настаивания в течение часа и фильтрования образовавшегося осадка.
• Очистка фильтрата от жиров, смол, пигментов путём экстракции эфиром. Эфирное извлечение отбрасывают.
• Подщелачивание водного извлечения 20% раствором натрия гидроксида и экстрагирование веществ основного характера хлороформом при рН =9–10 (трёхкратная экстракция), отделение органической фазы и концентрирование полученного извлечения упариванием.
Разработанный вначале для алкалоидов, метод применим и для изолирования других азотсодержащих веществ основного характера (синтетических лекарственных средств).
Метод достаточно быстрый. Преимуществом является хорошая очистка извлечений от соэкстрактивных веществ.
Рисунок 4. Схема проведения анализа методом В.Ф.Краморенко
Кроме указанных выше методов изолирования, для отдельных алкалоидов, таких, как жидкие алкалоиды – анабазин, никотин, кониин рекомендуется перегонка алкалоидов с водяным паром с последующим экстрагированием из дистиллята органическим растворителем. Для стрихнина и пахикарпина предложены такие методы, как электрофорез и электродиализ.
5.2.1.8. Исследование биологических жидкостей
1. При исследовании биожидкостей, таких как кровь, моча, плазма, слюна, сыворотка, промывные воды желудка, для изолирования «нелетучих» ядов используют прямую дробную жидкость – жидкостную экстракцию (ЖЖЭ).
Биожидкость подкисляют кислотой хлористоводородной до рН 2-3 и экстрагируют эфиром (фракция А), а затем подщелачивают до рН 9-10 и экстрагируют хлороформом (фракция Б). Во фракции А присутствуют вещества кислого, нейтрального и слабоосновного характера, во фракции Б – вещества основного характера.
ЖЖЭ соответствует второй стадии изолирования ядов из биоматериала в рассмотренных ранее общих методах, поэтому все факторы, определяющие эффективность изолирования на этой стадии, имеют место здесь.
Для некоторых веществ основного характера (морфин) при изолировании его из биожидкостей предварительно проводят кислотный гидролиз, чтобы разрушить его комплекс с глюкуроновой кислотой, в виде которого он находится в жидкостях. При прямой ЖЖЭ совместно с ядом из биожидкостей могут экстрагироваться сопутствующие вещества, что заставляет в дальнейшем прибегать к различным методам очистки.
В последнее время для изолирования ядов из биожидкостей применяется сорбция их на синтетических смолах, модифицированных силикагелях и активированном угле. Вещества сорбируются на твердом носителе, а потом элюируются из него органическим растворителем (по фракциям). Метод позволяет не проводить дополнительную обработку пробы и изолирование, дает возможность одновременно сконцентрировать вещество и провести очистку. Это приводит к повышению чувствительности метода. Однако, при неизвестном яде сорбция не всегда может быть использована ввиду опасности его потери из-за недостаточной сорбции.
5.3. АНАЛИТИЧЕСКИЙ СКРИНИНГ ЛЕКАРСТВЕННЫХ ВЕЩЕСТВ, ИМЕЮЩИХ ТОКСИКОЛОГИЧЕСКОЕ ЗНАЧЕНИЕ
1. Необходимость разработки аналитических скрининговых методов анализа вызвана многообразием лекарственных соединений, которые при определенных обстоятельствах могут стать источником отравлений. Круг этих веществ постоянно расширяется по мере синтеза новых соединений.
Рост числа отравлений лекарственными препаратами связан с самолечением, в результате чего имеют место случаи передозировки лекарств, проявление их побочного действия и развитие идиосинкразии.
Большую долю в общем числе отравлений лекарственными веществами составляют детские отравления. Определенный вклад вносят отравления, связанные с наркоманией и токсикоманией.
Клиническая диагностика острых отравлений лекарственными средствами затруднена из-за нехарактерных симптомов. Особенно трудно идентифицируются комбинированные и детские отравления, где природа яда чаще неизвестна. В связи с этим возникает необходимость в разработке «скрининговых» методов анализа, которые позволяли бы за короткое время выбрать из большого числа потенциальных ядов одно или несколько веществ, послуживших причиной отравления. «Скрининг» (англ.) – отсеивание, просеивание. Таким образом, СКРИНИНГ – это научно обоснованная система поиска неизвестного яда, когда в процессе последовательных операций поэтапно отсеиваются (или определяются) отдельные группы веществ или индивидуальные вещества.
Аналитический скрининг наиболее удобен и эффективен в случае аналитической диагностики комбинированных отравлений, а также при ненаправленном анализе, когда неизвестна природа определяемого вещества. Применение аналитического скрининга позволяет систематизировать исследование и направить его в нужное русло, сократив тем самым время анализа и материальные затраты на его проведение.
К аналитическим скрининговым методам предъявляются определенные требования:
-универсальность (возможность подвергнуть исследованию большое количество веществ);
- достаточная специфичность (чаще групповая);
- высокая чувствительность (до десятых долей мкг);
- экспрессность (возможность выполнения серийных анализов);
- точность (отклонение до 10%) и воспроизводимость;
- простота и доступность;
- лабильность (возможность оптимизации и модернизации за счет введения новых соединений, материалов, реагентов и оборудования в существующую систему скрининга);
- возможность сочетания с другими методами анализа.
Перечисленным требованиям удовлетворяют, в основном, современные физико-химические методы анализа:
1. Хроматографические.
2. Спектроскопические.
3. Иммунохимические.
Эти методы могут быть использованы в системе как общего, так и частного скрининга.
Общий скрининг – предусматривает, в основном, химическое исследование веществ, отличающихся по своему строению, и принадлежащих к различным фармакологическим группам. В основном здесь применяется групповая идентификация (например, группа производных барбитуровой кислоты, фенотиазина и т.п.)
Частный скрининг – направлен на исследование веществ внутри группы и идентификацию ее отдельных представителей. Примером может служить хроматографическое исследование на производные барбитуровой кислоты для идентификации конкретного вещества из этой группы.
5.3.2.Хроматографические скрининговые методы
Хроматографию можно рассматривать как метод разделения веществ, в основе которого лежит разница в коэффициентах распределения этих веществ между неподвижной и подвижной фазами.
В настоящее время в качестве методов хроматографического скрининга наибольшее применение находят:
1. Тонкослойная хроматография (ТСХ).
2. Высокоэффективная тонкослойная хроматография (ВЭТСХ).
3. Газожидкостная хроматография (ГЖХ).
4. Высокоэффективная жидкостная хроматография (ВЭЖХ).
5.3.2.1.Тонкослойная хроматография (ТСХ)
В ТСХ роль неподвижной фазы выполняет тонкий фиксированный слой сорбента (0,1-0,5 мм), содержащий определенное количество воды, нанесенный на пластинку из стекла (алюминиевой фольги, полимера). В качестве сорбентов чаще используется силикагель и окись алюминия. Для лучшего связывания сорбента в него добавляют связующий компонент – гипс, крахмал и др. Роль подвижной фазы выполняет индивидуальный растворитель или смесь растворителей, называемые «хроматорафической системой».
В процессе хроматографирования по мере подъема растворителя вверх по пластине за счет капиллярных сил происходит разделение смеси веществ согласно их коэффициентам распределения между подвижной и неподвижной фазами.
Детектирование (обнаружение) веществ на хроматограмме проводят следующим образом:
- визуально, если вещество имеет собственную окраску (дротаверин, клозапин, бензофеноны и др.),
- в УФ-свете – для веществ, обладающих флуоресценцией (свечением) или способных поглощать УФ-излучение (темные пятна на флуоресцирующем фоне),
- с помощью хромогенных реакций: бесцветные вещества переводят в окрашенные соединения, обрабатывая хроматографическую пластинку соответствующими реактивами.
Идентификацию веществ на хроматограммах проводят по коэффициенту Rf (скорость фракционирования).
Rf – это величина, численно равная отношению длины пробега анализируемого вещества к длине пробега растворителя:
Rf = Нв-ва / Нраств.
Rf является константой вещества в заданных хроматографических условиях при их строгом соблюдении. На практике соблюдение всех условий затруднено. Величина Rf может колебаться в зависимости от целого ряда факторов:
- техники выполнения работы,
- качества и активности сорбента,
- толщина слоя сорбента,
- чистоты растворителей,
- степени насыщения камеры парами растворителей,
- температуры,
- присутствия балластных веществ и проч.
Поэтому иногда принято пользоваться не абсолютным, а относительным значением Rf, которое обозначается как Rst.
Относительный коэффициент Rst. численно равен отношению абсолютной величины Rf исследуемого вещества к Rf метчика:
Rst = Rf в-ва / Rf метчика
В качестве метчика используется вещество, принятое за стандарт. Относительное значение Rf более воспроизводимо, т.к. с изменением хроматографических условий меняются значения Rf исследуемого веществ и вещества-стандарта, а их соотношение остается достаточно стабильным. При совпадении величин Rf исследуемого веществ и вещества-стандарта можно предположить их идентичность. В условиях скрининга Rf исследуемого вещества сравнивают с табличными данными, полученными в аналогичных условиях
Метод ТСХ широко распространен благодаря своей доступности и простоте выполнения, и в то же время высокой эффективности, чувствительности, экспрессности, достаточной специфичности.
ТСХ применяется в системе общего и частного скрининга и разработана для многих лекарственных веществ, имеющих токсикологичское значение.
В общем скрининге используется множество систем растворителей, из них можно выделить некоторые:
1. Для веществ кислого, нейтрального и слабоосновного характера, извлекаемых органическим растворителем из кислого водного раствора – хлороформ:ацетон (9:1).
2. Для веществ основного характера, извлекаемых органическим растворителем из щелочного водного раствора: диоксан:хлороформ:ацетон:25% раствор аммиака (47,5:45:5:2,5), ацетон:хлорофром:25% раствор аммиака (245:12:1).
3. При анализе наркотических и других одурманивающих веществ, при экспресс-анализе острых отравлений используют универсальную систему толуол:ацетон:этанол:25% раствор аммиака (45:45:7,5:2,5).
Для детектирования веществ на хроматографической пластинке разработана схема последовательного их проявления.
Для веществ кислого, нейтрального и слабоосновного характера:
- УФ-облучение,
- дифенилкарбазон в хлороформе и раствор сульфата ртути: проявляются производные барбитуровой кислоты;
- раствор хлорида железа трехвалентного: проявляются производные пиразолона, салициловой кислоты, фенотиазина;
- реакив Драгендорфа и 0,5 М серная кислота: проявляются азотсодержащие вещества слабоосновного характера.
Для веществ основного характера:
- УФ-облучение,
- раствор хлорида железа трехвалентного: проявляются производные пиразолона, фенотиазина;
- раствор натрия нитрата в кислоте хлорной: проявляются производные фенотиазина, тиоксантены;
- реакив Драгендорфа и 0,5 М серная кислота: проявляются азотсодержащие вещества основного характера.
Отдельная пластинка: реактив Марки (концентрированная кислота серная, содержащая 10% формалина): проявляются, в частности алкалоиды группы опия, дифенгидрамин, некоторые производные фенотиазина и др.
При обнаружении веществ в общих системах переходят к исследованию в частных системах растворителей.
Например:
Для барбитуратов – хлороформ:н-бутанол:25% раствор аммиака (70:40:5).
Для алкалоидов опия – этилацетат:метанол:25% раствор аммиака (17:2:1).
Разработанная методика проста, универсальна, может быть использована в клинико-диагностических лабораториях и Бюро судебно-медицинской экспертизы.
С помощью ТСХ можно определять вещества в количествах от 10-9 до 10-6 г, ошибка определения компонентов – 5-10 %.
Воспроизводимость результатов исследования методом ТСХ достигается проведением их при следующих условиях:
1. Инструментальные условия проведения эксперимента, которые включают конструкцию используемой хроматографической камеры; способ ее герметизации; условия насыщения камеры парами растворителя и т.д.
2. Свойства хроматографической системы, которые включают тип и способ химической обработки использованного сорбента; величину его зернения; толщину слоя, а также тип подложки, на которую он нанесен; вид и количество внесенных в адсорбент вспомогательных веществ, таких как связующие компоненты и флуоресцирующие вещества; метод активации сорбента, например, выдерживание при повышенной температуре; способ обработки пластинки импрегнирующими буферами, щелочами или кислотами, а также веществами, модифицирующими ее свойства.
3. 3. Методические подходы к нанесению пробы и проведению хроматографирования, которые предусматривают способ нанесения образца на пластинку и использованное при этом устройство; размер начальной зоны хроматографирования; полярность растворителя, использованного для нанесения образца и его количество; продолжительность исследования и величину пробега растворителя; его состав и чистоту; температуру и влажность окружающей среды в момент проведения исследования.
Представление результатов исследований. В экспертном заключении полученные рассматриваемым методом результаты должны содержать подробное описание условий проведения эксперимента: хроматографические пластины (адсорбент, наличие или отсутствие индикатора в его составе, использованное связующее вещество, тип подложки для адсорбента, фирма – изготовитель, а также проведение специальной обработки пластин перед исследованием, например, высушивание при повышенной температуре или импрегнирование щелочью или буфером). Схема обработки хроматографических пластин должна содержать описание использованных реактивов с их полным качественным и количественным составом, последовательности проведения этапов обработки, их интенсивности и продолжительности. Особо отмечается интенсивность и окраска хроматографических зон исследуемых веществ после обработки каждым реактивом, а также величина их Rf или RRf. При проведении подтверждающих исследований на конкретное вещество допускается указание о том, что в данных конкретных условиях величина Rf и окраска хроматографической зоны исследуемого вещества использованными реактивами совпадает с величиной Rf и окраской стандартного раствора - метчика. В заключении приводятся также данные о пределе обнаружения метода.
5.3.2.2. Высокоэффективная тонкослойная хроматография (ВЭТСХ)
ВЭТСХ появилась в начале 70-х г.г. прошлого столетия как новое направление в ТСХ. Имеет ряд преимуществ по сравнению с ТСХ:
ü более высокая эффективность (за 1 прием можно разделить около 40 веществ),
ü высокая чувствительность и экспрессность.
Высокая эффективность данного метода достигается за счет применения высокодисперсного сорбента, а более высокая чувствительность и экспрессность – более тонкого слоя сорбента (10-15 нм).
В качестве сорбентов применяются силикагель, окись алюминия, целлюлоза, метилцеллюлоза, полиамид, инактивированный силикагель и др.
Методы хроматографирования существенно не отличаются от ТСХ. Методы детектирования идентичны, только более чувствительны. Возможно проведение количественного анализа с применением метода сканирующей денситометрии, дающей точные результаты и не требующей элюирования веществ с пластинки.
ВЭТСХ, так же как и ТСХ, сочетают с другими физико-химическими методами анализа – спектральными, ГЖХ, ВЭЖХ, что повышает надежность исследования.
5.3.2.3. Газожидкостная хроматография (ГЖХ)
ГЖХ нашла свое применение в анализе лекарственных веществ в качестве скринингового метода благодаря своей универсальности. Необходимым условием является переведение исследуемого вещества в летучее состояние. Метод используется при анализе барбитуратов, алкалоидов и других лекарственных веществ в качестве общего и частного скринингового.
Идентификация веществ проводится по относительным временам удерживания (или индексам удерживания Ковача). Количественное определение – по высоте (площади) пиков исследуемого вещества и вещества, применяемого в качестве внутреннего стандарта.
Достоверность исследований повышается при использовании не менее 2 колонок, обладающих различной полярностью. Используемые детекторы – пламенно-ионизационный, масс-селективный.
5.3.2.4. Высокоэффективная жидкостная хроматография (ВЭЖХ)
ВЭЖХ (жидкостная хроматография высокого давления) является вариантом колоночной хроматографии, где элюент подается в колонку под высоким давлением, что ускоряет проведение анализа. Разделение веществ проводится на колонках, заполненных мелкодисперсным сорбентом.
При работе с колонками, заполненными силикагелем, в качестве элюента используются углеводороды, иногда с добавлением небольшого количества спирта или других растворителей (нормальнофазный вариант).
В обращеннофазном варианте к силикагелю прививают гидрофобную фазу – обычно это углеводороды с большим числом углеродных атомов, например, С18, в этом случае в качестве элюента используются смеси метанола или ацетонитрила с водой или буферными растворами.
В качестве детекторов обычно применяют детектор с переменной (от 190 до 900 нм) или с фиксированной длиной волны. Могут быть использованы и другие детекторы – рефрактометрический, флуорометрический, ионизационно-пламенный, электрохимический, диодно-матричный, масс-селективный и т.п.
Выходящие из колонки вещества регистрируются на хроматограмме в виде ряда хроматографических пиков. Идентификацию веществ проводят по параметрам удерживания (время выхода) и спектральным отношениям на разных длинах волн по отношению к опорной (базовой). Количественное определение проводится по площади пика исследуемого вещества, которая прямо пропорциональна количеству вещества в пробе. При этом предварительно строится калибровочный график с использованием методов абсолютной градуировки или внутреннего стандарта.
Метод ВЭЖХ может быть использован в качестве общего и частного скрининга. Он позволяет сочетать изолирование и очистку вещества с его идентификацией и количественным определением.
Значительным преимуществом этого метода перед ГЖХ является возможность анализа термолабильных нелетучих соединений с малой и большой молекулярной массой. Особенно удобен метод ВЭЖХ для работы в клинических лабораториях токсикологических центров при исследовании билогических жидкостей.
5.3.3. Спектральные скрининговые методы
Для скрининга лекарственных средств могут быть применены:
1. Абсорбционная спектроскопия в видимой и УФ-областях спектра.
2. ИК-спектроскопия.
3. Спектроскопия ЯМР (ядерного магнитного резонанса).
4. МС (масс-спектрометрия).
Из перечисленных методов наиболее широко применяется метод абсорбционной спектроскопии в видимой и УФ-областях спектра. Это связано с его доступностью и в то же время достаточной информативностью, чувствительностью.
5.3.3.1. Абсорбционная спектроскопия
Поглощение (абсорбция) веществом света, т.е. потока фотонов или электромагнитного излучения, в видимой или УФ-области спектра связано с переходом электронов внешних орбиталей (валентных электронов) из основного состояния (с меньшей энергией) в возбужденное состояние (с большей энергией). При этом энергия поглощенного фотона:
D Е = Е1- Е0, где
D Е – энергия поглощенного фотона,
Е1 – энергия электрона в возбужденном состоянии,
Е0 - энергия электрона в основном состоянии.
D Е = h .v = h . c/ l, где
h –постоянная Планка,
v – частота излучения,
v – скорость света,
l - длина волны.
Поскольку h и c – величины постоянные, очевидно, что энергия поглощенного излучения будет обратно пропорциональна l.
Согласно хромофорно-ауксохромной теории избирательным поглощением в видимой и УФ-областях спектра обладают вещества, имеющие в своей структуре определенные группы атомов – хромофоры.
Хромофоры содержат одну или несколько кратных (двойных) связей или неподеленные пары электронов, например:
C=C – этиленовая группа,
С=О – карбонильная группа,
N=O – нитрозогруппа,
N=N – диазогруппа,
C=N – азометиновая группа,
C6H6 – бензольное ядро.
Иногда в молекуле наряду с хромофорами находятся ауксохромные группы, которые не обладают собственным поглощением, но усиливают поглощение хромофоров. К таким группам относятся:
- NH2 – аминогруппа,
- OH – гидроксильная группа,
- OCH3 – метоксигруппа,
- N(CH3)2 – диметиламиногруппа,
- Cl, Br, F, I –галогены.
Идентификацию веществ в условиях скрининга проводят по спектрам поглощения. Кривая зависимости светопоглощения от длины волны l называется спектром поглощения и является качественной характеристикой вещества.
Характер спектра может меняться в зависимости от:
- природы растворителя,
- рН раствора для веществ, способных к ионизации, если молекулярная и ионизированная формы обладают различным светопоглощением.
Получение спектров поглощения в различных условиях повышает информативность метода.
Наряду с идентификацией веществ по характеру спектра можно провести их количественное определение, измеряя интенсивность поглощения в области максимума. Расчет концентрации вещества проводят по уравнению Бугера-Ламберта-Бера:
D = Е * L * C, где
D – оптическая плотность,
Е – удельный показатель поглощения 1% раствора при толщине слоя 1 см,
L – толщина светопоглощающего слоя,
C – концентрация вещества (%).
Измерение абсорбции D проводят на спектрофотометрах различных моделей, дающих монохроматическое излучение, т.к. закон Бера справедлив только для монохроматического излучения.
При проведении скрининга сравнивают спектры поглощения исследуемого вещества со спектрами эталонов.
Достоинства спектральных методов анализа:
- универсальность, позволяющая анализировать различные классы химических соединений,
- высокая чувствительность (мкг),
- информативность.
К недостаткам метода можно отнести необходимость высокой степени чистоты исследуемых веществ, поэтому рекомендуется сочетать спектральные методы анализа с предварительной очисткой веществ, например, с помощью ТСХ или других методов.
5.3.4. Иммунохимические методы в скрининге лекарственных веществ. Иммунохимический анализ (ИХА)
Современные иммунохимические методы анализа лекарственных и наркотических средств отличаются такими особенностями, как высокая чувствительность, специфичность, экспрессность, простота выполнения. Реакция проводится непосредственно в биожидкости, поэтому не требуется применять изолирования и дополнительной очистки. Методы ИХА позволяют одновременно анализировать большое число проб, поэтому они удобны для целей экспресс-диагностики.
В то же время, широкое применение этих методов сдерживается тем, что для них требуются особые реагенты (особо чистые сыворотки, ферменты и т.п.), которые необходимо закупать у иностранных поставщиков.
В основе всех методов ИХА лежит специфическая реакция «антиген – антитело», где антигеном является определяемое вещество, чужеродное для организма. При введении в живой организм чужеродного соединения (антигена АГ) образуются антитела АТ, которые сразу связываются с антигеном. Образующийся комплекс АГ+АТ выпадает в осадок. Реакция АГ+АТ является специфичной и протекает количественно, что используется и для целей количественного определения.
Для детектирования результатов реакции один из компонентов (антиген или антитело) метят специальной меткой.
Таблица 1. Зависимость природы метки и способа ее детектирования от различных видов ИХА
| Метод | Способ детектирования |
| Радиоиммунный анализ (РИА) | Радиоактивность |
| Иммуноферментный анализ (ИФА) | Ферментная активность |
| Рекомендуем посмотреть лекцию "Деятельность человека, ее строение и виды". Поляризационный флюороиммуноанализ (ПФИА) | Интенсивность флюоресцентной поляризации |
| Люминесцентный иммуноанализ (ЛИА) | Интенсивность люминесценции |
Существуют и некоторые другие методы. Наибольшее распространение в химико-токсикологическом анализе лекарственных и наркотических средств получили РИА и ИФА. В ИФА в качестве метки для антигенов (определяемых веществ) используются ферменты. Как правило, это различные оксидазы, способные окислять специальное химическое вещество – хромогенный субстрат, с образованием окрашенных продуктов. По интенсивности окраски и судят о количестве искомого вещества.
В РИА используется аналогичный принцип, только в качестве метки используется радиоактивный изотоп. Измеряя радиоактивность выделившегося изотопа, определяют количество искомого вещества.





















