Первое начало термодинамики с точки зрения статистической физики. Статистическое определение энтропии
1.4. Первое начало термодинамики с точки зрения статистической физики. Статистическое определение энтропии
Первое начало термодинамики для бесконечно малых величин может быть записано в виде:
 .
.
Внутренняя энергия:  т.е. это среднее значение микроскопической внутренней энергии
т.е. это среднее значение микроскопической внутренней энергии
 (*),
(*),
где  – дифференциал по а и Т.
– дифференциал по а и Т.
Введем микроскопические (зависит от Х) силы, соответствующие обобщенным координатам  :
:
 .
.
Отметим, что размерность этих сил может быть различной в зависимости от параметров  .
.
Рекомендуемые материалы
Термодинамические силы  определяются как средние от микроскопических сил:
определяются как средние от микроскопических сил:  .
.
Работа в термодинамике может быть определена как:
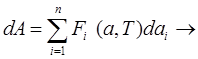
первый член (*) равен работе термодинамических сил
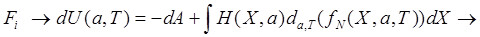
 (**).
(**).
Вполне понятно, что работа связана с изменением внешних параметров, поскольку они не дают вклада в кинетическую энергию, то должны дать вклад в потенциальную.
То есть  определяется изменением функции распределения вследствие изменения термодинамических переменных а, Т.
определяется изменением функции распределения вследствие изменения термодинамических переменных а, Т.
Из условия нормировки:
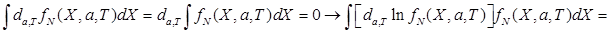
 . (***)
. (***)
В выражении (**) разделим и умножим на  и вычтем выражение
и вычтем выражение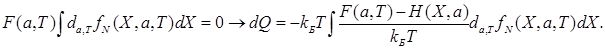
Используем каноническое распределение Гиббса:
 с учетом
с учетом  – вынесем за интеграл
– вынесем за интеграл  →(***).
→(***).
 .
.
Из определения энтропии в термодинамике:  .
.
Если приравнять величину  в каноническом распределении Гиббса к термодинамической температуре, то, сравнивая
в каноническом распределении Гиббса к термодинамической температуре, то, сравнивая  , получим:
, получим:
 ,
,
где  – константа, которая может быть определена только в квантовой статистической теории. Или:
– константа, которая может быть определена только в квантовой статистической теории. Или:  .
.
Из термодинамики свободная энергия определяется как:
 .
.
Таким образом, действительно функция  в каноническом распределении Гиббса совпадает со свободной энергией, определенной в термодинамике. Зная сводную энергию, можно вычислить основные термодинамические параметры:
в каноническом распределении Гиббса совпадает со свободной энергией, определенной в термодинамике. Зная сводную энергию, можно вычислить основные термодинамические параметры:
 .
.
Люди также интересуются этой лекцией: 2 Становление конфликтологии как науки.
Отсюда:
 ,
,  .
.
С другой стороны можно определить теплоемкость:
 .
.
Таким образом, основной алгоритм, на котором основана равновесная СФ, выглядит так:
 .
.




















