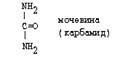Часть 5
ДЕЗАМИНИРОВАНИЕ АМИНОКИСЛОТ
У человека происходит в основном путем окислительного дезаминирования. Эти реакции протекают с помощью двух ферментов:
- оксидаза Д-аминокислот
- оксидаза L-аминокислот
|
|
Эти ферменты обладают групповой стереоспецифичностью. Оксидазы отнимают протоны и электроны от аминокислот с помощью такого же механизма, как и оксидазы, обеспечивающие дезаминирование биогенных аминов. Эти ферменты являются флавопротеинами и содержат в качестве простетической группы ФАД или ФМН:
На первой стадии образуется иминокислота, а затем, после спонтанного гидролиза образуется альфа-кетокислота.
Кроме оксидаз имеется еще один фермент, катализирующий окислительное дезаминирование глутаминовой кислоты - глутамат-дегидрогеназа (глутаматДГ).
Этот фермент является НАД-зависимым и обладает высокой активностью (как и другие НАД-зависимые дегидрогеназы). В этом его отличие от оксидаз аминокислот, которые медленно превращают аминокислоты в физиологических условиях (поэтому в клетке сохраняется большинство аминокислот). Так как глутамат-ДГ является никотинамидной, то отнимаемые протоны и электроны не передаются сразу на кислород, а транспортируются по полной цепи МтО с образованием воды и параллельным образованием трех молекул АТФ.
Рекомендуемые материалы
 Глутамат-ДГ обладает высокой активностью и этим отличается от МАО и ДАО. Глутамат-ДГ является регуляторным ферментом - он ингибируется избытком АТФ, и активируется избытком АДФ.
Глутамат-ДГ обладает высокой активностью и этим отличается от МАО и ДАО. Глутамат-ДГ является регуляторным ферментом - он ингибируется избытком АТФ, и активируется избытком АДФ.
БИОЛОГИЧЕСКОЕ ЗНАЧЕНИЕ РЕАКЦИЙ ДЕЗАМИНИРОВАНИЯ
1. Реакции дезаминирования необратимы, как и реакции декарбоксилирования - дезаминирование тоже может играть роль первого этапа на путях распада аминокислот.
2. Один из непосредственных продуктов дезаминирования -конечный продукт метаболизма аммиак. Это токсическое вещество. Поэтому клетки должны затрачивать энергию, чтобы обезвредить аммиак до безвредных продуктов, которые выводятся из организма.
3. Другой продукт реакции дезаминирования - альфа-кетокислота.
Все образующиеся альфа-кетокислоты легко расщепляются дальше до СО2 и Н2О (например, аланин превращается в ПВК (путем дезаминирования; аспартат - в ЩУК; глутаминовая кислота - в альфа-кетоглутаровую). Большинство альфа-кетокислот тем или иным путем превращаются в кислоты, которые являются промежуточными метаболитами ЦТК:
- в альфа-кетоглутаровую;
- в янтарную;
- фумаровую;
- щавелево-уксусную. Все эти метаболиты могут в организме трансформироваться в углеводы, перед этим превращаясь в ПВК. Поэтому большинство аминокислот относится к группе, которая называется ГЛЮКОГЕННЫМИ АМИНОКИСЛОТАМИ (их 17). Только 3 аминокислоты не могут превращаться в ПВК, но превращаются в Ац-КоА - КЕТОГЕННЫЕ АМИНОКИСЛОТЫ: лейцин, лизин, триптофан). Они могут прямо трансформироваться в жирные кислоты или в кетоновые тела.
 Метаболические пути, в которые вступают аминокслоты после дезаминирования, уже не являются собственно путями метаболизма аминокислот, а являются универсальными и для аминокислот, и для углеводов, и для жиров.
Метаболические пути, в которые вступают аминокслоты после дезаминирования, уже не являются собственно путями метаболизма аминокислот, а являются универсальными и для аминокислот, и для углеводов, и для жиров.
ТРАНСАМИНИРОВАНИЕ
Эта реакция заключается в том, что аминокислота и кетокислота обмениваются друг с другом своими функциональными группами при альфа-углеродном атоме. В результате вступившая в реакцию аминокислота превращается в соответствующую альфа-кетокислоту, а кетокислота становится аминокислотой.
Эту реакцию катализируют ферменты под названием ТРАНСАМИНАЗЫ (АМИНОТРАНСФЕРАЗЫ). Коферментом всех трансаминаз является активная форма витамина В6 - пиридоксальфосфат (фосфопиридоксаль).
ГЛАВНЫЕ ОСОБЕННОСТИ РЕАКЦИИ ТРАНСАМИНИРОВАНИЯ:
1. Это циклический процесс, все стадии которого катализируются одним и тем же ферментом - трансаминазой данной пары кислот. В этот цикл вступает одна аминокислота и кетокислота (в приведенном примере - это глутамат и ПВК). Образуются другая альфа-кетокислота и аминокислота (в приведенном примере - альфа-кетоглутарат и аланин).
2. Все стадии этого процесса обратимы. Поэтому весь цикл в целом может протекать как в прямом, так и в обратном направлении. Направление этого цикла зависит от соотношения концентраций участников реакции - всех четырех кислот. Резко повысив концентрацию какой-либо одной из кислот, можно направить реакцию по определенному направлению.
3. Каждая трансаминаза обычно специфична для одной пары субстратов и соответствующей ей пары продуктов и все стадии реакции катализируются только одним ферментом. По участникам процесса для данного фермента дают ему название:
Фермент, который катализирует приведенную реакцию, можно назвать: Аланинаминотрансфераза (АлТ) (глутаминово-пировиноградная трансаминаза (ГПТ)).
4. Трансаминазы обычно обладают высокой субстратной специфичностью и высокой активностью. Наиболее активными в клетках являются те трансаминазы, для которых хотя бы один из субстратов является дикарбоновой альфа-кетокислотой - это АлТ - аланинаминотрансфераза (ГПТ) и АсТ - аспартатаминотрансфераза (ГЩТ).
Определение активности этих ферментов в сыворотке крови имеет важное значение в ДИФФЕРЕНЦИАЛЬНОЙ ДИАГНОСТИКЕ таких заболеваний, как ВИРУСНЫЙ ГЕПАТИТ и ИНФАРКТ МИОКАРДА.
АсТ и АлТ являются внутриклеточными ферментами. Поэтому в норме их активность в крови очень мала. При вирусном гепатите или при инфаркте миокарда наблюдается разрушение клеток печени или миокарда соответственно. Поэтому в крови будет наблюдаться повышение активности и АлТ, и АсТ, но неодинаковое для каждого из ферментов.
В клетках сердечной мышцы (миокарда) содержится гораздо больше АсТ, чем АлТ, а в клетках печени - наоборот: АлТ намного больше, чем АсТ. Поэтому ПРИ ИНФАРКТЕ МИОКАРДА АКТИВНОСТЬ АСТ в крови БУДЕТ ЗНАЧИТЕЛЬНО ВЫШЕ, ЧЕМ АЛТ, А ПРИ ВИРУСНОМ ГЕПАТИТЕ АКТИВНОСТЬ АЛТ БУДЕТ ВЫШЕ, ЧЕМ АСТ.
Поэтому определение активности этих ферментов в крови помогает врачам в постановке правильного диагноза.
БИОЛОГИЧЕСКАЯ РОЛЬ РЕАКЦИЙ ТРАНСАМИНИРОВАНИЯ.
1. ОБЕСПЕЧИВАЮТ СИНТЕЗ НОВЫХ АМИНОКИСЛОТ ИЗ ЧИСЛА ЗАМЕНИМЫХ. Из заменимых аминокислот также могут образоваться необходимые клетке кетокислоты.
Эта функция позволяет ругулировать содержание различных аминокислот в клетках организма (корректировка аминокислотного состава клеток).
В основе этой роли - полная обратимость реакции трансаминирования. Для характеристики направления каждой конкретной реакции трансаминирования и определения положения равновесия данной реакции вычисляют ее КОНСТАНТУ РАВНОВЕСИЯ (Кравновесия):

Для большинства реакций трансаминирования эта константа равновесия близка к единице.
 При избытке какой-либо из кислот соотношение быстро восстанавливается трансаминазой за счет другой пары. Недостающее количество какой-либо из кислот может быть взято клеткой из других метаболических путей (например, альфа-кетоглутарат может быть взят из ЦТК). Избыток какой-либо из кислот может быть ликвидирован другими ферментами (например, избыточное количество глутамата окисляется глутаматдегидрогеназой).
При избытке какой-либо из кислот соотношение быстро восстанавливается трансаминазой за счет другой пары. Недостающее количество какой-либо из кислот может быть взято клеткой из других метаболических путей (например, альфа-кетоглутарат может быть взят из ЦТК). Избыток какой-либо из кислот может быть ликвидирован другими ферментами (например, избыточное количество глутамата окисляется глутаматдегидрогеназой).
2. ОБЕСПЕЧИВАЮТ ПРОТЕКАНИЕ РЕАКЦИЙ КОСВЕННОГО ДЕЗАМИНИРОВАНИЯ.
3. ОБЕСПЕЧИВАЮТ СИНТЕЗ МОЧЕВИНЫ
КОСВЕННОЕ ДЕЗАМИНИРОВАНИЕ (ТРАНСДЕЗАМИНИРОВАНИЕ).
Оксидазы аминокислот в клетках организма человека имеют очень низкую активность. Поэтому прямое окислительное дезаминирование аминокислот почти не протекает. Исключением является никотинамидный фермент глутаматдегидрогеназа, который легко дезаминирует глутаминовую кислоту, расщепляя ее до NH3 и альфа-кетоглутарата. Альфа-кетоглутарат может легко вступать в реакции трансаминирования с другими аминокислотами, превращаясь обратно в глутаминовую кислоту.
 Значит, если аминокислота не может дезаминироваться прямо, то она может дезаминироваться косвенно с участием пары "альфа-кетоглутарат/глутамат".
Значит, если аминокислота не может дезаминироваться прямо, то она может дезаминироваться косвенно с участием пары "альфа-кетоглутарат/глутамат".
Некоторые аминокислоты не имеют "своей собственной" трансаминазы, которая могла бы перенести их аминогруппу на альфа-кетоглутарат (лизин, треонин, пролин, оксипролин), но для этих аминокислот есть специальные реакции, в результате которых аминогруппа этих аминокислот оказывается в составе глутаминовой кислоты.
Таким образом, глутаминовая кислота работает в паре с альфа-кетоглутаровой: альфа-кетоглутарат принимает у разных аминокислот азот в форме аминогруппы, превращаясь в глутамат; глутамат легко дезаминируется прямым путем высокоактивной глутаматдегидрогеназой с образованием аммиака.
Общий итог косвенного дезаминирования такой же, как и результат прямого окислительного дезаминирования.
Это вариант дезаминирования, который протекает в две стадии:
а) трансаминирование с участием альфа-кетоглутаровой кислоты;
б) дезаминирование образовавшейся на первой стадии глутаминовой кислоты.
Косвенное дезаминирование является наиболее важным, т.к. именно таким путем дезаминируются большинство аминокислот живого организма. Это обусловлено тем, что фермент глутамат-ДГ более активен, чем оксидазы аминокислот.
ПРЕИМУЩЕСТВА КОСВЕННОГО ДЕЗАМИНИРОВАНИЯ ПЕРЕД ПРЯМЫМ:
1. В этом процессе не образуется Н2О2, в отличие от прямого дезаминирования, а образуется Н2О и 3 молекулы АТФ (энергия).
2. Косвенное дезаминирование обеспечивает гораздо более быстрое дезаминирование (благодаря высокой активности фермента глутамат-ДГ и трансаминазы);
3. Косвенное дезаминирование протекает не только быстрее, но скорость этого процесса может регулироваться. Возможность регуляции косвенного дезаминирования обусловлена обратимостью процесса и автономной саморегуляцией. Аллостерическими регуляторами глутаматдегидрогеназы являются АДФ (сильный активатор) и АТФ (ингибитор). Ингибирующее действие на этот фермент оказывают также ГТФ и НАДН2.
Если АТФ начинает расходоваться больше, чем образуется в процессе биоокисления в митохондриях, то после активации глутамат-ДГ происходит смещение реакций в сторону образования АТФ, благодаря тому, что глутамат начинает быстрее дезаминироваться, а образующиеся кетокислоты, либо сразу, либо после определенных превращений, могут также вступать на путь митохондриального окисления. Это наблюдается при недостатке жирных кислот или углеводов. То есть при недостатке жиров и углеводов в пище, в качестве дополнительного источника энергии организм начинает использовать аминокислоты. Нередко приходится при голодании разрушать собственные белки. Т.е. при похудании в организме разрушаются не только жиры и углеводы, но и собственные белки. Присутствие достаточного количества жиров и углеводов в пище позволяет сберечь белки от нерационального использования.
СИНТЕЗ ЗАМЕНИМЫХ АМИНОКИСЛОТ В ОРГАНИЗМЕ
Иногда в организме возникает ситуация, когда потребность в тех или иных аминокислотах больше, чем их поступление с пищей. Допустим, организму требуется 7 граммов аланина и 15 граммов глутамата, а с пищей поступило всего лишь 5 граммов аланина, но зато 20 граммов глутамата. Тогда организм, используя механизм трансаминирования, может синтезировать недостающее количество аланина из ПВК, который синтезируется в бих количествах (сотни граммов в сутки). Таким образом, в организме постоянно происходит корректировка аминокислотного состава, но это не уменьшает потребности организма в пищевом белковом азоте. Эта корректировка осуществляется с использование соответствующих альфа-кетокислот, образующихся в ходе метаболизма углеводов и жиров.
Незаменимые аминокислоты не могут образуются в организме, потому что в ходе распада углеводов и жиров не образуется соответствующих им альфа-кетокислот.
Подводя итог, можно сказать, что в результате общих путей катаболизма аминокислот, они разрушаются до СО2, NH3 и безазотистых фрагментов, которые также могут разрушаться до СО2 и Н2О.
Аммиак подвергается реакциям обезвреживания.
ОБЕЗВРЕЖИВАНИЕ АММИАКА. СИНТЕЗ МОЧЕВИНЫ (ОРНИТИНОВЫЙ ЦИКЛ).
Только у рыб аммиак является конечным продуктом распада и выводится из организма. У птиц и рептилий, конечный продукт катаболизма азотсодержащих соединений - мочевая кислота, а не аммиак. У млекопитающих образующийся аммиак превращается в мочевину - это полный амид угольной кислоты:
|
|
Образование мочевины происходит в печени в результате орнитинового цикла (открыт Г.Кребсом).
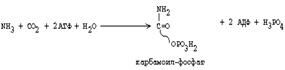
1. В матриксе митохондрий соединяются СО2 и NH3 (при этом расходуются две молекулы АТФ).
|
|
Синтез мочевины представляет собой циклический процесс, в который вступают предварительно синтезированный карбамоил-фосфат и аспартат, а образуются фумарат и мочевина.

Мочевина синтезируется из одной молекулы СО2, одной молекулы NH3 и аминогруппы аспартата. Из фумарата в реакциях ЦТК вновь образуется щавелевоуксусная кислота, которая может вступать в трансаминирование с другими аминокислотами и превращаться в аспартат.
Таким образом, в орнитиновом цикле существуют два сопряженных цикла:
а) образование мочевины; б) регенерация аспартата.
В добавление к лекции по общим путям обмена аминокислот можно сказать, что еще одна, третья по счету функция трансаминирования - это перенос аминогруппы с аминокислот для синтеза мочевины без промежуточного выделения аммиака.
При синтезе мочевины расходуется в сумме 4 молекулы АТФ. Мочевина - это нетоксичное вещество, которое легко выводится из организма с мочой. Накопление мочевины в крови выше нормы происходит только при нарушениях функции почек.
Ещё посмотрите лекцию "Содержание" по этой теме.
Синтез мочевины происходит только в печени, а аммиак образуется в разных тканях. Значит, должен быть специальный механизм транспорта аммиака в безвредной для организма форме: это МЕХАНИЗМ ВРЕМЕННОГО ОБЕЗВРЕЖИВАНИЯ АММИАКА.
Обеспечивается ферментом глутамин-синтетазой, которая присоединяет с затратой АТФ дополнительную аминогруппу к гамма-карбоксигруппе:
|
|
Аминогруппа может также присоединяться и к аспартату - к бета-карбоксигруппе.
Особенно важны реакции временного обезвреживания аммиака в нервной ткани (очень чувствительной к токсическому влиянию аммиака). Со значительной скоростью протекают они и в мышечной ткани.
Образующиеся амиды переносятся в печень, где отдают амидный азот на синтез мочевины. В почках некоторое количество аммиака из амидов может выделяться в свободном виде. Обычно такого аммиака образуется немного, но если в организме - ацидоз - сдвиг рН в кислую сторону, то этот аммиак начинает выделяться с мочой в больших количествах. Аммиак позволяет частично нейтрализовать кислоты, которые из крови при ацидозе попадают в мочу. Таким образом, глутамин и аспарагин являются транспортными формами аммиака и в составе своей молекулы переносят его из разных тканей к печени и к почкам.