Теоретические основы электролитического рафинирования меди
3 ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ЭЛЕКТРОЛИТИЧЕСКОГО РАФИНИРОВАНИЯ МЕДИ
Электролитическому рафинированию подвергается красная (анодная) медь, полученная после огневого рафинирования. Такая медь содержит 99,4-99,6% Сu. Остальное приходится на примеси, включая селен, теллур, серебро и золото. В среднем в анодной меди содержится 30-100 г золота и до 1000 г серебра на одну тонну анодной меди. Целью электролитического рафинирования является: глубокая очистка от вредных примесей, а также попутное извлечение из меди таких ценных компонентов, как селен, теллур, серебро и золото.
Сущность электролитического рафинирования меди заключается в том, что в электролизную ванну, содержащую электролит подвешивают литой анод и матрицу из катодной меди и пропускают через систему электрический ток. Анодная медь растворяется электрохимическим путём и затем осаждается на катоде. Примеси, содержащиеся в анодной меди, или накапливаются в электролите, или переходят в шлам Электрохимическая цепь электролизёра для электролитического рафинирования меди может быть представлена в виде:
(-)(катод)Cu /раствор СuSO4,H2SO4,Н2О, добавки/ Cu (анод) (+).
Электролит содержит 160-200 г/л Сu и серной кислоты 135-200 г/л. В качестве добавок используют столярный клей и мочевину. Эти добавки вводятся для улучшения качества (структуры) катодного осадка.
При анодном растворении меди возможны следующие электрохимические реакции, которые сопровождаются возникновением соответствующих электродных потенциалов:
Сu - e = Cu+ φ = 0,51 В (3.1)
= 0,51 В (3.1)
Cu+ - e = C2+ φ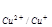 = 0,17 В (3.2)
= 0,17 В (3.2)
Рекомендуемые материалы
Cu - 2e = Cu2+ φ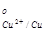 = 0,34 В (3.3)
= 0,34 В (3.3)
В первую очередь должна протекать реакция (10.2). Однако, эта реакция не получает развития так как концентрация ионов Сu+ в растворе ничтожно мала. Концентрация ионов Сu+ в электролите устанавливается в соответствии с равновесием реакции, которая протекает при контакте металлической меди с ионами Сu 2+:
Сu2+ + Cu = 2Cu+ (3.4)
Константа равновесия этой реакции определяется выражением
К =  (3.5)
(3.5)
При 55оС константа равновесия этой реакции составляет 0,25·10-4. Это означает, что концентрация ионов Сu+ будет в 200 раз меньше концентрации ионов Сu2+. Таким образом в условиях процесса электролитического рафинирования меди устойчивым в электролите ионом будет ион Сu2+.
Поэтому растворение медного анода будет проходить по реакции (10.3)
Если по каким - либо причинам равновесие реакции (10,4) сдвигается влево, то у поверхности анода образуется тонкий порошок металлической меди. В процессе электролитического рафинирования меди масса образующегося порошка невелика и составляет 0,02 - 0,1% от массы анода.
Поскольку электролит всегда содержит растворённый в нём кислород воздуха, то в процессе рафинирования анод частично растворяется по химическим реакциям:
Сu + H2SO4 + 0,5O2 = CuSO4 + H2O (3.6)
Cu2O + 2H2SO4 + 0,5O2 = 2CuSO4 + 2H2O (3.7)
Из-за протекания реакций (1.84) и (1.85) анодный выход по току для меди выше 100 %. Переходящая в раствор за счёт химического растворения медь не осаждается на катоде, а накапливается в электролите. Избыток такой меди обычно не превышает 3 % от массы анода.
Основным процессом, протекающим на катоде, является разряд ионов меди:
Сu2+ + 2e = Cu (3.8)
Все примеси, находящиеся в анодной меди можно условно разбить на четыре группы.
К первой группе относятся более электроотрицательные, чем сама медь примеси. К ним относятся Zn, Fe, Ni, Sn, Pb. Эти примеси электрохимическим путём переходят в электролит. На катоде они разряжаться не могут, поэтому накапливаются в электролите. Их попадание в катодный осадок возможно за счёт межкристаллических включения раствора в катодную медь. Олово и свинец образуют нерастворимые соединения Sn(OH)2 и PbSO4 и попадают в шлам.
Вторую группу примесей образуют As, Sb, и Bi. Их электродные потенциалы близки к потенциалу меди, поэтому вероятность их перехода в катодный осадок высока. Для предотвращения их выделения на катоде необходимо не допускать превышения их предельной концентрации в электролите. На практике это достигается выводом мышьяка, сурьмы и висмута из раствора при регенерации электролита.
Мышьяк, сурьма, переходящие в электролит, могут окисляться кислородом воздуха до солей высших валентностей.
As2(SO4)3 + 2H2SO4 + O2 = As2(SO4)5 + 2H2O (3.9)
Sb2(SO4)3 +2H2SO4 + O2 = Sb2(SO4)5 + 2H2O (3.10)
Cоли высших валентностей мышьяка и сурьмы склонны к образованию кислот H3SbO4 и H3AsO4.
Кроме того, они подвергаются гидролизу, в результате которого образуются оксиды этих элементов и основные соли::
As2(SO4)5 + 2H2O = As2O3 + 3Н2SO4 (3.11)
Sb2(SO4)5 + 2H2O = Sb2O3 + 3Н2SO4 (3.12)
Bi2(SO4)3 + 2H2O = 2Bi(OH)SO4 + Н2SO4 (3.13)
В итоге окислившиеся на аноде электрохимическим путём As, Sb, и Bi распределяются между раствором и шламом.
Твёрдые частицы оксидов и основных солей этих элементов могут образовывать хорошо сформировавшиеся кристаллы, которые осаждаются на дно ванны. Но иногда они формируются в виде мелко дисперсных частиц, близких к коллоидным частицам. Тогда они находятся в электролите в виде взвесей и образуют так называемые плавучие шламы. Эти шламы механическим путём попадая к поверхности катода могут служить источником загрязнения катодной меди этими примесями.
Для предупреждения накопления примесей в электролите и для поддержания его постоянного состава электролит подвергают регенерации. Для этих целей часть электролита выводят из ванн. Количество выводимого электролита обычно рассчитывают по предельно допустимой ведущей примеси. Обычно таковой является никель.
К третьей группе примесей относятся благородные металлы. Как более электроположительные, чем медь, они не растворяются электрохимическим путём. По мере растворения анода они осыпаются и попадают в шлам. Их выход в шлам составляет 98 - 99%.
К примесям четвёртой группы отнoсятся растворённые в анодной меди химические соединения Cu2O, Cu2S, Cu2Se, Cu2Te. Эти соединения электрохимически нейтральны и малорастворимы в электролите. Все они практически полностью переходят в шлам.
Для электролитического рафинирования меди применяют железобетонные ванны ящичного типа, имеющие удлинённое прямоугольное сечение. Для повышения коррозионной стойкости против взаимодействия серной кислоты изнутри ванны облицовываются винипластом, стеклопластиком, полипропиленом, кислотоупорным бетоном. Электролизные ванны группируются в блоки. В каждом блоке содержится 10-20 ванн. Блоки группируются в серии, состоящие обычно из двух блоков. Электроды в отдельных ваннах (катоды и аноды) подключены параллельно. На рисунке 1.17 приведена схема питания электродных ванн в блоках и сериях.
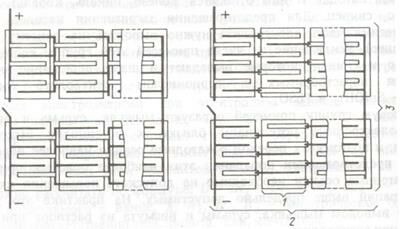
1 - ванна; 2 - блок; 3 - серия
Рисунок 1.17 - Схема питания электролитных ванн электрическим током в блоках и сериях.
Геометрические размеры ванн зависят от числа и размера электродов, завешиваемых в ванну. Современные ванны имеют длину 3,5-5,5м, ширину - 1-1,1м, высоту 1,2-1,5м. Число катодов в ванне всегда превышает число анодов на единицу. Размеры катодов превышают размеры анодов по высоте и ширине на 20-30мм. Первичными катодами служат тонкие листы катодной меди толщиной 0,4 - 0,5мм. Катодные основы состоят их меди. Их получают электролитическим путём. Для этих целей в специальных электролизёрах на медные матрицы осаждают медь.
Время наращивания одного катода в ванне рафинирования меди составляет 6-15 суток. Масса катода достигает 60-140 кг. После тщательной промывки катоды направляют потребителю или переплавляют в слитки меди.
Время растворения анода составляет 20-30 суток. Аноды полностью не растворяют. Часть анода, составляющая 12-18 % от первоначальной массы анода, остается в виде скрапа нерастворённой. Анодный скрап направляется на переплавку в анодную печь. За время работы анодов осуществляется 2 - 3 съёма катодной массы.
Поскольку при электролитическом рафинировании меди оба электрода (катод и анод) изготовлены из одного металла (Сu), то напряжение между электродами в процессе электролиза складывается в основном из падения напряжения в электролите между электродами и падения напряжения в ток подводящих шинах и контактах. Поэтому напряжение на ванне можно рассчитать по уравнению:
U = IR1 + IR2 + IR3 (3.14)
где R1 - электрическое сопротивление электролита между электродами,
Ом;
R2 - электрическое сопротивление ток подводящих шин, Ом;
R3 - электрическое cопротивление контактов, Ом;
I - cила тока, А;
U - напряжение между электродами ванны, В.
Напряжение между электродами на ванне обычно составляет 0,25-0,30 В. Плотность тока, поддерживаемая в процессе электролиза, составляет порядка 250-300 А/м2 . Катодный выход по току составляет порядка 95 %. Расход электрической энергии составляет 230-350 кВт·час на 1т меди. Температура электролита поддерживается порядка 50-55оС.
В процессе электролиза электролит обогащается медью и загрязняется примесями. Для предупреждения накопления примесей в электролите и для поддержания его постоянного состава электролит подвергают регенерации. Для этих целей часть электролита выводят из ванн. Количество выводимого электролита обычно рассчитывают по предельно допустимой ведущей примеси. Обычно таковой является никель.
Регенерация электролита с целью вывода из него избытка меди обычно производится в регенерационных ваннах, в которых в качестве катода служит матрица из катодной меди, а в качестве анода используется свинец с добавкой 3-6% сурьмы или 1% Аg. На катоде в ванне регенерации протекает реакция разряда ионов меди
Сu2+ + 2e =Cu. (3.15)
Свинцовый анод является нерастворимым и в процессе регенерации электролита на нем протекает электродная реакция, сопровождающаяся выделением кислорода:
Н2О + 2е = 2Н+ + 0,5О2. (3.16)
В ванне регенерации электролита протекает реакция:
CuSO4 + H2O = Cu + H2SO4 (3.17)
В результате протекания реакции (1.97) электролит обедняется медью и обогащается свободной серной кислотой. После частичного обеднения электролит можно возвращать в ванны электролитического рафинирования.
Напряжение на ванне регенерации электролита составляет 2,0-2,5 В.
На многих заводах регенерацию электролита совмещают с получением медного купороса. В этом случае отобранный из рафинировочной ванны
электролит нейтрализуют в присутствии кислорода воздуха анодным скрапом или специально приготовленными медными гранулами. При этом протекает реакция:
Сu + H2SO4 + 0,5O2 = CuSO4 + H2O (3.18
В результате протекания реакции (1.96) раствор обогащается медью и обедняется серной кислотой.
Если Вам понравилась эта лекция, то понравится и эта - 5.4. Включение цепи r, L к источнику гармонического напряжения.
Полученный раствор упаривают в кристаллизаторах. В них при охлаждении выделяются кристаллы медного купороса CuSO4·5H2O. Для ускорения процесс проводят в вакуумных кристаллизаторах.
Процесс кристаллизации проводят в три стадии. Раствор после третей стадии содержит 50- 60 г/л Сu. Этот раствор подвергают электролизу в ваннах с нерастворимыми анодами. В результате электролиза получают рыхлый катодный осадок меди, загрязнённый мышьяком и сурьмой. Эту медь направляют на медеплавильный завод. Раствор, содержащий около 1 г/л меди и богатый серной кислотой, направляют на получение никелевого купороса, а затем в цех электролитического рафинирования меди для приготовления свежего электролита.
Важным направлением дальнейшего развития электрометаллургии меди является получение медного порошка и фольги.
Получение медного порошка осуществляется путём электролиза с высокой плотность тока, которая может достигать 2000 А/м2, и низким порядка 10 - 13 г/л содержанием меди в электролите. Выделение меди в этих условиях проходит при скоростях близких к предельному току диффузии. Формирование плотного катодного осадка в этих условиях невозможно и в результате получается порошкообразная медь.
Электролитическую медную фольгу получают путём электролитического осаждения меди на барабанном вращающемся катоде. При получении фольги используют электролит с содержанием 40-60 г/л Cu и 40-60 г/л H2SO4. Электролиз ведут при 35-50 оС с интенсивным перемешиванием электролита сжатым воздухом при плотности тока 1800-3000 А/м2.






















