Строение вещества
Строение вещества
Строение атома
Радиус атома: rа » 0.1 нм; радиус ядра rя » 10-6нм. Как видно, величина ядра очень мала по сравнению с размером атома, но плотность ядра очень велика (r=1014 ), поэтому строение ядра более сложно и требует подробного рассмотрения.
), поэтому строение ядра более сложно и требует подробного рассмотрения.
Состав ядра:
Ядро состоит из нуклонов (протонов и нейтронов). Масса протона: mp = 1.00076 а.е.м.; масса нейтрона: mn = 1.0009 а.е.м. Заряд протона: zp =1.6×10-19 кулон, соответствует элементарному заряду (+1), заряд электрона - (-1).
Протон обозначается - , нейтрон -
, нейтрон -  .
.
Массовое число атома равно: А = N + Z, где N - сумма нейтронов, Z - сумма протонов, масса же электрона ничтожно мала ( ), т. е. суммой масс электронов можно пренебречь.
), т. е. суммой масс электронов можно пренебречь.
Из таблицы Менделеева можно извлечь следующие данные:
1) массовое число - атомная масса;
Рекомендуемые материалы
2) порядковый номер элемента - заряд ядра, он же и число протонов в ядре;
3) число нейтронов вычисляется по формуле: N = A - Z.
Пример. Указать состав атома  .
.
А = 19, Z = 9, N = 19 - 9 = 10, e-1 = 9.
Совокупность атомов, обладающих одинаковым зарядом ядра, называется химическим элементом. Атомы, обладающие одинаковым зарядом ядра, но разными массами, называются изотопы.
Массу атомов и молекул принято выражать в виде относительной величины, в атомных единицах массы (а.е.м.). В настоящее время это углеродная единица, равная 1/12 части масссы атома углерода ( ).
).
Строение электронных оболочек атомов.
В 1903 г. Томпсон предположил модель атома, состоящего из положительного ядра, в который вкраплены отрицательные заряды. Впоследствии эта модель была отвергнута, и Э. Резерфордом в 1911 г. была выдвинута планетарная модель атома. Он предположил, что положительно заряженное ядро находится внутри атома, а вокруг него, на большом расстоянии вращаются отрицательно заряженные электроны.
В 1913 г. Н Бор выдвинул 2 постулата:
1. Электорон, вращаясь по стационарной орбите, не излучает энергию.
2. При переходе с одной стационарной орбиты на другую, электрон может поглощать или излучать энергию, причём, если он переходит с дальней орбиты на ближнюю, он излучает энергию, а при переходе с ближней на дальнюю - поглащает энергию.
Следствия:
DE = E2 - E1; DЕ = hn - квант энергии, где h - постоянная Планка, равная 6,626×10-34 Дж/с;
n - частота излучения, она равна количеству колебаний световой волны, которые происходят на отрезке в 300000 км., за 1 секунду, или сколько длин волны укладывается на этом отрезке в 1 с.
2-ой постулат Бора гласит, что энергия квантуется (когда какая-нибудь величина имеет ряд строго определённых значений, говорят, что она квантована).
Однако, теория Бора не обьясняет, где находится электрон, когда переходит с одной орбиты на другую.
Основные положения квантовой химии.
1-ая идея квантовой химии: а) вещество дискретно; б) энергия квантуется.
2-ая идея квантовой химии: корпускулярно-волновой дуализм.
3-я идея квантовой химии: вероятностный характер законов микромира.
1. Дискретность - вещество состоит из отдельных микрочастиц. Именно эти частицы изучает квантовая химия. Идею квантования энергии, основываясь на спектрах излучения нагретых тел, выдвинул Планк.
2. Корпускулярно-волновой дуализм. Микрочастицы в микромире обладают и свойствами частицы, и свойствами волны.
Впервые корпускулярно-волновой дуализм был предположен для света (электромагнитного излучения). С одной стороны свет, это электромагнитная волна и для него характерны такие свойства, как интерференция и дифракция, а с другой стороны при наблюдении явления фотоэффекта, было выдвинуто предположение, что свет это поток частиц - фотонов. Была измерена даже масса фотона. Энергия фотона равна mc2.
Электрон тоже обладает двойственной природой: с одной стороны это частица, обладающая определённой массой и скоростью, с другой стороны электрон может вести себя как волна. Для потока электронов были обнаружены свойства интерференции и дифракции.
Электронография - метод изучения строения вещества, основанный на волновых свойствах потока электрона.
Уравнение, связывающее корпускулярные и волновые свойства, это уравнение де Бройля.
Е = mc2; E = hn = h ; mc2 = h
; mc2 = h ; где l - длина волны, с - скорость света, m - масса фотона.
; где l - длина волны, с - скорость света, m - масса фотона.
 - уравнение де Бройля для световой волны.
- уравнение де Бройля для световой волны.
Для электрона уравнение де Бройля имеет вид:
 , где u - скорость электрона. Когда u ® ¥, l ® 0, l =
, где u - скорость электрона. Когда u ® ¥, l ® 0, l =  , n ® ¥.
, n ® ¥.
3. Вероятностный характер законов микромира.
В 1927 г. Гейзинберг выдвинул принцип неопределённости; согласно этому принципу невозможно точно определить местоположение частицы и её импульс в данный момент времени.
 , где Dpx - погрешность импульса вдоль оси Х, Dx - погрешность координаты,
, где Dpx - погрешность импульса вдоль оси Х, Dx - погрешность координаты,  - квант действия - константа.
- квант действия - константа.
Пусть Dpx ® 0, тогда Dx ® ¥, т. к.  , и наоборот, если Dx ® 0,
, и наоборот, если Dx ® 0,
Dpx ® ¥.
Примечание. Эта неопределённость не связана с неточностью приборов, она является следствием самой природы электрона.
Следствия принципа неопределённости:
1. Движение электронов в атоме - это движение без траектории, поэтому понятие “орбита”, выдвинутая Бором, в настоящее время не принимается, т.е. можно говорить только с той или иной степенью вероятности о нахождении электрона на определенном расстоянии от ядра.
2. На основании принципа неопределенности можно объяснить, почему электрон не падает на ядро.
Законы движения микрочастиц в квантовой химии выражены уравнением Шредингера, который применил волновую функцию y, для описания движения электрона в 3-х мерном пространстве.
 ;
;
 , где Ñ - оператор “набла”, y - волновая функция, Е - полная энергия, Еп - потенциальая энергия, (Е - Еп) - кинетичская энергия.
, где Ñ - оператор “набла”, y - волновая функция, Е - полная энергия, Еп - потенциальая энергия, (Е - Еп) - кинетичская энергия.
y2dV - вероятность нахождения электрона в элементарном обьёме dV.
Решение уравнения Шреденгера в полярной системе координат даёт 3 независимые величины, которые называются квантовыми числами электрона: n, l, me. Вводят также ms - спиновое квантовое число, которое характеризует движение электрона вокруг своей оси.
Квантовые числа - прастранственные и энергитические характеристики электрона. Электроны в атоме образуют электронную оболочку, которая состоит из электронных слоёв, а электронные слои состоят из атомных орбиталей.
Атомная орбиталь - область наиболее вероятного нахождения электрона.
1). n - главное квантовое число, оно характеризует размер электронного облака, т. е. расстояние от ядра до наиболее плотной части этого облака. Электроны, имеющие облака одинакового размера, независимо от формы, составляют электронный слой оболочки атома или энергитический уровень.
n принимает значения 1;2;3;…;¥. n соответствует номеру периода.
2). ℓ - орбитальное квантовое число, оно характеризует форму электронного облака или энергетический подуровень. ℓ принимает значения от 0 до n - 1.
Электроны, характеризующиеся значениями орбитального квантового числа 0,1, 2 и 3, называют соответственно s-электронами,р-электронами, d-электронами и f-электронами. При данном значении главного квантового числа n наименьшей энергией обладают s-электроны, затем р-, d- и f-электроны.
| n | ℓ | Форма облака |
| 1 2 3 4 | 0 0,1 0,1,2 0,1,2,3 | s s,p s,p,d s,p,d,f |
3). mℓ - магнитное квантовое число, оно характеризует ориентацию электрона в поле, которое создают другие электроны.
Магнитное квантовое число принимает значения 2ℓ + 1 ( - ℓ, … 0, …+ ℓ).
| ℓ | подуровень | mℓ |
| 0 | s | 1 (m = 1) |
| 1 | p | -1, 0, +1 (m = 3) |
| 2 | d | -2, -1, 0, +1, +2 (m = 5) |
| 3 | f | -3, -2, -1, 0, +1, +2, +3 (m = 7) |
Электронное облако определённого размера (с определённым значением n), определённой формы (с определённым значением ℓ), и определённым образом ориентированное в пространстве (с определённым значением m), называется электронной орбиталью и изображается в виде квантовой ячейки.
s d
p f
4). ms - спиновое число.
Спиновое квантовое число отражает наличие у электрона собственного момента движения. Проекция собственного момента количества движения электрона на избранное направление и называется спином.
ms = ± ½ , т. е. электроны могут вращаться по часовой или против часовой стрелки. На одной электронной орбите могут находиться два электрона с противоположно направленными спинами.
Распределение электронов в многоэлектронных атомах.
Распределение электронов в многоэлектронных атомах основано на трех положениях: принципе минимума энергии, принципе В. Паули и правиле Ф Хунда.
1. Заполнение энергетических уровней и подуровней происходит согласно принципу минимальной энергии: минимальной энергией обладают уровни и подуровни, ближайшие к ядру: 1s, 2s, 2p, 3s, 3p, 4s, 3d и т. д.
Правила Клечковского:
1). Минимальной энергии соответствует минимальное значение суммы n + ℓ.
2). Если эта сумма для двух электронов одинакова, то минимальная энергия (Emin) соответствует минимальному значению n.
| nℓ | n + ℓ |
| 1s | 1 + 0 =1 |
| 2s | 2 + 0 = 2 |
| 2p | 2 + 1 = 3 |
| 3s | 3 + 0 = 3 |
| 3p | 3 + 1 = 4 |
| 3d | 3 + 2 = 5 |
| 4s | 4 + 0 = 4 |
| 4p | 4 + 1 =5 |
| 4d | 4 + 2 = 6 |
| 4f | 4 + 3 = 7 |
| 5s | 5 + 0 = 5 |
| 5p | 5 + 1 = 6 |
| 5f | 5 + 2 = 7 |
| 5f | 5 + 3 = 8 |
| 6s | 6 + 0 = 6 |
| 6p | 6 + 1 =7 |
Emin: 1s<2s<2p<3s<3p<4s<3d<4p<5s<4d<5p<6s<4f≈5d<6p.
2. Принцип Паули состоит в том, что
в атоме не может быть электронов, имеющих одинаковый набор всех четырех квантовых чисел.
Вспомним, что электрон может характеризоваться только одним набором 4-х квантовых чисел (n, l,ml и ms), а одной пространственной атомной орбитали (АО) соответствует состояние с фиксированными значениями 3-х квантовых чисел (n, l, ml). Тогда по принципу Паули для конкретной АО возможно лишь столько состояний электрона, сколько различных значений возможно для четвертого квантового числа ms. Для последнего возможны лишь два значения. Поэтому максимальное количество электронов для одной АО – 2. Два электрона, находящихся на одной орбитали и обладающие противоположно направленными спинами, называются спаренными. Согласно принципу Паули максимально возможное количество электронов на подуровне Nmax =2(2ℓ + 1), так как каждому значению ℓ соответствует (2ℓ + 1) значение магнитного квантового числа, т.е. (2ℓ + 1) АО, а на каждой может находиться по 2 электрона.
На s - подуровне Nmax = 2;
На р - подуровне Nmax = 6;
На d - подуровне Nmax = 10;
На f - подуровне Nmax = 14.
Максимально возможное число таких комбинаций всех 4-х квантовых чисел при заданном значении n, чтобы не было двух одинаковых, дает нам максимальное число электронов на уровне Nmax=2n2.
3. Правило Хунда. Это правило определяет порядок размещения электронов в пределах одной электронной подоболочки для наиболее устойчивого состояния атома.
Оно гласит: в наиболее устойчивом состоянии атома электроны размещаются в пределах электронной подоболочки так, чтобы их суммарный спин был максимален.
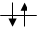
Например: для электронной конфигурации 2р3 возможны следующие варианты размещения электронов
 |  |  |  |  |  |  | |||||||||||
 | |||||||||||||||||
 | |||||||||||||||||
1 2
1.Суммарный спин электронов: ½ +½ +½ = 3/2
2. Суммарный спин электронов: ½ - ½ +½ = ½
3. Суммарный спин электронов: ½ - ½ +½ = ½
Только в первом случае, когда каждой АО соответствует электрон со спином +1/2, достигается максимальный суммарный спин. Значит, это и есть энегетически самое выгодное состояние системы.
Правило Хунда не запрещает другого распределения электронов в пределах электронной подоболочки. Состояние атома с меньшими значениями суммарного спина электронов будут энергетически менее выгодными и, в отличие от первого, называемого основным, будут относиться к возбужденным состояниям.
Составление электронных формул по двум квантовым числам.
Максимальное заполнение энергетических уровней и подуровней.
| n | N = 2n2 | ℓ | N = 2(2ℓ + 1) | Запись электронного состояния |
| 1 | 2 | 0(s) | 2 | 1s2 |
| 2 | 8 | 0(s) 1(p) | 2 6 | 2s2p6 |
| 3 | 18 | 0(s) 1(p) 2(d) | 2 6 10 | 3s2p6d10 |
| 4 | 32 | 0(s) 1(p) 2(d) 3(f) | 2 6 10 14 | 4s2p6d10f14 |
| 5 | 32 | 0(s) 1(p) 2(d) 3(f) | 2 6 10 14 | 5s2p6d10f14 |
| 6 | 8 | 0(s) 1(p) | 2 6 | 6s2p6 |
1. Чтобы правильно составить электронную формулу элемента, нужно определить его положение в таблице Менделеева. Z - заряд ядра, А = Z + N; ē = Z.
2. n – главное квантовое число и, значит, число энергетических уровней, соответствует № периода.
3. № группы соответствует числу валентных электронов (участвующих в образовании связей), причём, если это главная подгруппа (А), то все валентные электроны находятся на верхнем энергетическом уровне. Если это побочная подгруппа, то на внешнем энергетическом уровне находятся 1 или 2 валентных электрона, остальные находятся на предвнешнем энергетическом уровне.
Пример:  ; n = 1,2 ,3,4; VII A; z = 35;
; n = 1,2 ,3,4; VII A; z = 35;  = 35;
= 35;  = 45; ē = 35.
= 45; ē = 35.
Br°: 1s22s2p63s2p6d104s2p5 - на последнем энергетическом уровне, находятся валентные электроны.
У десяти элементов побочной подгруппы наблюдается проскок электронов (Cu, Au, Ag, Mo, Cr, Nb, Ru, Rh, Pt, Pd).
Периодический закон Д.И. Менделеева
В зависимости от того, на какой энергетический подуровень пришёл последний электрон, различают электронные семейства элементов (s, p, d, и f элементы).
1. s - элементы, это элементы первой группы главной подгруппы и второй группы главной подгруппы (IA, IIA). На внешнем энергетическом уровне у них 1 или 2 электрона. Все s - элементы - типичные металлы (исключение - Be - амфотерный).
В своих соединениях s - элементы имеют степени окисления +1 и +2.
IA - щелочные металлы, их оксиды обладают основным характером.
Пример: Na2O + H2O = NaOH - щёлочь.
IIА - Be -амфотерный металл, Mg – типичный металл. Их оксиды не реагируют с водой, гидроксиды не растворимы в воде. Ca, Sr, Ba - щелочноземельные элементы. Их оксиды непосредственно реагируют с водой, обладают основным характером.
Пример: CaO + H2O = Ca(OH)2
Пример: : 1s22s2; n = 1,2; IIA.
: 1s22s2; n = 1,2; IIA.
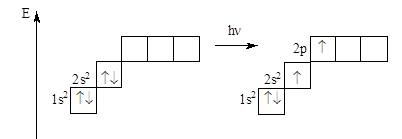
Be° Be*
Бериллий в основном состоянии не имеет неспаренных электронов, но при поглощении кванта энергии спаренные s-электроны распариваются и занимают свободные ячейки на p-подуровне. Таким образом, в возбужденном состоянии атом бериллия имеет валентность, равную 2.
Валентность элемента равна количеству неспаренных электронов в возбужденном состоянии.
2. p - элементы, это элементы c третьей группы главной подгруппы по восьмую группу главной подгруппы (IIIA - VIIIA), в основном – это неметаллы. Они занимают верхний правый угол в таблице Менделеева:
Неметаллы могут проявлять как положительные, так и отрицательные степени окисления: отрицательную степень окисления - в соединениях с водородом и металлами.
Минимальная степень окисления равна (№ группы-8): C-4 H4, N-3H3, H2S-2, HCl-1.
В соединениях с кислородом и с другими более электроотрицательными элементами, неметаллы могут проявлять положительную степень окисления, максимальная степень окисления равна номеру группы.
Пример:
 - хлорноватистая кислота;
- хлорноватистая кислота; 2 - хлористая кислота;
2 - хлористая кислота;
 - хлорноватая кислота;
- хлорноватая кислота;  - хлорная кислота.
- хлорная кислота.
Т. е. все оксиды неметаллов обладают кислотным характером и растворимы в воде (исключение SiO2).Пример:  ; n = 1,2,3,4; VA; p - элемент.
; n = 1,2,3,4; VA; p - элемент.
As: 1s22s2p63s2p6d104s2p3
 As° As*
As° As*
As-3: 1s22s2p63s2p6d104s2p6;
As° + 3ē → As-3; As-3H3 - арсин.
As° - 3ē → As+3; As+3: 1s22s2p63s2p6d104s2; As2O3 - оксид мышьяка (Ш), амфотерный характер.
As2O3 + H2O = 2HAsO2 - мышьяковистая кислота. Соли мышьяковистой кислоты NaAsO2 - арсениты.
As° - 5ē → As+5; As2O5 - кислотный оксид; As2O5 + H2O = 2HAsO3 - мышьяковая кислота. Соли мышьяковой кислоты, NaAsO3 - арсенаты.
Существуют следующие р - элементы - металлы:
IIIA: Al (амф.), In, Tl (типичные металлы).
IVA: Ge, Sn, Pb ( типичные амфотерные элементы), могут проявлять степень окисления +2, +4, могут проявлять отрицательную степень окисления:  .
.
VA: Sb (амф.).
VIA: Po (амф.).
Рассмотрим соединения олова:
 : 1s22s2p63s2p6d104s2p6d105s2p2; n = 1,2,3,4,5; IVA; p - элемент.
: 1s22s2p63s2p6d104s2p6d105s2p2; n = 1,2,3,4,5; IVA; p - элемент.
Sn+2: 1s22s2p63s2p6d104s2p6d105s2;
Sn+4: 1s22s2p63s2p6d104s2p6d104s2p6d10.
Оксид олова (II) - SnO – амфотерный
 HCl SnCl2 - хлорид олова
HCl SnCl2 - хлорид олова
 Sn(OH)2
Sn(OH)2
NaOH Na2SnO2 - станнит натрия
Оксид олова (IV) - SnO2 – амфотерный
 HCl SnCl4
HCl SnCl4
 Sn(OH)4
Sn(OH)4
NaOH Na2SnO3 - станнат натрия
H4SnO4; H2SnO3 – оловянная кислота, орто- и мета-форма.
3) d - элементы это элементы, у которых происходит заполнение электронами предвнешнего d подуровня. Они составляют побочные подгруппы. У d - элементов на внешнем уровне 1- 2 электрона (искл. Pd - 0 электронов). Валентными являются электроны внешнего уровня и предвнешнего d - подуровня. Все d - элементы металлы, проявляют только положительную степень окисления. Характер оксидов и гидрооксидов зависит от степени окисления элементов. Низшая положительная степень окисления как правило +2, (искл. - Ag, Au, Cu, степень окисления этих элементов +1), характер оксидов и гидрооксидов - основной. Промежуточная степень окисления равна +3, +4, характер оксидов и гидрооксидов - амфотерный. Высшая положительная степень окисления равна номеру группы (искл. Ag, Au, Cu - степень окисления +3), характер оксидов и гидрооксидов - кислотный.
Рассмотрим пример типичного d - элемента, Mn (марганец).
 : 1s22s2p63s2p6d54s2; n = 1,2,3,4; VII B.
: 1s22s2p63s2p6d54s2; n = 1,2,3,4; VII B.
Mn2+: MnO - основной оксид, Mn(OH)2 – основной гидроксид.
Mn4+: MnO2 – амфотерный оксид, Mn(OH)4 - амфотерный гидрооксид, H2MnO3 - марганцеватистая кислота. Соли марганцеватистой кислоты: Mg2MnO3 - манганиты.
Мn6+; MnO3 - кислотный оксид, H2MnO4 - марганцовистая кислота. Соли марганцовистой кислоты: K2MnO4 - манганаты.
Mn7+; Mn2O7 - кислотный оксид, HMnO4 - марганцевая кислота. Соли марганцевой кислоты: KMnO4 - перманганаты.
4) f - элементы. К ним относятся лантаноиды и актиноиды. В них происходит достраивание предпредвнешнего f- подуровня.
La: - // - // - // - 5d16s2
Ac: - // - // - // - 6d17s2
 : 1s22s2p63s2p6d104s2p6d10f15s2p6d16s2
: 1s22s2p63s2p6d104s2p6d10f15s2p6d16s2
Лантаноиды и актиноиды похожи на типичные d - элементы.
Периодический закон и периодическая система элементов.
Свойства элементов находятся в периодической зависимости от заряда ядра их атомов.
1. Радиусы атомов. В пределах периода с увеличением порядкового номера элемента, размеры атомов уменьшаются, т. к. увеличивается положительный заряд ядра, а количество энергетических уровней остаётся постоянным. Чем больше заряд ядра, тем сильнее электроны притягиваются к ядру, поэтому радиус атома уменьшается.
В пределах группы, с увеличением порядкового номера, размеры атомов возрастают, т. к. несмотря на увеличение заряда ядра, увеличивается количество энергетических уровней и ослабляется притяжение электронов к ядру.
Радиусы ионов, по сравнению с радиусами атомов могут увеличиваться или уменьшаться, в зависимости от того, принимает атом электрон, или отдаёт.
2. Энергия ионизации или DНион. это то количество энергии, которое необходимо затратить, чтобы оторвать электрон от невозбуждённого атома и удалить его за пределы взаимодействия.
DНион. > 0, причём, каждый последующий электрон отрывается труднее
DН1 < DН2 < DН3 <…< DНn
Величина DНион. характеризует способность элемента отдавать электроны, т. е. характеризует его восстановительные свойства. Чем меньше DНион., тем выше восстановительные свойства элементов. В пределах периода с уменьшением радиуса атомов энергия ионозации увеличивается, а в пределах группы с увеличением радиуса атомов энергия ионизации уменьшается.
3. Энергия сродства к электрону - это энергия, которая выделяется при присоединении электрона к невозбуждённому атому, молекуле или радикалу.
Э + е → Э-, DН < 0 - процесс экзотермический.
В периодах слева направо сродство к электрону увеличивается, а в пределах группы сверху вниз сродство к электрону уменьшается, т. к. увеличивается радиус атома.
Сродство к электрону характеризует окисляющие свойства элемента, т. е. чем больше сродство к электрону, тем более сильным окислителем является элемент. Самым сильным окислителем является F (фтор): .
.
4. Электроотрицательность. Чтобы учесть и DНион. и DНср-ва, вводят понятие электроотрицательности.
 .
.
Электроотрицательность (по Полингу) это способность атома, связанного в молекуле и ионе, притягивать к себе электроны, участвующие в образовании связей.
Вводится шкала электроотрицательности по Полингу:
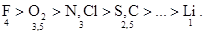
В пределах периода электроотрицательность возрастает слева направо. А в пределах группы электроотрицательность уменьшается сверху вниз.
5. Кислотно-основные свойства оксидов и гидроксидов.
В пределах периода, слева направо возрастают кислотные свойства оксидов и гидроксидов. Рассмотрим, например III период:
NaOH Mg(OH)2 Al(OH)3
щёлочь н/р в воде основание амфотерный гидроксид
H2SiO3 H3PO4 H2SO4 HClO4
слабая кислота средней силы кислота сильная кислота очень сильная кислота
В пределах группы возрастают основные свойства оксидов и гидроксидов. Возьмём IV группу, главную подгруппу:
"4 Газовая турбина" - тут тоже много полезного для Вас.
H2CO3 - кислота;
H2SiO3 - не растворимая в воде кислота;
H2GeO3 ≡ Ge(OH)4 - амфотерный гидроксид, с преобладанием кислотных свойств;
H2SnO3 ≡ Sn(OH)4 - амфотерный гидроксид;
Pb(OH)4 - амфотерный гидроксид, с преобладанием основных свойств.
6. Окислительно-восстановительная способность элемента. См. п. 2 и 3.


















