Оценка допустимости применения континуального приближения
Лекция №17.
Оценка допустимости применения континуального приближения
Допустимость применения континуального приближения оценивается по критерию Кнудсена

![]()
- 0,01
![]()
Скачки температур, скоростей, концентраций, давлений учитываются в граничных условиях.
![]() молекулярное течение, все уравнения переноса берутся из статической физики –
молекулярное течение, все уравнения переноса берутся из статической физики –

 ,
,  – эффективное сечение столкновения молекул,
– эффективное сечение столкновения молекул,  , n
, n – число молекул,
– число молекул,
d =r1+r2 – эффективный диаметр молекул при столкновении
Течение со скачками
Рекомендуемые материалы




« » значения скачков параметров определяются знаком производной параметрической зависимости.
» значения скачков параметров определяются знаком производной параметрической зависимости.
Приравнивая уравнения, получаем выражения для расчета скачков параметров:



 0,01
0,01



Критерий  для газов
для газов
Только в газах и вакууме возможно, что 
Кинематическая вязкость:  ,
,  – скорость движения молекул в газе (скорость звука в газе)
– скорость движения молекул в газе (скорость звука в газе)
Вязкое течение:

 - критерий Маха – отношение характерной скорости к скорости звука.
- критерий Маха – отношение характерной скорости к скорости звука.

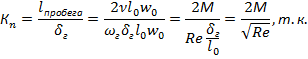

 - толщина гидродинамического слоя
- толщина гидродинамического слоя
Практические задачи в процессах переноса массы
Процессы разделения в процессах массопереноса


Условия для процесса разделения:
1) Необходимо иметь 2 фазы и межфазную границу, через которую проходит перенос вещества;
2) Необходимо различие равновесных концентраций компонента в фазах.
«Равновесие в системе пар – жидкость»
1.Идеальная смесь «пар – жидкость» - это смесь, подчиняющаяся законам Рауля и Дальтона
Закон Рауля: парциальное давление равно упругости паров смеси, умноженного на концентрацию смеси.
 - парциальное давление компонента
- парциальное давление компонента
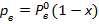
Закон Дальтона: общее давление в системе равно сумме парциальных давлений компонентов в ней:
Р=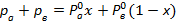
 - концентрация компонента в бинарной жидкой фазе.
- концентрация компонента в бинарной жидкой фазе.
Концентрация компонента а в парах:
 , график y=f(Р) – гипербола
, график y=f(Р) – гипербола

Легкокипящий компонент – компонент, упругость паров которого больше при данной температуре.
Закон Коновалова: пар обогащен легколетучим компонентом.


 -гиперболическая зависимость
-гиперболическая зависимость
 :
:
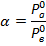
Гипербола ( x, y- диаграмма) выше диагонали, тогда выполняется закон Коновалова.
Реальные смеси.

В точках экстремума возникают азеотропные точки (состав пара и жидкости в них одинаков)
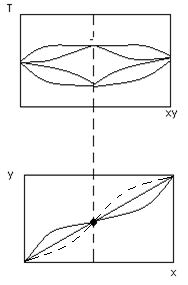
Поэтому разделить такие смеси в процессе испарения – конденсации не возможно.
на диаграмме Р, ху – минимум на диаграмме Т, ху.
В азеотропной точке нельзя просто разделить азеотропные смеси.
Дистилляция
Дистилляция – разделение жидких смесей на отличающиеся по составу фракции. Она основана на различии в составах жидкости и образующегося пара на основе первого закона Коновалова. Процесс осуществляется испарением жидкости и последующей конденсацией пара.
Процесс дистилляции

Расчет процесса непрерывной дистилляции
Баланс по потокам:

Баланс по компоненту:

y = f(x) – 3 уравнения и 3 неизвестных  и одна из концентраций или один из выходных потоков известен. Мы им задаемся. Система замкнута.
и одна из концентраций или один из выходных потоков известен. Мы им задаемся. Система замкнута.

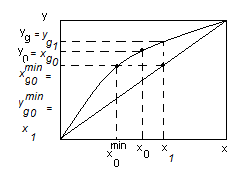
 . При
. При  , т.е. при дальнейшей перегонке будет ухудшаться состав дистиллята по отношению к х.
, т.е. при дальнейшей перегонке будет ухудшаться состав дистиллята по отношению к х.
Баланс тепла по контуру
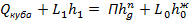
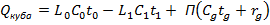
 - теплоемкость смеси подчиняется закону аддитивности
- теплоемкость смеси подчиняется закону аддитивности
 - скрытая теплота смеси подчиняется закону аддитивности
- скрытая теплота смеси подчиняется закону аддитивности
Тепловой баланс конденсатора: 

 теплота конденсации паров
теплота конденсации паров
Поверхность куба определяется из основного уравнения теплопередачи:
 , где
, где  – коэффициент теплопередачи при кипении.
– коэффициент теплопередачи при кипении.
Расчет процесса периодической дистилляции
Материальный баланс по компоненту из – за изменения концентрации и количества смеси в кубе записывается в дифференциальной форме:

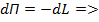

 – закон, связывающий количество жидкости L в кубе и текущую концентрацию вещества в кубе х:
– закон, связывающий количество жидкости L в кубе и текущую концентрацию вещества в кубе х: . Интеграл берется графически с использованием х – у – диаграммы:
. Интеграл берется графически с использованием х – у – диаграммы:


Стадия нагревания смеси в кубе. Баланс из – за меняющейся температуры в кубе записывается в дифференциальной форме:


Стадия кипения (дистилляции):
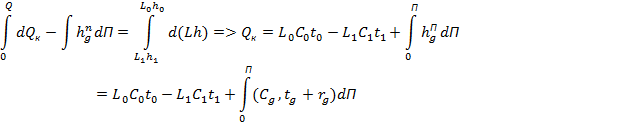
Алгоритм определения связи между  и П приведен ниже:
и П приведен ниже:
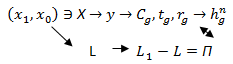

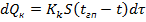

Задается промежуточная концентрация  , определяется текущее L и П, y =
, определяется текущее L и П, y = , затем текущее Q и
, затем текущее Q и . Строится кривая и вычисляется зачерненная площадь. Она равна некому интегралу.
. Строится кривая и вычисляется зачерненная площадь. Она равна некому интегралу.

 , при фиксированной S
, при фиксированной S
Перегонка с водяным паром
Применяется для вещества, которое нежелательно нагревать до высоких температур, т.к. они разлагаются при кипении под атмосферном давлением. Для понижения температуры кипения к целевому компоненту добавляют несмешивающееся вещество (чаще всего воду).
Информация в лекции "19 Обезвоживание осадков" поможет Вам.
Вода – бензол
 P =
P =  - по закону Дальтона
- по закону Дальтона
Надо смешать «б» и «в» в таких количествах, чтобы они выкипели одновременно:
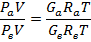
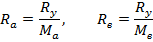
 соотношение, определяющее расходы компонентов.
соотношение, определяющее расходы компонентов.





 молекулярное течение, все уравнения переноса берутся из статической физики –
молекулярное течение, все уравнения переноса берутся из статической физики – 

















