Скорость химических реакций
Скорость химических реакций
Под скоростью химической реакции понимается изменение количества вещества за какой-то промежуток времени:
 .
.
Различают скорость реакции в гомогенных (однородных) и гетерогенных (неоднородных) системах. В гомогенных системах реакции протекают по всему объему:
 .
.
В гетерогенных системах реакции протекают на границе фаз, поэтому изменение количества вещества относят к площади раздела фаз:
 .
.
Скорость реакции зависит от следующих факторов:
· природа реагирующих веществ;
Рекомендуемые материалы
· концентрация реагирующих веществ;
· газовое давление;
· температура.
Зависимость скорости реакции от концентрации реагирующих веществ подчиняется закону действия масс.
Запишем химическую реакцию в общем виде:
 .
.
Если считать, что реакция протекает в гомогенной среде, то закон действия масс для неё выглядит следующим образом:
 ,
,
где
[А] и [В] - молярные концентрации веществ А и В;
а и в - показатели степеней, соответствующие количеству моль веществ А и В;
к - константа скорости реакции, зависящая от температуры, но не зависящая от концентрации реагирующих веществ.
Рассмотрим закон действия масс для конкретных реакций:
 .
.
Цинк - твердое вещество, его участие в реакции учитывается константой скорости химической реакции.
Влияние температуры на скорость химической реакции подчиняется уравнению Вант-Гоффа:
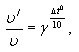
где
ν - начальная скорость реакции;
ν'- измененная скорость;
γ- температурный коэффициент;
Δt0- изменение температуры реакции.
При изменении температуры на 10oС, скорость реакции  изменяется в 2÷4 раза, т. е. температурный коэффициент находится в пределах от 2 до 4.
изменяется в 2÷4 раза, т. е. температурный коэффициент находится в пределах от 2 до 4.
Обратите внимание на лекцию "24.3 Документы".
Зависимость константы скорости реакции от температуры также подчиняется уравнению Вант-Гоффа:
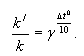
Пример решения задачи
При 20oС скорость реакции составляет 0,5. Чему равна скорость той же реакции при 70oС, если температурный коэффициент равен 2?
Решение
 .
.





















