Обратимые реакции
Обратимые реакции
Обратимыми называются реакции, в которых ни одно из исходных веществ до конца не расходуется. Обратимые реакции с определенного момента протекают в обоих направлениях - прямом и обратном:
 .
.
В обратимых реакциях устанавливается состояние равновесия, которое выражается в равенстве скоростей прямой и обратной реакций:

Состояние равновесия характеризуется константой равновесия (Кр):
 .
.
Индекс "р" означает равновесные концентрации веществ.
Состояние равновесия устойчиво и может сохраняться как угодно долго, пока на систему не будет оказано какое-либо внешнее воздействие:
Рекомендуемые материалы
· изменение концентрации реагирующих веществ;
· изменение газового давления;
· зменение температуры.
Нарушение состояния равновесия обратимой реакции означает, что скорости прямой и обратной реакций не равны друг другу. В зависимости от этого, равновесие обратимой реакции смещается либо в прямом  , либо в обратном
, либо в обратном  направлении.
направлении.
Направление смещения обратимой реакции подчиняется принципу Ле Шателье: "Если на систему, находящуюся в равновесии, оказать какое-либо внешнее воздействие, то равновесие сместится в таком направлении, чтобы ослабить оказанное воздействие".
Рассмотрим примеры смещения равновесия.
Дана система:
 .
.
Если увеличить концентрацию одного из исходных веществ (или одновременно обоих), то скорость прямой реакции превысит скорость обратной, и равновесие сместится в прямом направлении. Другими словами, система должна понижать повышенную концентрацию исходных веществ и смещаться в сторону образования продуктов реакции.
На примере этой же реакции рассмотрим смещение равновесия при изменении давления.
При увеличения давления равновесие смещается в сторону уменьшения числа молей.
При уменьшении давления равновесие сдвигается в сторону возрастания числа молей газообразных веществ, т. е. в сторону увеличения давления.
Следовательно, относительно рассматриваемой реакции при увеличении давления равновесие смещается в прямом направлении, в сторону образования аммиака, при понижении давления - в обратном направлении, в сторону исходных веществ.
Фактором, который определяет направление смещения равновесия при изменении температуры, является тепловой эффект реакции. Реакция является эндотермической, если протекает с поглощением тепла. Реакция, протекающая с выделением тепла, называется экзотермической.
Реакция синтеза аммиака:
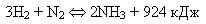
является экзотермической; реакция разложения аммиака на водород и азот - эндотермическая.
При повышении температуры усиливается эндотермическая реакция, при понижении температуры - экзотермическая реакция.
В рассматриваемой реакции при повышении температуры равновесие смещается в обратном направлении, а при понижении температуры - в прямом, в сторону образования аммиака.
Пример решения задачи
При состоянии равновесия в системе:

вещества имели следующие концентрации:
водород - 6 моль/дм3;
азот - 5 моль/дм3;
аммиак - 2моль/дм3.
Найти константу равновесия системы и начальные концентрации исходных веществ.
Решение
 .
.
Начальная концентрация исходных веществ частично расходуется (реагирует), образуя продукты реакции.
Концентрации исходных веществ, оставшаяся к моменту установления равновесия, называется равновесной.
Отсюда:
[исх. в-во] нач = [исх. в-во]прореаг. + [исх. в-во]равнов.,
т. е.
[Н2] нач = [Н2]прореаг. + [Н2]равнов
[N2] нач = [N2]прореаг. + [N2]равнов.
В лекции "6.4 Внешняя политика" также много полезной информации.
Из уравнения реакции
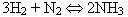
видно, что 3 моль Н2 приводит к образованию 2 моль NH3.
Составим пропорцию:























