150323 (598866), страница 2
Текст из файла (страница 2)

подставить значения , и  из таблиц. Например, для воды U1400 м/с. Здесь уместно отметить, что скорость звука в морской воде, согласно [5], зависит от температуры, солёности и гидростатического давления. Необходимо также подчеркнуть, что скорость звука – важная величина, во многом характеризующая физические свойства тел. Зная скорость звука, можно определить упругие постоянные твердых тел, их зависимость от температуры, сжимаемость, отношение теплоемкостей для жидкостей и твердых тел.
из таблиц. Например, для воды U1400 м/с. Здесь уместно отметить, что скорость звука в морской воде, согласно [5], зависит от температуры, солёности и гидростатического давления. Необходимо также подчеркнуть, что скорость звука – важная величина, во многом характеризующая физические свойства тел. Зная скорость звука, можно определить упругие постоянные твердых тел, их зависимость от температуры, сжимаемость, отношение теплоемкостей для жидкостей и твердых тел.
СПОСОБ ОПРЕДЕЛЕНИЯ СV ДЛЯ ИДЕАЛЬНОГО ГАЗА.
Теплоемкость газа при постоянном объёме определяется выражением Найдём связь между изменениями внутренней энергии системы и её температуры при постоянном значении р.
Найдём связь между изменениями внутренней энергии системы и её температуры при постоянном значении р.
 (5.1)
(5.1)
где учтены соотношения (3.1) и (2.2).
Найдём также связь между изменениями внутренней энергии системы и её температуры при адиабатическом процессе.
 (5.2)
(5.2)
где использовано соотношение, объединяющее первое и второе начала термодинамики и выражение (2.12).
Отвлекаясь от процессов, протекающих в системе, можно показать, что для идеального газа

Такое же заключение для ,
,
но с помощью статистического метода сделано в [6]. Читателям представляем возможность дать удовлетворительное, с точки зрения законов термодинамики, объяснение равенства выражений (5.3).
Отметим, что для реального газа, подчиняющегося уравнению Ван-дер-Ваальса после подстановки соответствующих частных производных, при замене давления его значением, найдём

ОБ ИЗМЕНЕНИЯХ ВНУТРЕННЕЙ ЭНЕРГИИ ПРИ ДРУГИХ ИЗОПРОЦЕССАХ.
Найдём связь между изменениями энтропии и внутренней энергии
при постоянных значениях других параметров системы.
 , (6.1)
, (6.1)
где использовано (5.1).
 (6.2)
(6.2)
где применены формулы (3.1) и (2.8).
Из выражения (6.1) вытекает, что для идеального газа
 (6.3
(6.3
) (6.3)
Сравнивая это значение с
 (6.4)
(6.4)
придём к выводу, что при изохорическом и изобарическом процессах одинаковому изменению энтропии соответствует неодинаковое изменение внутренней энергии. Нетрудно также заметить, что для идеального газа, согласно (6.2), изменение энтропии, связанное или с изменением объёма, или же давления, не приводят к изменению внутренней энергии.
Найдём связь между изменениями давления и внутренней энергии системы при адиабатическом, изотермическом и изохорическом процессах.
 (6.5)
(6.5)
 (6.6)
(6.6)
 (6.7)
(6.7)
В случае идеального газа формулы (6.5) и (6.7) дают
 откуда
откуда  (6.8)
(6.8)
Это соотношение показывает, что при изохорическом м адиабатическом процессах одинаковому изменению давления соответствуют неодинаковые изменения внутренней энергии. Читателям представляем возможность самим выяснить физическую сущность различия этих величин. Мы только отметим, что при изохорическом процессе система не совершает работы, а изменение давления может происходить за счёт подводимого к системе или отводимого от системы количества теплоты. При адиабатическом же процессе изменение давления может быть обусловлено либо работой системы, против сил, за счет её внутренней энергии, либо же работой, совершенной над системой.
Найдём связь между изменениями объёма системы и её внутренней энергией при изобарическом процессе.
 (6.9)
(6.9)
где были учтены (6.1), (2.15) и (2.2).
Для идеального газа выражение (6.9) даёт
 (6.10)
(6.10)
Сравним это значение с ранее полученным (3.1) и выражением
 (6.11)
(6.11)
Для идеального газа, на основании (3.1),

Из (6.10) и (6.11) следует:

откуда
 (6.12)
(6.12)
Объяснение причин различия значений этих величин должно быть подобно объяснению различия величин (6.8). Только в полученном выражении изменения объёма системы и её внутренней энергии при адиабатическом процессе имеют противоположные знаки, а при изобарическом – одинаковые.
ВЫВОД НЕКОТОРЫХ ПОЛЕЗНЫХ ТЕРМОДИНАМИЧЕСКИХ СООТНОШЕНИЙ.
1. Найдём разность теплоёмкостей СР и СV.

откуда
 (7.1)
(7.1)
Отметим, что поскольку соответствующие частные производные в выражении (7.1) имеют положительные знаки, то при температурах выше абсолютного нуля СР>CV, а при температурах, близких к абсолютному нулю

поэтому СР = СV , и так как при тех же температурах

то СР =СV=0.
2. Найдём связь между изменениями давления и энтропии при постоянном значении внутренней энергии системы
 (7.2)
(7.2)
где использованы соотношения (2.7), (2.12), (2.17) и значения соответствующих частных производных от внутренней энергии. Нетрудно заметить, что для газов, при постоянном значении внутренней энергии, увеличение давления сопровождается уменьшением энтропии. Это и понятно, так как энтропия связана с вероятностью, а при увеличении давления уменьшается вероятность состояния системы.
3. Найдём связь между изменениями отдельных параметров системы при постоянном значении внутренней энергии.
 (7.3)
(7.3)
В случае идеального газа имеем:
 (7.4)
(7.4)
Этого и следовало ожидать, поскольку внутренняя энергия идеального газа зависит от температуры. Поэтому условию U=const соответствует T=const. Для реальных газов условие (7.4) не выполняется.
 (7.5
(7.5
)Гч /-• ^ .6
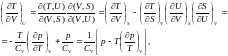 (7.6)
(7.6)  (7.7)
(7.7)
Нетрудно убедиться, что для идеального газа
 (7.8)
(7.8)
Найдём связь между изменениями отдельных параметров системы и её теплосодержанием.
 (7.9)
(7.9)
 (7.10)
(7.10)
 (7.11)
(7.11)
 (7.12)
(7.12)
Однако это значение частной производной можно определить и более простым способом, если учесть, что I=U+pV и dI=dU+d(pV). Тогда

Важно подчеркнуть, что одно и то же значение частной производной, при постоянном значении выбранного параметра, можно получить несколькими способами в зависимости от выбора промежуточных переменных. Учитывая это, при решении задач, можно ввести такие якобианы, тождественно равные единице, которые относительно быстро приведут к цели. Покажем это на одном примере.
-
![]() (7.13)
(7.13)
где были использованы (3.1) и (2.2).
-
![]() (7.14)
(7.14)
Аналогичное значение, но с помощью введения переменных S и p было получено ранее в выражении (6.9).
Приведённый пример показывает, что для проверки правильности нахождения одной и той же термодинамической величины можно использовать несколько вариантов, хотя и в данном примере использованы не все.
СПОСОБЫ ОПРЕДЕЛЕНИЯ CP ДЛЯ ИДЕАЛЬНОГО ГАЗА.
Из объединённого выражения обоих начал термодинамики следует, что если подвод теплоты к системе осуществляется при изобарическом процессе, то TdS=CPdT, или
Однако, теплоемкость Cp для идеального газа можно определить как частную производную от тепловой функции по температуре. Действительно, при изобарическом процессе
 (8.1)
(8.1)
Это соотношение нетрудно понять, поскольку при р=const
dI=TdS+Vdp=TdS=CpdT.
Найдём связь между изменениями температуры и тепловой функции при изохорическом процессе.
 (8.2)
(8.2)
где учтено выражение (7.11).
В случае адиабатического процесса изменения тех же величин дают:
 (8.3)
(8.3)
где использованы соотношения (2.2), (2.8), (7.10) и (8.2).
Непосредственной проверкой нетрудно убедиться, что для идеального газа
 (8.4)
(8.4)
Читателям представляется возможность найти удовлетворительное, с точки зрения законов термодинамики, объяснение выражений (8.4).
По аналогии с вышеприведенными примерами, можно решить большое количество задач, связанных со свободной энергией, энтальпией и термодинамическим потенциалом Гиббса.
Вышеприведенные примеры убедительно доказывают преимущество такого подхода к решению задач термодинамики. Этим способом, в основном, решаются и задачи, связанные с термодинамикой стержней, диэлектриков и магнетиков, примеры которых приведены в [4] и [7], для которых можно учесть электро- и магнитострикционные явления, пьезоэлектрический и пьезомагнитный эффекты, а также и задачи, связанные с химическим потенциалом, когда количество вещества в системе изменяется .
Применение якобианов, особенно после изучения свойств термодинамических функций и их дифференциалов, позволяет более доступным способом решить ту или иную задачу, и, что очень важно, даёт возможность, даже при решении одной задачи, охватывать большой материал, предусмотренный программой. Преимущество такого подхода к рассмотрению отдельных, или группы, вопросов, как показали наши наблюдения, не вызывает сомнений как с точки зрения корректности математических выражений, так и логичности и взаимосвязи явлений термодинамики.
СОСТАВЛЕНИЕ ДЕТЕРМИНАНТОВ ЯКОБИ И ТАБЛИЦЫ ТЕРМОДИНАМИЧЕСКИХ КОЭФФИЦИЕНТОВ ДЛЯ СИСТЕМ, ОПИСЫВАЕМЫХ БОЛЬШИМ ЧИСЛОМ ПЕРЕМЕННЫХ.
В качестве примера рассмотрим систему, описываемую тремя независимыми переменными, например, систему с переменным количеством вещества. В этом случае дифференциалы термодинамических функций имеют вид:
dU=TdS-pdV+dN, (9.1)
dF=-SdT-pdV+dN, (9.2)
dI=TdS+Vdp+dN, (9.3)
dФ=-SdT+Vdp+dN (9.4)
где dN – изменение числа молей вещества , а – химический потенциал, имеющий размерность энергии в расчете на количество молей.
Из выражения (9.1) получим следующие соотношения:
 (7.13)
(7.13) (7.14)
(7.14)















