Профилактика контактной и имплантационной инфекции
1.3. Профилактика контактной и имплантационной инфекции. Стерилизация и дезинфекция.
ПРОФИЛАКТИКА КОНТАКТНОЙ И ИМПЛАНТАЦИОННОЙ ИНФЕКЦИИ. СТЕРИЛИЗАЦИЯ И ДЕЗИНФЕКЦИЯ
Стерилизация достигается с помощью физических и химических методов. К физическим методам относятся термическая и лучевая стерилизация (кипячением, стерилизация паром под давлением, сухожаровая стерилизация, гамма-облучение). Химические методы стерилизации включают в себя стерилизацию окисью этилена, обработку надуксусной кислотой, а также химиотерапевтическую обработку. Кроме того, для создания асептических условий в операционных или в изоляторах используют физиотерапию воздуха с целью очищения его от бактерий.
Наиболее надежными считаются термические способы стерилизации, лучевая стерилизация и стерилизация окисью этилена.
При термических способах стерилизация производится либо водяным паром в автоклаве при температуре 120—132С (рис. 1), либо сухим паром в сухожаровых стерилизаторах (шкаф) при температуре 170—200°С.

Стерилизация паром. Горячий водяной пар служит переносчиком тепла. Он действует интенсивнее, чем горячий воздух, так как высокая теплоемкость пара при конденсации переносится на стерилизуемый объект. Одновременно пар действует как непосредственный стерилизующий агент путем гидратирования, коагуляции и гидролиза белков
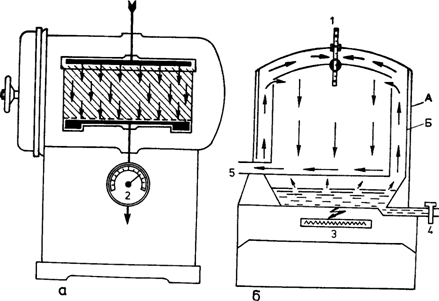
Рис. 16. Схемы (а, б) парового стерилизатора (автоклава):
Рекомендуемые материалы
А — наружная стенка стерилизатора; Б — внутренняя стенка стерилизатора; 1 — термометр; 2 — манометр; 3 — источник тепла; 4 — вводный кран; 5 — выпускной кран.
Аппарат для стерилизации паром под давлением (автоклав) состоит из двух металлических цилиндров разного диаметра, вставленных один в другой так, что между ними остается пространство, которое наполняется водой (рис. 16). Во внутреннюю камеру автоклава кладут стерилизационные коробки с фильтром, биксы перевязочного материала или пакеты с инструментами в двухслойной упаковке из бязи или в пергаментной бумаге. Плотно завинчивают боковую дверь парового стерилизатора и начинают стерилизацию в заданном режиме. Паровой стерилизатор оборудован термометром, манометром (указывает давление пара внутри аппарата) и предохранительным клапаном, который срабатывает при нарастании избыточного давления.
Автоклавирование проводится при давлении пара 1,1+0,1 кгс/см2
в течение 45+3 мин или 2,0 ±0,1 кгс/см2 в течение 20+2 мин.
Все предметы, которые не выдерживают высокой температуры жаровой стерилизации и для которых температура пара не является повреждающей, должны стерилизоваться автоклавированием (перевязочный материал, резиновые и синтетические предметы, бумажные фильтры, закрытые ампулы и банки с водосодержащими препаратами и др.).
По окончании стерилизации пар из аппарата удаляют через выпускной кран в воду и выводят в канализационный сток. Отвинчивают боковой люк, выпускают остаток пара и в течение некоторого времени проводят сушку материала теплом стенок стерилизатора.
Сухожаровая стерилизация. При сухожаровой стерилизации (рис. 17) происходит разогревание стерилизуемых объектов. Так как горячий воздух в отличие от водяного пара служит только переносчиком тепла, температура стерилизуемых предметов должна достигнуть 170—200°С (180±14°С) при экспозиции 60+5 мин. Термическое распределение обеспечивают за счет поступления нагретого воздуха через специальный клапан в нижней части воздушного стерилизатора, а его выход — через верхний клапан. При подъеме воздух отдает тепло стерилизуемым объектам.
Путем сухожаровой стерилизации можно обрабатывать все термостабильные, негорючие материалы из стекла, металла или фарфора. Сухожаровая стерилизация непригодна для перевязочного материала, резины, катетеров, изделий из бумаги и пластиков. Стерилизуемые объекты, например шприцы, закладывают чистыми и сухими в холодный аппарат (рис. 18). Добавление новых материалов и предметов для стерилизации недопустимо. После отключения воздушного стерилизатора необходимо дождаться снижения температуры до 80 °С. Подключенный к электросети стерилизатор нельзя открывать, так как поступление кислорода может привести к воспламенению. Несмотря на наличие автоматики и программированного управления, автоклавы и сухожаровые стерилизаторы недопустимо оставлять без присмотра персонала.
Лучевая стерилизация. Этот вид стерилизации осуществляется ионизирующим излучением большой энергетической мощности, проникающим в стерилизуемый материал на различную глубину. В практических целях применяются бета- и гамма-излучение. Для стерилизации гамма-излучением изотопами 60Со и 137Cs доза облучения должна быть весьма значительной — не менее 2,5 мрад (25000 Гр), чтобы исключить возможность оставления жизнеспособной Особенно удобна стерилизация гамма-излучением сывороток, вакцин, биологических тканей, лекарственных препаратов, медицинских изделий одноразового пользования (системы для переливания крови, атравматические иглы, трахеостомические канюли, электрокардиостимуляторы и т. п.). Существенным препятствием к широкому внедрению лучевого метода стерилизации является опасность проникающей радиации для людей. Это заставляет создавать громоздкую систему противолучевой защиты гамма-установок, что по силам только мощным специализированным учреждениям.
Возможна также стерилизация ультразвуком. Стерилизаторы наполняют слабым антисептиком (0,05% водный раствор хлоргексидина биглюконата), в котором под воздействием ультразвуковых волн стерилизуют хирургический инструментарий, мелкие пластмассовые изделия или производят дезинфекцию рук.
Химическая стерилизация. Увеличение числа приборов и устройств, которые трудно стерилизовать традиционными методами, способствовало появлению новых методов стерилизации. Под химической (холодной) понимают стерилизацию с помощью окиси этилена или сильнодействующих антисептиков (0,2% раствор надуксусной кислоты, 6% раствор перекиси водорода, 0,1%-терги-цида, 0,5% спиртовой раствор гибитана, сайдекс, тройной раствор и др.). Холодная стерилизация осуществляется в условиях, при которых температура не превышает температуры коагуляции белка (от 45 до 60 °С; рис. 19).
 Рис. 19. Камера для новой стерилизации пароформалиновой стерилизации
Рис. 19. Камера для новой стерилизации пароформалиновой стерилизации
Окись этилена, оказывающая бактерицидное действие за счет алкилирования протеинов бактерий, растворима в воде, спиртах. При нормальных атмосферных условиях это бесцветный газ с неприятным эфирподобным запахом.
Применяются портативные газовые стерилизаторы с полезным объемом 2—3 л (ГДР, ВНР). При температуре 55°С, концентрации окиси этилена 750—1000 мг/л и соответствующей влажности газа успешно используется управляемая программа стерилизации при небольшом избыточном давлении, что предотвращает улетучивание газа. Газовые стерилизаторы не требуют большого помещения, необходимо наладить лишь вентиляцию; после стерилизации оставшийся газ удаляют через выпускники камеры в вытяжные трубы.
С помощью газовой стерилизации следует обрабатывать лишь те предметы, которые не выдерживают стерилизацию в автоклаве или воздушном стерилизаторе. Окисью этилена стерилизуют катетеры из искусственных материалов, хирургические перчатки, протезы сосудов, эндоскопы, кардиостимуляторы, отдельные узлы респираторов и аппаратов искусственного кровообращения с выдержкой 6—16 ч. Изделия, простерилизованные газовым методом, применяют после выдержки в вентилируемом помещении в течение 1—5 сут.
Проверка качества стерилизации. Вещества и предметы считаются стерильными, если они в упакованном виде обработаны термическим путем или облучением и если эффект стерилизации подтвержден индикатором стерильности. Контроль работы воздушных и паровых стерилизаторов проводят с применением химических тест-индикаторов и с помощью максимальных термометров.
Показателями качества работы стерилизаторов являются:
изменение исходного состояния (цвет, агрегатное состояние) химических тест-индикаторов и отклонение температуры в различных точках камеры парового стерилизатора от номинального значения в пределах Т±2°С.
Контроль работы воздушных стерилизаторов осуществляется цветным термоиндикатором ТИК № 6 и гидрохиноном. Нанесенная на бумагу термоиндикаторная краска марки ТИК № 6 светло-салатового цвета при температуре 175—180°С становится темно-коричневой. Гидрохинон в количестве 0,3 г помещается в стеклянный флакон. При температуре 170—175°С серо-коричневый порошок гидрохинона превращается в расплавленную массу черного цвета.
Работу парового стерилизатора ежедневно контролируют тест-индикатором мочевины или бензойной кислоты с фуксином. При режиме стерилизации 132 °С и давлении в 2 ат белый порошок мочевины плавится, превращаясь в аморфную массу того же цвета (в биксы помещается флакончик с мочевиной в количестве 0,3 г). При режиме стерилизации 120 °С и давлении в 1,1 ат в качестве индикатора применяют бензойную кислоту с фуксином, фуксин выполняет роль красителя. При температуре, близкой к пару (120 °С), бензойная кислота с кислым фуксином расплавляются, превращаясь в аморфную массу красного цвета, а с основным фуксином — синего цвета. Применение серы для контроля эффективности стерилизации не рекомендуется.
Контроль за качеством стерилизации окисью этилена проводят с использованием индикоторов в виде раствора глицерола с этиленом (раствор I) и бромида лития, бромкрезолового пурпурного с этанолом (раствор II).
Помимо обязательного ежедневного контроля эффективности стерилизации в стерилизаторе пробой на достижение точки плавления раз в неделю (выборочно) или через 10 дней проводят бактериологический контроль материала. Бактериологический контроль является самым надежным методом контроля стерильности. Его недостатком является продолжительный период и трудоемкость исследования. В связи с этим в клинической практике широко используются перечисленные экспресс-методы.
СТЕРИЛИЗАЦИЯ ИНСТРУМЕНТОВ
Использованные инструменты подвергают предстерилизационной очистке. Режим очистки складывается из промывания их горячей водой в течение 30 сек с последующим замачиванием в специальной емкости в моющем растворе (температура моющего раствора 50°С, экспозиция 15 мин). После этого инструменты моют ершом или ватно-марлевым тампоном в моющем растворе в течение 30 сек, споласкивают проточной водой, кипятят в течение 5 мин в дистиллированной воде и сушат горячим воздухом при температуре 85°С. Качество предстерилизационной очистка инструментов оценивают путем постановки ампдопириновой, бензидиповой (реже орто-толуидиновой) и фенолфталеиновой проб на наличие остаточных компонентов моющего препарата и крови. При положительной пробе на кровь или моющие средства вся группа контролируемых изделий подлежит повторной обработке до получения отрицательного результата.
Изделия медицинского назначения, используемые при проведении гнойных операций или манипуляций у инфицированных больных, перед предстернлнзационной очисткой проходят дезинфекцию. Изделия из коррозионно-нестойких материалов обеззараживают преимущественно кипячением в 2% растворе гидрокарбоната натрия в течение 30 мин, при наличии анаэробной инфекции продолжительность кипячения составляет 90 мин. Дезинфекцию изделий медицинского назначения осуществляют погружением в 1% раствор хлорамина на 30 мин, 3% перекиси водорода с 0,5% моющих средств на 80 мин, 0,1% дезоксоп-1 (по надуксусной кислоте) на 15 мин.
В воздушных стерилизаторах стерилизацию производят при температуре 180°С в течение 60 мни. При стерилизации воздушным методом режущие инструменты (иглы, лезвия, скальпели) не тупятся. Наборы инструментов также стерилизуют в автоклаве при 1,1 ат в течение 45 мин или 20 мин при 2 ат. Срок сохранения стерильности инструментов 3 сут.
Хирургические инструменты из коррозионно-стойких металлов и изделия из пластмасс (резины) можно стерилизовать в 6% растворе перекиси водорода при температуре 18°С в течение 360 мин или I80 мин при 50°С. Изделия из резины, пластических масс и корозионно-стойких металлов стерилизуют также в 1% растворе дезоксона-1 (по надуксусной кислоте), время обработки 45±5 мин. Дезинфекцию инструментов можно производить тройным раствором (2% формалин, 0,3% фенол, 1,5% двууглекислая сода) в течение 45 мин, 0,1% раствором сульфохлорантина и 1% дихлором-1 в течение 30 мин.
Шприцы стерилизуют в разобранном виде: в связи с различным коэффициентом расширения стекла (цилиндра) и металла (поршень) при стерилизации в собранном виде цилиндры часто трескаются. Стерилизацию осуществляют в централизованных стерилизационных в воздушных стерилизаторах при температуре 180°С в течение 60 мин. Шприцы хранят в стерильной упаковке. Желательно пользоваться шприцами одноразового пользования, прошедшими стерилизацию гамма-излучением или окисью этилена. В амбулаторной практике возможна стерилизация шприцев кипячением в течение 45 мин.
В последние годы находят применение дезинфекция или стерилизация эндоскопов, пластмассовых катетеров, преобразователей и других изделий с помощью 2% растворов глутарового диальдегида (активатор) и гипохлорида натрия (ингибитор коррозии), входящего в состав препарата сайдекс; срок обработки 45—180 мин. Применяется также 0,1% раствор тергицида в течение 30—60 мин.
Мочеточниковые катетеры и эндоскопы можно стерилизовать и одним из ранее предложенных способов:
1. Помещение в специальные герметические закрывающиеся стерилизаторы, на дно которых кладут таблетки формальдегида. Стерилизация обеспечивается парами формалина при экспозиции 48 ч.
2. Опускание на 10 мин в этанол, затем на 5 мин в раствор цианида ртути (1 : 1000); перед употреблением протереть этанолом.
Отдельные узлы аппаратов искусственного кровообращения, искусственной почки, респираторов и других приборов стерилизуют кипячением, в воздушном стерилизаторе, в катионно-анионных растворах или окисью этилена. При пользовании окисью этилена продолжительность стерилизации составляет 6—16 ч. Перед употреблением узлы аппаратов промывают дистилированной водой.
СТЕРИЛИЗАЦИЯ ПЕРЕВЯЗОЧНОГО МАТЕРИАЛА И ОПЕРАЦИОННОГО БЕЛЬЯ
Перевязочный материал и белье, используемые во время операций и при перевязках, должны быть стерильны. В качестве перевязочного материала применяют марлю, вату и лигнин, основными свойствами которых являются хорошее впитывание жидкостей (гигроскопичность), мягкая поверхность и эластичность. Они должны хорошо переносить воздействие высокой температуры во время стерилизации. Чаще всего применяется марля.
Марля — хлопчатобумажная ткань, которая после особой обработки делается мягкой, белой, обезжиренной и гигроскопичной. Нити этой ткани не прилегают друг к другу, а расположены в виде мелкой сетки. Из марли делают бинты различной ширины, салфетки, тампоны, шарики и др. Более плотная марля менее гигроскопична. Складывая салфетки, шарики, тампоны и т. п., необходимо завернуть края марли внутрь, чтобы обрывки нитей не попадали в рану и не препятствовали ее заживлению.
Вату как белую (гигроскопическая), так и серую (негигроскопическая) делают из хлопка. Ограниченно применяется и вата из искусственных волокон. Большим преимуществом белой ваты является ее гигроскопичность, однако при перевязках вату всегда укладывают над марлей из-за ее свойства прилипать к поверхности и краям раны.
Лигнин изготавливают из древесины, он на редкость гигроскопичен, однако в присутствии раневого оделяемого разлагается, что препятствует его широкому применению.
В качестве операционного белья используют большие и малые простыни, салфетки, полотенца, пеленки, халаты для медицинского персонала, нарукавники, маски, шапочки и т. д.
Перевязочный материал и операционное белье стерилизуют в автоклаве при высокой температуре под давлением пара 1,1 ат в течение 45 мин (температура 120 °С) или 2 ат в течение 20 мин (132°С). Наиболее удобны для стерилизации и хранения материала стерилиза-ционные коробки с фильтром и металлические барабаны или биксы Шиммельбуша — металлические коробки различной величины и формы с крышкой и отверстиями по бокам (рис. 21, 22). Эти отверстия открывают во время стерилизации, передвигая вокруг бикса металлический ободок. Перевязочный материал или операционное белье укладывают в металлических биксах (иногда в брезентовых мешках) так, что каждый предмет занимает определенный сектор.
После завершения стерилизации металлический ободок бикса тут же закрывают. Биксы хранят в закрытом помещении, ключ от которого находится у старшей операционной сестры. Срок сохранения стерильности перевязочного материала или операционного белья в биксах составляет 3 сут. Стерилизация перевязочного материала и операционного белья в воздушных стерилизаторах при температуре 180 °С не пригодна, так как материал портится.
СТЕРИЛИЗАЦИЯ ПЕРЧАТОК
Для стерилизации резиновых перчаток пользуются следующими методами:
1. Пересыпают их пудрой или тальком, завертывают в марлевую салфетку, укладывают в биксы Шиммельбуша и стерилизуют в паровом стерилизаторе при температуре 120 °С под давлением 1,1 ат 45 мин.
2. Перчатки кипятят в воде 45 мин.
3. Перчатки погружают в раствор детергентов на 60 мин.
4. Стерилизуют перчатки в портативных газовых стерилизаторах окисью этилена.
Резиновые перчатки после использования моют под проточной водой с мылом, дезинфицируют в 1% растворе хлорамина 30 мин, прополаскивают в проточной воде и сушат. При возможности лучше пользоваться перчатками одноразового пользования, их стерилизация осуществляется гамма-лучами.
СТЕРИЛИЗАЦИЯ ШОВНОГО МАТЕРИАЛА
Хирургический шовный материал должен быть стерильным, прочным на разрыв и хорошо переноситься тканями, а после выполнения своей фиксирующей функции по возможности рассасываться. Стерилизация шовного материала достигается разными способами: термическим, химическим, гамма-облучением. Нити хранятся в стерильном виде в пластиковых упаковках или упаковках из алюминиевой фольги. Выпуск и стерилизация шовного материала в упаковке для многократного применения нежелательны.
По строению нити могут быть монофиламентными (монолитные), кручеными или плетеными. Более целесообразно использовать монофи-ламентные синтетические нити, которые из-за отсутствия фитильного эффекта препятствуют распространению инфекции. В атравматических иглах (не имеют ушка) конец нити заделывается в полый тупой конец иглы.
Шелковые нити являются естественным продуктом; в настоящее время выпускают также синтетический шелк. Они изготавливаются плетеными либо кручеными и имеют выраженный фитильный эффект, т. е. способность переносить жидкость и содержащиеся в ней бактерии; их преимущество — большая прочность. Шелк не рассасывается. Толщина шелковых нитей различна, от 00 до 16 (чем больше номер, тем толще нить).
В настоящее время медицинской промышленностью в отдельных случаях еще выпускается шелк в мотках для многократного применения, Стерилизацию шелка в подобных случаях производят следующим образом.
1. Мотки шелка моют в теплой воде с мылом, затем высушивают. Намотанный на катушку шелк опускают в эфир на 12—24 ч для обезжиривания. После извлечения стерильным инструментом из эфира шелк погружают на тот же срок в 70% этанол, после чего шелк кипятят 10 мин. Хранят стерильный шелк в герметически закрытых банках с 95% этиловым спиртом (метод Кохера). Перед употреблением подготовленный по данной методике шелк повторно кипятят 2 мин.
2. Мотки шелка раскручивают и моют два раза в мыльной пене, после чего несколько раз прополаскивают в теплой воде, сушат и наматывают на стерильные катушки. Обезжиривают в эфире в течение 12— 24 ч, после чего кипятят в дистиллированной воде 45 мин. С помощью стерильных инструментов шелк погружают в герметически закрытые банки с 95% спиртом на 6—12 ч, после чего он пригоден к применению. В герметических банках спирт меняют через каждые 7 дней.
Капроновые и лавсановые нити многократного применения стерилизуют в паровом автоклаве, как операционное белье, или кипячением, как инструменты в течение 45 мин.
Нерастворимые атравматические нити из искусственных синтетических волокон изготавливают из полиамидных (найлон, капрон, перлон,
супрамид) или полиэфирных (дакрон, мерсилен, тефлон) волокон. Они превосходят естественные нити по прочности и отсутствию реакции тканей, стерилизуются гамма-облучением или окисью этилена.
Кетгут является материалом органического происхождения. Изготовляют кетгут из подслизистого слоя тонких кишок крупного рогатого скота или свиней. Как гетерогенный белок, он может вызывать сильную реакцию тканей. Преимуществом кетгута является то, что через 6—12 дней он резорбируется в организме. За счет хромирования (хромированный кетгут) резорбция кетгута в организме может быть продлена до 15—40 дней. Задубленный кетгут не токсичен. Хромированный кетгут выпускается в ампулах или в упаковке из алюминиевой фольги с консервирующим раствором (спирт ректификат 96% 89 мл, глицерин 6 мл, бензин авиационный 1 мл, вода дистиллированная 4 мл), стерилизация гамма-облучением.
Полимеры гликолевой кислоты (дексон) или полипропилен (пролен), а также викрил являются искусственными рассасывающимися нитями. Рассасывающиеся синтетические нити имеют преимущество перед кетгутом, особенно при работе в инфицированной ране.
Металлические скобки и шовные нити из стали имеют повышенную прочность, стерилизуют их термическим способом (кипячением) или гамма-облучением.
ДЕЗИНФЕКЦИЯ
Дезинфекция достигается с помощью химических и физических методов.
Под физическими методами понимают использование сухого жара или водяного пара, кипячение, ультрафиолетовое облучение. Наиболее наглядным примером применения их является использование водяного пара под повышенным давлением для дезинфекции матрацев и термолабильных текстильных изделий. Для этого используют специальные пароформалиновые камеры.
Для химической дезинфекции установлены следующие требования: надежное и быстрое действие против всех патогенных микроорганизмов, устойчивость растворов на воздухе и на свету, безвредность для человека и животных, хорошая переносимость материалов и полезный эффект при наименьшей концентрации. Следует принять во внимание, что универсального дезинфицирующего средства не существует. Кроме раствора йода спороцидным действием обладает только надуксусная кислота (дезоксон-1).
В последние годы в области дезинфекции разрабатываются новые принципы, однако по-прежнему основное значение имеет хирургическая дезинфекция рук и дезинфекция операционного поля.
ХИРУРГИЧЕСКАЯ ДЕЗИНФЕКЦИЯ РУК
Целью хирургической дезинфекции рук является надежное освобождение их от микроорганизмов на длительный срок. Подготовка рук хирурга и его помощников к операции сопряжена с большими трудностями в связи с невозможностью использовать для этого высокую температуру и концентрированные растворы антисептиков. Особое затруднено обеззараживание рук от микробов, скапливающихся в выводных протоках сальных, потовых желез и в волосяных мешочках. В связи с этим наряду со смыванием бактерий и уничтожением их на поверхности кожи антисептиками все методы включают как обязательный компонент дубление кожи, чтобы сузить поры и воспрепятствовать проникновению этих микробов на ее поверхность во время операции.
Очень важны уход за руками и предупреждение их загрязнения. Стремление оградить кожу рук от различных травм, повреждений и загрязнений должно являться предметом постоянной заботы для тех, кто участвует в операции; ногти всегда должны быть коротко пострижены и чисты.
Принцип хирургической дезинфекции рук — сначала механическая очистка, а затем дезинфекция. Кисти и предплечья предварительно обрабатывают в течение 2—5 мин мылом и щеткой. Особое внимание уделяют обработке ногтевых лож, складок кожи, межпальцевых промежутков. После этого руки ополаскивают и вытирают стерильными салфетками. На заключительном этапе используют дезинфицирующие средства, которые должны отвечать следующим требованиям: 1) быстро убивать патогенную микрофлору; 2) надежно убивать микробы в перчаточном соке, чтобы руки оставались обеззараженными в течение всей операции; 3) обладать кумулятивным действием, чтобы руки хирурга оставались обедненными микроорганизмами и в промежутках между процедурами дезинфекции; 4) не оказывать раздражающего действия на кожу.
Классические способы обработки рук по Фюрбрингеру (Р. Furbrin-ger, 1897), Спасокукоцкому—Кочергину (1929) и другие в настоящее время оставлены, так как они занимают много времени. Применяются ускоренные методы хирургической дезинфекции рук.
/. Обработка рук раствором перекиси водорода и муравьиной кислоты (1970). Рецептуру «С-4» готовят в день операции из необходимого количества 30—33% перекиси водорода (пергидроля) и 85—100% муравьиной кислоты, которые смешивают в стерильном сосуде в соотношении 1 : 2,4 и хранят не более суток в посуде с герметической пробкой в прохладном месте. Для обработки рук используют 2,4% раствор рецептуры «С-4». Перед обработкой рук раствором рецептуры «С-4» их моют водой с мылом (без щетки) в течение 1 мин, вытирают насухо стерильной салфеткой, затем руки обрабатывают в течение 1 мин рецептурой «С-4» в эмалированном тазу, вытирают стерильной салфеткой и надевают стерильные перчатки (рис. 24, 25).
2. Обработка рук хлоргексидин биглюконатом (1977). Для обработки рук используют 0,5% спиртовой раствор препарата (препарат разводят в 70% спирте в соотношении 1:40). После предварительного мытья рук с мылом и последующего протирания стерильной марлевой салфеткой производят их обработку двумя ватными тампонами, смоченными в 0,5% спиртовом растворе хлоргексидина, в течение 2—3 мин.
Возможна обработка рук и 1% водным раствором (1:20) хлоргексидина в стерильном тазу в течение 3 мин. Рабочий раствор готовят, разводя 500 мл 20% оригинального раствора препарата в 10 л дистиллированной воды.
3. Обработка рук моющими средствами (1960). После предварительного мытья рук с мылом их на 3—5 мин погружают в таз с моющим средством (ОП-7, «Новость», «Астра»). Раствор моющих средств готовят непосредственно перед применением (1 столовая ложка порошка на 3 л теплой воды). После высушивания рук стерильной салфеткой их протирают в течение 3 мин 95% этанолом.
4. Обработка рук дегмином и дегмицидом (1968). Руки перед обработкой дегмином или дегмицидом моют теплой водой с мылом в течение 2—3 мин, тщательно ополаскивают их и протирают двумя тампонами, обильно смоченными 1% раствором препарата, по 3 мин каждым. После этого стерильными салфетками вытирают руки насухо и надевают стерильные перчатки.
5. Обработка рук церигелем (1971). Препарат содержит цетилпирииний хлорид — катионный детергент, обладающий большой поверхностной активностью Бесцветная опалесцирующая жидкость церигеля, нанесенная на кожу, после испарения спирта образует тонкую плотную асептическую полимерную пленку (воздействие поливинилбутираля).
После предварительной обработки рук мылом на сухую кожу наносят 3—4 г церигеля и в течение 8—10 с тщательно растирают так, чтобы препарат покрыл ладонные и тыльные поверхности, межпальцевые промежутки и дистальную треть предплечья. Руки высушивают на воздухе или под вентилятором в течение 2—3 мин, следя за тем, чтобы пальцы не соприкасались и были слегка согнуты. Способ обработки рук эффективен в эсренных ситуациях, во время работы в перевязочной, при первичной хирургической обработке ран и т. п. Полимерная пленка смывается с рук после операции или манипуляции 95% этиловым спиртом.
6. Обработка рук йодофором (1972). Очень эффективным и быстрым способом является обработка йодофором (1% йодопирон-поливинилпиролидон, повидон-йодин-бетадин) и гексахлорофеном в мыльном растворе (шампунь) в течение 3—5 мин. Одновременно достигается очистка и дезинфекция кожи рук, после чего их высушивают салфеткой и надевают стерильные перчатки.
7. Обработка рук ультразвуком. Сконструированы специальные аппараты с ультразвуковыми ваннами, в которых мытье и дезинфекция рук происходит в течение 1 мин. Руки погружают в раствор антисептика (0,05% водный раствор гибитана), через который пропускаются ультразвуковые волны, которые и обеспечивают дезинфекцию.
НАДЕВАНИЕ ОПЕРАЦИОННОЙ ОДЕЖДЫ
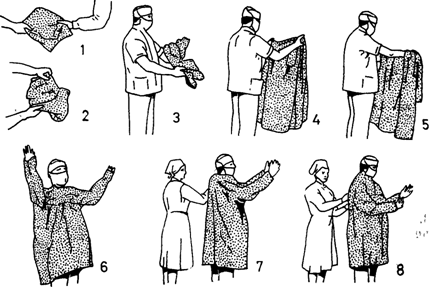
Медицинский персонал (хирург, ассистенты, операционные сестры) после хирургической дезинфекции рук надевают стерильные (свободные от микроорганизмов) халаты, покрывающие также руки до кисти и спину. Для операционных халатов не подходит рыхлый текстильный материал, многократно бывший в употреблении, так как он становится проницаемым для пота и бактерий, содержащихся на коже членов операционной бригады (появляются на халате уже через 30 мин работы). Лучше всего использовать белье и халаты из плотного импрегнированного хлопчатобумажного материала (рис. 26). Манжеты костюма и завязки должны быть эластичными и не сдавливать запястья и кисти. Маска должна плотно закрывать рот и нос.
После хирургической дезинфекции рук микроорганизмы на коже отсутствуют. Однако вскоре из протоков потовых желез, волосяных мешочков, микротрещин на поверхности кожи снова появляются микроорганизмы, поэтому с целью асептического проведения операции необходимо изолировать руки стерильными резиновыми перчатками (рис. 25). При надевании перчаток нельзя притрагиваться к их наружной поверхности оголенной рукой.
Во время работы в перчатках руки становятся влажными, в перчатках скапливается так называемый перчаточный сок, который содержит концентрат вирулентной микрофлоры, поэтому и перед операцией и во время ее необходимо обращать пристальное внимание на целость перчаток. Поврежденную перчатку необходимо тотчас же сменить. Если операция продолжительна, во время работы через каждые 45—60 мин перчатки обрабатывают 2,4% раствором первомура и протирают 96% этиловым спиртом. Чтобы перчатки легко снимались и надевались, кисти и внутреннюю поверхность перчаток следует обработать стерильной пудрой. Пудра, изготовленная на основе крахмала, полностью резорбируется, поэтому она имеет преимущество перед тальком.
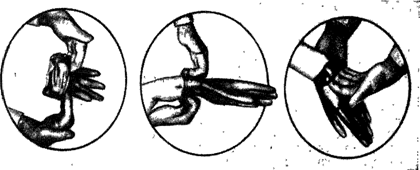
Рис. 25. Надевание хирургических перчаток
Рекомендуем посмотреть лекцию "5.10 Параллельный интерфейс".
Рис. 26. Схема надевания хирургического халата
ДЕЗИНФЕКЦИЯ ОПЕРАЦИОННОГО ПОЛЯ
Подготовка операционного поля начинается в предоперационном периоде (гигиеническая ванна, очистка загрязнений эфиром или бензином, обработка кожи зеленым или калиевым мылом, бритье волос в области операционного поля).
Для обработки кожи операционного поля в настоящее время чаще всего применяют йодонат, йодопирон, хлоргексидин биглюконат. Рабочий раствор йодоната готовят ex tempore путем разбавления исходного раствора в 4,5—5 раз кипяченой или стерилизованной водой. Кожу операционного поля без предварительного мытья спиртом обрабатывают двухкратным смазыванием стерильными тампонами, смоченными раствором йодоната или йодопирона (1% по свободному йоду), либо 0,5 % спиртовым раствором хлоргексидина биглюконата. Как показали многочисленные исследования, содержащийся в спиртовом растворе йод дубит кожу, однако недостаточно дезинфицирует ее, поэтому этот метод, некогда традиционный, не применяют.
Для обработки операционного поля используются и другие антисептические вещества (1% раствор дегмицида, 1% раствор роккала или катамина А—Б, 2,4% раствор первомура). Для дезинфекции слизистых их смазывают 1 % раствором бриллиантового зеленого, 3% раствором перекиси водорода, 1% раствором йодоната или йодопирона, а также 0,5% спиртовым раствором гибитана.
Для изоляции кожи операционного поля применяют специальную стерильную пленку (протектор).






















