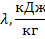Общая классификация холодильных машин
Лекция 2
Общая классификация холодильных машин.
| Тип | Вид использованной энергии | Фазовое состояние рабочего вещества |
| 1 | механическая | жидкость – пар |
Рекомендуемые материалыFREE Маран Программная инженерия Техническое задание -20% Помощь с курсовым проектом по технологии машиностроения Помощь с выполнением - КМ-3. Практическое задание 2 -70% Практическое задание 3 |Информатика СОО 2023 (ДО, СПДО, ПНК, КП, ПДО, ДОУА, СР 2 ЧАСТЬ) | НСПК Помогу выполнить - КМ-2. Моделирование ТЭС. Контрольная работа 2 | тепловая | жидкость – пар |
| 3 | тепловая | жидкость – пар |
| 4 | механическая | жидкость – газ |
| 5 | механическая | Газ |
| 6 | Электрическая | Твердое тело |

Источники тепла
Для всякой тепловой машины (ХМ, в которой осуществляется обратный термодинамический цикл, или энергетический цикл, в котором осуществляется прямой термодинамический цикл) необходимо два источника тепла: источник низкотемпературного тепла (ИНТ) и источник высокотемпературного тепла (ИВТ). Каждый из этих источников может отдавать тепло системе или воспринимать (отбирать) тепло от системы, т.е. быть теплоприемником. Выполнять роль ИНТ и ИВТ может окружающая среда (ОС). Она может быть источником тепла и теплоприемником.
Термодинамическая система – это совокупность тел находящихся во взаимодействии между собой и окружающей средой. Она, или ее часть, отделена от окружающей среды контрольной поверхностью с заданной проницаемостью.
ХМ является термодинамической системой, находящейся во взаимодействии с окружающей средой, характерные формы взаимодействия: тепловая и механическая.
Термодинамические процессы и циклы ХМ осуществляются с помощью рабочего вещества – холодильного агента (ХА).
Состояние термодинамической системы характеризуется параметрами состояния рабочего вещества.
Параметры состояния – это физические величины:
« » – термические параметры состояния.
» – термические параметры состояния.
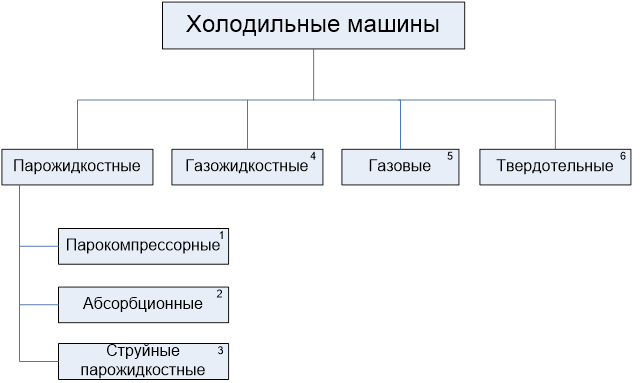
«энтальпия 𝒥, Дж; внутренняя энергия U, Дж; энтропия S  » – калорические параметры состояния.
» – калорические параметры состояния.
Наиболее широко используются: 𝒾,  ; u,
; u,  ; s,
; s,  .
.
Термодинамический процесс – это процесс, при котором изменяется хотя бы один из параметров состояния.
Термодинамический цикл – это совокупность последовательных термодинамических процессов, в результате которых система возвращается в первоначальное состояние по всем параметрам.
Основные уравнения для расчета и анализа термодинамических процессов и циклов вытекают из первого и второго начала термодинамики.
Первое начало термодинамики
 Количество теплоты, подведенное к системе через контрольную поверхность равно изменению внутренней энергии и работе совершаемой системой против внешних сил.
Количество теплоты, подведенное к системе через контрольную поверхность равно изменению внутренней энергии и работе совершаемой системой против внешних сил.
(1), PdV =  Lабс
Lабс
d𝒥 = dU + d(PV) (2)
 d(PV) = PdV + VdP
d(PV) = PdV + VdP
; VdP =  Lтехнич.
Lтехнич.
 Lтехнич. – это работа затраченная на сжатие и перемещение рабочего вещества.
Lтехнич. – это работа затраченная на сжатие и перемещение рабочего вещества.
Q1-2 = (𝒥2 - 𝒥1)- 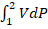
Изоэнтропный Q = 0, 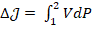
Изобарический p = const, Q1-2 = 𝒥2 - 𝒥1
Второе начало термодинамики
Теплота не может самопроизвольно переходить от системы с меньшей к системе с большей температурой. Для осуществления такого процесса необходимо затратить энергию. Направление подвода или отвода теплоты характеризуется параметром состояния – энтропия.
Полный дифференциал энтропии будет изменение количества теплоты на температуру.
 ;
; 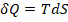
Энтропию называют приведенной теплотой.
Q – теплота участвующая в процессе.
Т – температура при которой процесс происходит.
Энтропия является мерой обратимости процесса
Для конечного процесса, равное интегралу от начального до конечного, количество теплоты на температуру здесь будет равенство или больше.
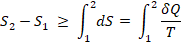
Для обратимого процесса будет знак «=». Для необратимого будет знак «>». Для кругового процесса будет:
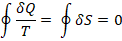
 Отсюда важнейший вывод из второго начала термодинамики.
Отсюда важнейший вывод из второго начала термодинамики.
 Подставляя в уравнения 1 и 2 вместо
Подставляя в уравнения 1 и 2 вместо 
 TdS, то получится
TdS, то получится
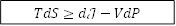 |
Получение низких температур с помощью фазовых превращений рабочих веществ.
Фазовые превращения – это: кипение, испарение, плавление и сублимация.
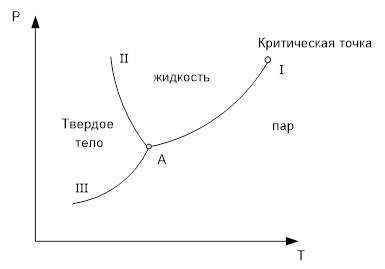
I – линия кипения;
II – линия плавления;
III – линия сублимации.
Кр – критическая тоска, в которой состояние жидкости и пара не различимы.
т.А – тройная точка равновесия трех фаз: жидкой, твердой и газообразной.
На линиях I, II, III в равновесии находятся соответственно: жидкость – пар, твердое тело – жидкость, твердое тело – пар. При повышении температуры рабочее вещество меняет фазовые состояния.
На этих линиях температура и давление связаны между собой однозначно: чем выше давление, тем выше температура, и наоборот. Эти линии называются линиями насыщения.
Для каждого рабочего вещества существует температура кипения при атмосферном давлении, которая называется нормальной температурой кипения: Ts, K; ts, oC – является важной характеристикой данного рабочего вещества.
| ts, oC | tкр, oC | Ркр, МПа | tf, oC | Рf, МПа | |
| Вода Н2О | 100 | 374,5 | 22,56 | 0 | 0,00061 |
| Амиак NН3 | -33,35 | 132,4 | 11,52 | -77,7 | 0,6 |
| Диоксид углерода СО2 | -78,5 | 31,0 | 7,38 | -56,6 | 0,554 |
| Воздух | -192 | -140 | 3,76 | -208 | 0,01 |
Кипение – процесс происходящий с подводом тепла при постоянном давлении и при постоянной температуре (для моновеществ).
Необходимый уровень температуры обеспечивается соответствующим уровнем давления (см. рис. выше). Если температура кипения ниже температуры окружающей среды, то с помощью этого процесса можно проводить охлаждение.
 Эффект охлаждения определяется теплотой парообразования, обозначается латинской буквой «r».
Эффект охлаждения определяется теплотой парообразования, обозначается латинской буквой «r».
х – степень сухости.
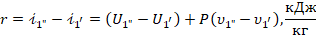
1-е слагаемое:  - внутренняя теплота парообразования, затраченная на придание необходимой энергии молекулам вещества при переходе из жидкости в пар.
- внутренняя теплота парообразования, затраченная на придание необходимой энергии молекулам вещества при переходе из жидкости в пар.
2-е слагаемое:  - внешняя теплота парообразования, расходуемая на преодоление внешнего давления (разность удельных объемов).
- внешняя теплота парообразования, расходуемая на преодоление внешнего давления (разность удельных объемов).
При повышении давления температура кипения возрастает, а теплота парообразования уменьшается и в критической точке (при Ткр) r = 0.
Процесс парообразования при кипении используется в парожидкостных холодильных машинах. В лабораторной практике и в некоторых технологических процессах используется эффект парообразования: жидкого воздуха, азота и других сжиженных газов.
Необходимая температура кипения обеспечивается достаточно низким давлением, при котором происходит процесс.
Испарение – это процесс парообразования, происходящий на свободной поверхности жидкости, при температуре ниже нормальной температуры кипения вещества. Этот процесс связан с неравновесным состоянием паровой фазы над жидкостью и самой жидкостью.
Эффект испарения воды, испаряющейся в условиях низкой относительной влажности воздуха при 0 градусов составляет 2500 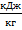
Сублимация. В области ниже тройной точки (см. рисунок) вещество находится либо в твердом либо в газообразном состоянии. Точки кривой III определяются значениями температур и давлений, при которых твердая и газообразная фазы находятся в равновесии. Процесс перехода из твердого состояния в газообразный называется сублимацией.
Процесс сублимации дает большой эффект, т.к. теплота сублимации равна сумме теплот плавления и парообразования (кипения).
На практике широко используется сублимация диоксида углерода СО2 (сухого льда), тройная точка которого выше атмосферного давления (см. таблицу) Рf = 0,528; Ратм = 0,1 МПа.
При атмосферном давлении и температуре -77,7 оС (есть в табличке) теплота сублимации составляет 573 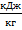 .
.
Процесс сублимации применяется для сублимационной сушки. Если замороженный продукт, содержащий воду, поставить по вакуум ниже давления тройной точки воды (0,00061 МПа), то при подводе тепла вода будет сублимировать – выходить из продукта и продукт будет обезвожен.
Плавление – процесс перехода рабочего вещества из твердого состояния в жидкое, происходящий с поглощением тепла, при этом поглощается теплота плавления. Для водного льда теплота плавления составляет 334,88 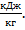
Для получения низких температур с использованием эффекта плавления используются растворы (водные) солей и кислот. При этом температура плавления понижается, но одновременно снижается и теплота плавления по сравнению с водным льдом. Так, например 30% раствор поваренной соли позволяет получить температуру -21,2 оС и теплоту плавления 192,55 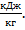 Раствор хлористого кальция в воде позволяет получить -55 оС. Достигаемая температура плавления в водных растворах солей характеризуется диаграммой концентрация – температура (Т-х).
Раствор хлористого кальция в воде позволяет получить -55 оС. Достигаемая температура плавления в водных растворах солей характеризуется диаграммой концентрация – температура (Т-х).
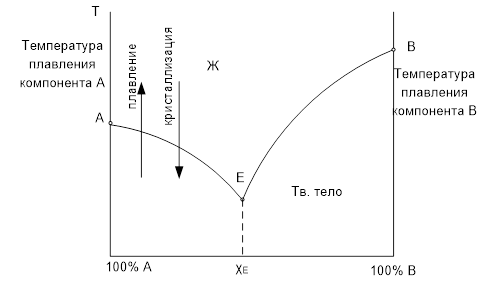
В точке Е раствор насыщен одновременно обоими компонентами. Ниже точки Е расположены две твердые фазы, насыщенные соответственно, с преобладанием компонента А и В. Над кривыми раствор находится в жидком состоянии, под кривыми – в твердом.
Таким образом, линия 1 и 2 – линия плавления или кристаллизации. Концентрация хЕ – называется эвтектической, а температура ТЕ – эвтектической температурой. Для данной пары веществ более низкая температура достигнута быть не может.
| Концентрация соли, % | tЕ, оС |
| |
| NaCl | 22,4 | -21,2 | 236,1 |
| Лекция "11 Эмульсии" также может быть Вам полезна. NH4Cl | 18,6 | -15,7 | 239,8 |
В справочной литературе имеется огромное количество данных о параметрах эвтектических растворов из разных компонентов. На практике этот эффект находит применение в быту (сумка – холодильник, в автомобильном транспорте).
В автомобильном транспорте: изолированный кузов грузовика, стенки которого состоят из панелей, наполненных эвтектическим раствором и в нее встроен трубчатый теплообменник, подключают к ХМ, которая прокачивает через него теплоноситель.