Технический прогресс в области конвертирования
Лекция 17. Технический прогресс в области конвертирования.
Основным направлением развития научно-технического прогресса следует считать применение новых типов конвертеров и технологий, обеспечивающих полную утилизацию отходящих газов. Рассмотрим альтернативные (горизонтальному конвертеру) конструкции агрегатов, в которых решается задача переработки медного штейна, полученного в других медеплавильных печах, на черновую медь.
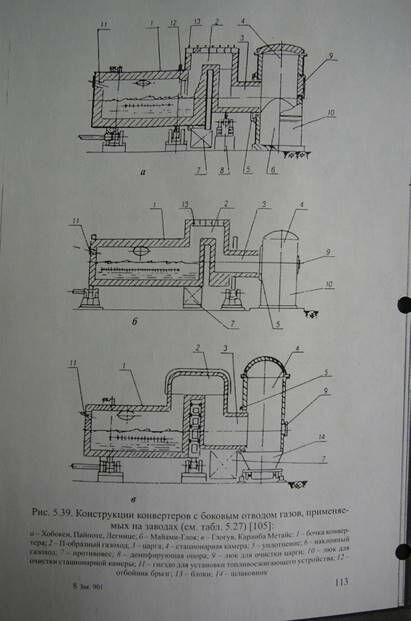
Вопрос 1. Конвертеры с боковым отводом газов (КБО). Агрегаты данного типа характеризуются принципиально иной системой эвакуации газов. Конструкция КБО или сифонных конвертеров разработана фирмой «Металлуржи Хобокен Оверпелт» (Бельгия) и в дальнейшем усовершенствована институтом «Бипромет» (Польша). Первый отечественный конвертер сконструирован СКБЦМ при Гинцветмете для Красноуральского медеплавильного комбината (1975 г.). За прототип был принят 40-тонный горизонтальный конвертер. Опыт работы КУМК’а позволил спроектировать и построить на базе КБО конвертерный передел для Иртышского полиметаллического комбината (1982-1983 г.г.).
Основным достоинством КБО по сравнению с горизонтальными конвертерами является более высокая концентрация сернистого ангидрида в отходящих газах (примерно в два раза), обусловленная меньшим их объемом (при одинаковой дутьевой нагрузке) и меньшими подсосами воздуха. Это позволяет осуществлять практически полную их утилизацию.
В таблице 1. приведены технические характеристики КБО, используемых в различных странах. В настоящее время насчитывается 34 конвертера на 10 заводах мира.
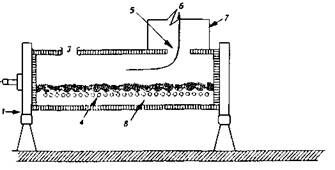
Характерным отличием КБО от горизонтальных агрегатов является уменьшенная горловина, в которой с помощью эксгаустера, работающего в автоматическом режиме, поддерживается нулевое давление. Система автоматики также контролирует режим работы конвертера и состояние газоходного тракта. Принципиальной особенностью конструкции является наличие сифонно-осевого (бокового) отвода технологических газов (рис. 1), что позволяет осуществлять непрерывный их отсос при любых рабочих положениях конвертера.
Конвертер фирмы «Хобокен» (рис. 1 а) имеет три опоры - две основные и одну демпфирующую. Третья опора - вспомогательная основной опоре, примыкающей к П-образному газоходу. Она закреплена на специальных рессорах, которые обеспечивают некоторое биение опирающегося на опору бандажа. У этого конвертера между рабочей частью бочки и П-образным газохо дом установлен отбойник брызг, а свод сифонного газохода выполнен из блоков, изготовленных из хромомагнезитовой массы.
| Характеристики конвертеров с боковым | отводом газов [105] | |||||||||
Рекомендуемые материалыFREE Маран Программная инженерия Техническое задание -34% ЛЮБАЯ практика в Синергии! -20% Помощь с любой практикой в МТИ! Завод | Вместимость е,т | Число конвертеров, шт. | Размеры бочки (внешние) ЛхД м | Внутренний объем Кк.мЗ | Диаметр фурм, мм | Число фурм, шт. | Расход дутья Нд тыс. м^/ч | Удельные расходы дутья | Газовая* | |
| (страна) | V IV мУ(м'-ч) | У= Кд/(О-60), м3/(тмин.) | нагрузка {]= К„/(^-3600), м/с | |||||||
| Хобокен (Бельгия) | 40-45 28-33 | 3 | 6.26x3.04 6.1x3.05 | 19.4 | 42 38 | 17 18 | 10.8-11.4 | 557-588 | 4.0-4.74 5.75 | 0.265-0.28 |
| Пайноте (Чили) | 25 | 2 | 6.1x3.05 | 19.8 | 38(33) | 21 | 12.7-13.0 | 642-657 | 8.47-8.67 | 0.313-О.32 |
| Майами-Глог (США) | 100 (до 150) | 5 | 11.58x4.27 | 87 | 38(51) | 52(44) | 25.5-34 | 293-391 | 4.25-5.67 | - |
| Легнице (Польша) | 33 | 2 | 6.8x3.35 | 25.4 | 38 | 17 | 6-10 | 236-394 | 3.04-5.04 | 0.122-0.204 |
| Легнице-Глогув-1 (Польша) | 40^5** | 2+5 | Н.д. 3.65 | 30.3 | 38 | 24 | 15-21 (13-15) | 495-692 (428^195) | 5.55-8.75 (5.4) | - |
| Глогув-1, Глогув-И (Польша) | 80** | 5+2 | 8.84x4.2 | 62.2 | 42 | 38 | 27 (19.2-30) | 434 (308^182) | 5.62 (4.0-6.25) | 0.308 (0.218-0.342) |
| Караиба Метайс (Бразилия) | 100 (до 120) | 3 | 10.1x4.32 | 70 (73) | 42 (38) | 50 (42) | 18-27 | 257-385 | 3.0-4.5 | 0.174-0.261 |
| ОАО "Святогор" (Россия) | 40 | 1 | 8.1x3.72 | 40 | 41 | 33 | 18-21 | 450-525 | 5.0-8.7 | 0.266-0.31 |
| Иртышский медеплавиль- | 40(60) | 4 | 8.215x3.72 | 40 | 40 | 32 | 15-21 | 375-525 | 4.2-8.7 | 0.266-0.317 |
| ный завод (Казахстан) | (до 25) | (625) | (до 10.4) | (0.37) | ||||||
| Горизонтальные | 40 | 6.1x3.66 | 28(30) | 38-44 | 30-34 | 19.8-21 | 707-750 | 8.25-8.75 | 0.487-0.517 | |
| конвертеры | (6.1x3.72) | (до 23.4) | (780) | (9.7) | ||||||
| (стандартные | 80 | 10x3.95 | 62.5 | 44-53 | 44-52 | 36-51 | 576-815 | 7.5-10.6 | 0.425-0.60 | |
| и усовершенствованные | 100 | 12.06x3.95 | 78.0 | 52 | 56 | 52-55 | 667-705 | 8.67-9.17 | 0.488-0.517 | |
| для сравнения с КБО) | 150 | 11.4-5.2 | 117.5 | 60 | 28 | 72 | 612 | 8 | 0.533 | |
| * Р - площадь горизонтального | )сечен | ля бочки (виз | /тр.). | |||||||
| ** При реконструкции за | вода «Г | тогув-1 | » проведена з | амена конвертеров на более мощные | (80 т). |
Презентация
Презентация
Конструкция КБО завода «Майами-Глог» снабжена двумя опорами, расположенными на концах бочки (рис. 1, б). Сифонно-осевой отвод газа обеспечивается за счет перегородки в ванне конвертера и П–образном газоходе. В перегородке установлены кессоны воздушного охлаждения.
На польских конвертерах 2-я опора размещена под поворотным газоходом (рис. 5.37, в) за счет удлинения площадки П-образного газохода для установки бандажа.
Агрегаты КБО имеют различные дутьевые характеристики и отличаются от горизонтальных конвертеров более низкими их значениями, что обусловлено специфическими особенностями конструкции и эксплуатации ( настылеобразование в П-образном газоходе).
|
|
Вопрос.2. Инжекционный конвертер «Инспирейшн».Модернизированной разновидностью КБО является инжекционный конвертер «Инспирейшн». Агрегаты данной конструкции снабжены двумя горловинами, расположенными по оси верхней образующей бочки конвертера (рис.1). Малая горловина предназначена для загрузки в конвертер перерабатываемых материалов, слива конвертерного шлака и черновой меди. Большая горловина снабжена водоохлаждаемым напыльником и предназначена для отвода технологических газов. Напыльник не имеет открывающихся стенок и обеспечивает необходимую герметизацию газового тракта во время работы конвертера. Особенностью конструкции является также применение теплового экрана с воздушным охлаждением, изготовленного по ширине колпака и монтируемого на корпусе бочки.
Рис. 1. Модифицированная конструкция конвертера в Майами :
1 - опорное кольцо; 2 - подача воздуха в фурмы; 3 - горловина; 4 - фурмы; 5 горловина для газа; 6 - отвод газов; 7 - водоохлаждаемый напыльник; 8 - жидкий штейн
На заводе в Майами (США), использующем данный конвертер, были достигнуты достаточно высокие показатели процесса. В частности, его кампания, оцениваемая по выпуску меди, составила 30-35 тыс. т, концентрация SO2 в отходящих газах 5-10 % об., извлечение серы - 97.6-99.4%. Достигнута производительность 480 т штейна (58% Cu) за цикл при общей продолжительности цикла 13.5 ч. Были получены шлаки с концентрацией меди около 4 % [22].
КБО установлен на единственном в Бразилии медеплавильном заводе «Караиба Метайс» и характеризуется следующими показателями :
Производительность по штейну (60% Cu), т/цикл 144-160
Число циклов в сутки, шт. 3.5-5.5
Обогащение дутья кислородом, %.об. 24-26
Объем отходящих газов, м3/ч 36000-42500
Концентрация SO2 в газах, %,об. 6-12
Кампания, циклы 160-320
В настоящее время КБО на Красноуральском медеплавильном комбинате не используют. При работе на бедные штейны (19-21 % Cu) периодически возникали трудности со стойкостью уплотнения в П-образном газоходе; конвертирование более богатых штейнов (≥30% Cu) протекало без заметных осложнений. Производительность процесса по черновой меди составляла 3 т (за 1 ч. дутья ), концентрация SO2 4.7% (1-ый период) и около 7 % во втором, коэффициент нахождения под дутьем 66.4 % [106].
Типичными недостатками КБО являются:
- необходимость удаления настылей в П-образном газоходе;
- низкая стойкость уплотнения газохода;
- потребность в большой производственной площади:
- более высокий расход огнеупорных материалов ( ~ на 20 %).
В связи с тем, что горизонтальные конвертеры сохранят свое ведущее положение в течении определенного периода времени, представляется целесообразным их переоборудование в КБО, что сопровождается сравнительно низкими капитальными затратами и малым сроком реконструкции.
Вопрос 3. Конвертерная печь Мицубиси. Новым по конструктивному исполнению агрегатом является конвертерная печь процесса Мицубиси, отличающаяся от описанных выше типов оборудования наличием стационарного аптейка, обеспечивающего практически полную герметизацию газового пространства. Особенностью конвертера является применение верхней продувки с помощью вертикальных фурм. Агрегат работает на непрерывном потоке жидкого штейна, черновую медь выпускают из печи через сифон, а богатый шлак переливается через открытое шлаковое окно. С момента начала эксплуатации опытной установки (1968 г.) конструкция печи постоянно модернизировалась.
Современный вариант печи Мицубиси имеет круглую (внутренний диаметр 6650 мм) форму и максимальную высоту 2935 мм. Печь футерована в основном магнезитохромовым кирпичом. Кладка шлакового пояса выполнена из литых магнезитохромовых блоков. Глубина ванны расплава в печи около 750 мм, в том числе 150 мм шлака, остальное - черновая медь. Кампания агрегата составляет около одного года
Часть 5.Современное состояние и перспективы технологии рафинирования черновой меди.
Лекция 18. Термодинамика реакций окислительного огневого рафинирования
Вопрос 1. Термодинамика реакций окисления меди и примесей
 Пирометаллургическое рафинирование основано на частичном окислении расплава меди свободным кислородом газовой фазы и образовании ограничено растворимых в жидкой меди оксидов примесей (ПхОу), которые за счет более низкой плотности формируют на поверхности расплава слой шлака. Реакции окисления меди и ее компонентов протекают в системе, состоящей из жидкой фазы раствора примесей, конденсированных фаз оксидов и газа летучих соединений.
Пирометаллургическое рафинирование основано на частичном окислении расплава меди свободным кислородом газовой фазы и образовании ограничено растворимых в жидкой меди оксидов примесей (ПхОу), которые за счет более низкой плотности формируют на поверхности расплава слой шлака. Реакции окисления меди и ее компонентов протекают в системе, состоящей из жидкой фазы раствора примесей, конденсированных фаз оксидов и газа летучих соединений.
Поскольку основным компонентом чернового металла является медь [Cu], то согласно закону действующих масс при продувке расплава газообразным окислителем она преимущественно вступает во взаимодействие с кислородом дутья {O2}
4[Cu]+{O2}=2Cu2O. (2.1)
По мере образования и растворения Cu2O, в объеме расплава происходит окисление примесей (П) меди
хП +уСu2O=ПхОу+2уCu. (2.2)
Согласно теории А.Н. Вольского взаимодействие 2.2. протекает, когда

упругость диссоциации  становится выше упругости диссоциации оксида-примеси
становится выше упругости диссоциации оксида-примеси  . Возможность диссоциации оксидов Сu2O и ПхОу, протекающих по реакциям с образованием 1 моля кислорода
. Возможность диссоциации оксидов Сu2O и ПхОу, протекающих по реакциям с образованием 1 моля кислорода
2Cu2O=4Cu+О2 (2.3)
2/yПхОу=2х/yП+О2 (2.4)
зависит от прочности закиси меди и оксидов примесей. Термодинамическую прочность любых оксидов металлов можно определить на основе обобщенного уравнения для кислородного потенциала МеО
 , (2.5)
, (2.5)
 - окислительный потенциал МеО;
- окислительный потенциал МеО;  -стандартное изменение энергии Гиббса для реакции образования оксида МеО;
-стандартное изменение энергии Гиббса для реакции образования оксида МеО;  - активность оксидов и металла в случае образования растворов;
- активность оксидов и металла в случае образования растворов;  -дополнительное изменение энергии Гиббса за счет фазовых превращений металла и оксида.
-дополнительное изменение энергии Гиббса за счет фазовых превращений металла и оксида.
Соответствующие уравнения для расчета кислородных потенциалов образования Cu2O и ПхОу имеют вид
πo(Сu2O)= +
+ (2.6)
(2.6)
πo (ПхОу) = +
+  . (2.7)
. (2.7)
Термодинамическую возможность окислительного рафинирования черновой меди можно рассматривать на основе сравнительного анализа кислородных потенциалов закиси меди πo(Сu2O) и оксидов примесей πo(ПхОy ) в системе «Медный расплав-шлак». Диаграмма стандартных потенциалов образования некоторых оксидов при отсутствии взаимных растворов и с учетом фазовых превращений приведена на рис.2.1. Из представленных данных видно, что кислородный потенциал оксидов уменьшается в ряду: πо(Сu2O)>πо(Вi2O3)>πо(РbО)>πо(As2O3)>πо(NiO)>πо(СоО)>πо(SnO2)>πо(FeО)>
>πо(ZnО). При этом наиболее высокую термодинамическую вероятность окисления имеют примеси с максимальной разностью πо (Сu2O) - πо (ПхОy). Поэтому сравнительно легко удаляются железо, цинк, олово и пр. примеси, имеющие высокое сродство к кислороду и соответственно наибольшую разность кислородных потенциалов. Увеличение температуры приводит к росту подвижности кислорода а, следовательно, к уменьшению устойчивости оксидов и повышению значения  .
.
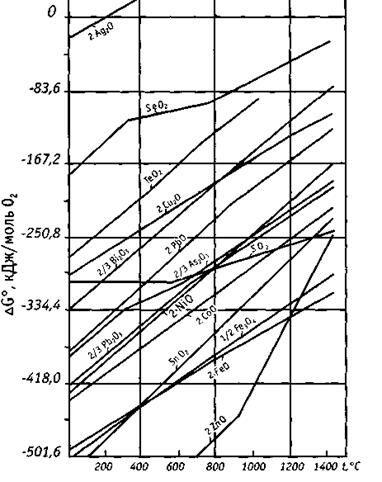
Рис.2.1. Зависимость стандартного изменения энергии Гиббса
реакций образования оксидов от температуры
При рафинировании кислородный потенциал окислителя в условиях
постоянной продувки ванны воздухом и насыщения расплава меди Сu2O поддерживается постоянным. Кислородный потенциал окисляющихся примесей является величиной переменной, поскольку изменяются активности компонентов, как в расплаве меди, так и среди оксидов примесей.
Таким образом, величины кислородных потенциалов ро (Сu2O),
πо (ПхОy) зависят не только от активности кислорода в металле, но и наличия в расплаве других компонентов, поскольку они в свою очередь также оказывают влияние на активность кислорода и примесей. Поэтому для оценки степени их удаления необходимо располагать данными о величинах активности всех компонентов системы Cu-П-О.
Для расчета активностей используют метод параметров взаимодействия ( ), который учитывает взаимное влияние j-ого элемента многокомпонентного расплава на коэффициент активности i-ого. Предполагается, что в первом приближении коэффициент активности (ln γi) линейно зависит от мольных долей растворенных компонентов и параметров взаимодействия
), который учитывает взаимное влияние j-ого элемента многокомпонентного расплава на коэффициент активности i-ого. Предполагается, что в первом приближении коэффициент активности (ln γi) линейно зависит от мольных долей растворенных компонентов и параметров взаимодействия  по уравнению
по уравнению
 . (2.8)
. (2.8)
В технологических расчетах удобнее выражать состав в массовых %, тогда параметры называются массовыми  и коэффициент активности ( f ) в разбавленном многокомпонентном растворе равен
и коэффициент активности ( f ) в разбавленном многокомпонентном растворе равен
 , (2.9)
, (2.9)
Преобразование параметров взаимодействия компонента i с компонентом j при переходе от одной размерности состава (мольная доля) к другой (%, по массе) производят по уравнениям

 . (2.10)
. (2.10)
В таблице 2.1. представлены данные о величинах коэффициентов активностей γi некоторых примесей (хi) черновой меди и параметры их взаимодействия  в системе Cu-xi-O.
в системе Cu-xi-O.
Проанализируем некоторые физико-химические характеристики бинарной системы Cu-O. При сравнительно низких концентрациях кислорода здесь характерно наличие двух конгруэнтно (с разложением) плавящихся оксидов (Сu2O и СuО), а также имеется широкая область расслаивания (рис.1.9) жидких расплавов кислорода в меди и жидкого оксида Сu2O. Растворимость кислорода в чистой меди составляет 1,5 % (по массе) при 1473 К. Максимальная растворимость кислорода при заданной температуре рассчитывается по уравнениям
lg [%O]max= -9260 /Т +6,55, при 1138-1489 К (2.11)
lg [% O]max = -6500 /Т +4.47 при 1356-1506 К (2.12)
Таблица 2.1
Значения γi и  примесей хi в системе Cu-xi-O
примесей хi в системе Cu-xi-O
в интервале температур 1100-1200оС
| хi | γi | Зависимость от температуры |
| О S Ag As Bi Co Fe Ni Pb Sb Sn Zn | 0,175 0,093 3,23 0,06 1,97 1,50 26,0 2,5 5,7 0,25 0,42 0,15 | -7,71) - -0,22) +3,33) -8,1+4∙10-3t -191+11,5∙10-2t -3740,5+2,46t -23,75+12,5∙10-3t -15,87+6,5∙10-3 t -16,48+10,6∙10-3t -9,6+5,6∙10-3t -7,52+3,49∙10-3t |
1),2),3) Средние значения величин 
На окислительной стадии рафинирования содержание кислорода обычно составляет 0,4-0,9%, что обеспечивает перенос Cu2O в объем жидкой меди и соответственно протекание реакции 2.2. Для этой области концентраций наблюдается заметное отклонение от закона Генри (рис.2.2). Коэффициент активности кислорода γО обычно уменьшается с ростом концентрации и уменьшением температуры расплава.
Для расчета коэффициента активности кислорода при бесконечном разбавлении раствора и температуре 1350-1800 К может быть использовано уравнение
ln aO = -8913/Т + 4,52 (2.13)
В черновой меди, содержащей другие металлы активность кислорода отли-
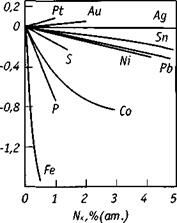
чается от величин aO в чистой меди. На рис. 2.3 показано влияние некоторых
элементов на изменение активности кислорода. Видно, что снижают актив-
ность примеси, имеющие более высокое сродство к кислороду. Их поведение
| lg aO |
|
|
Рис.2.2. Зависимость между концентрацией и активностью кислорода в жидкой меди: 1-опытные данные, 1473 К; 2-закон Генри
Рис.2.3. Влияние примесных элементов на активность
кислорода в меди при 1423 К
объясняется соотношением межатомных сил взаимодействия компонентов системе Сu-[О]Сu-П, когда примеси образуют более прочные связи с кислородом, чем с медью. Концентрация этих элементов вблизи аниона кислорода выше, чем в остальном расплаве, поэтому с ростом содержания примесного элемента, прочность связи кислорода с металлом увеличивается, а активность кислорода снижается.
Вопрос 2. Анализ системы Cu-П-О
Воспользуемся результатами термодинамического анализа системы
Cu-П-О для оценки конечной концентрации примеси в расплаве меди при условии ее насыщения Cu2О ( , aCu =1), находящегося в равновесии с чистым оксидом примеси (
, aCu =1), находящегося в равновесии с чистым оксидом примеси ( ). В этом случае согласно равновесию реакции 2.2 активность двухвалентной примеси (х=у=1) составляет
). В этом случае согласно равновесию реакции 2.2 активность двухвалентной примеси (х=у=1) составляет
 =
= , (2.14)
, (2.14)
и введя эффективное значение активности примеси  для ограниченной ее растворимости в меди
для ограниченной ее растворимости в меди
 , (2.15)
, (2.15)
где:  ,
,  - активность, соответствующая конечной концентрации примеси и насыщенному раствору в меди, получим
- активность, соответствующая конечной концентрации примеси и насыщенному раствору в меди, получим
 . (2.16)
. (2.16)
Для трехвалентной примеси (х=2, у=3) аналогичное уравнение имеет вид

 =
= . (2.17)
. (2.17)
Из выражений 2.16, 2.17 следует, что остаточная концентрация примеси в меди зависит только от константы равновесия и предельной растворимости примеси при данной температуре. В частности конечная концентрация железа, цинка, свинца в анодной меди, рассчитанная по уравнению 2.16 при температуре 1423 К составляет (%, по массе): 9,36∙10-4; 8,3∙10-4; 8,14 соответственно. При расчете по данным Аглицкого приняты величины предельной растворимости в меди Fe 0,089, Pb 0,15 моль и допускается полная растворимость цинка. Аналогично рассчитаны пределы рафинирования некоторых трехвалентных примесей, в частности для мышьяка и сурьмы остаточные концентрации данных компонентов составляют: 0,33; 0,13. Величины ΔGo , Кр, lg Кр для реакции 2.2 окисления различных металлов и элементов получены с использованием современного термодинамического пакета программы HSC-4 и представлены в табл.2.2.
Таблица 2.2.
| № | Реакция | ΔGo, кДж/моль | Кр | lg Kp |
| 1 | 2As+3Cu2O=As2O3+6Cu | -136,21/-138,85/-141,50 | (1,52 /1,25/1,04)∙105 | 5,18/5,10/5,02 |
| 2 | 2Sb+3Cu2O=Sb2O3+6Cu | -154,64/-157,04/-159,46 | (7,63 /5,81 /4,51)∙105 | 5,88/5,76/5,65 |
| 3 | 2Bi+3Cu2O=Bi2O3+6Cu | -0,34/-2,70/-5,14 | 1,03/1,26/1,52 | 0,013/0,100/0,182 |
| 4 | Co+Cu2O=CoO+2Cu | -68,95/-69,89/-70,81 | (4,20 /3,68 /3,24)∙102 | 2,62/2,56/2,51 |
| 5 | Fe+Cu2O=FeO+2Cu | -105,70/-106,87/-108,05 | 1,05 104/(8,37 /6,78) ∙103 | 4,02/3,92/3,83 |
| 6 | Ni+Cu2O=NiO+2Cu | -48,85/-49,09/-49,33 | 7,22/6,34/5,61 | 1,86/1,80/1,75 |
| 7 | Pb+Cu2O= PbO+2Cu | -19,37/-20,26/-21,17 | 5,45/5,54/5,63 | 0,737/0,744/0,751 |
| 8 | Sn+ Cu2O=SnO+2Cu | -77,11/-77,80/-78,52 | (5,80 /7,18 /6,09) ∙102 | 2,93/2,85/2,78 |
| 9 | Zn+Cu2O=ZnO+2Cu | -139,51/-138,67/-137,81 | (2,03 /1,23 /7,71) ∙105 | 5,31/5,09/4,89 |
Изменение свободной энергии Гиббса ΔGo , константы равновесия Кр , lg Кр окисления
примесей расплава черновой меди по реакции 2.2 при температуре, К: 1373/1423/1473
Результаты выполненных расчетов свидетельствуют о достаточной сходимости с данными практики для железа, цинка. В случаях рафинирования от As, Sb, Pb получены завышенные величины остаточной концентрации. Причиной заметного отклонения от реального состава анодной меди являются следующие обстоятельства. Во первых, при огневом рафинировании окисление меди осуществляют до концентраций кислорода существенно меньших пределов его насыщения, поэтому  . Во вторых, расплав меди покрыт шлаком, в котором активная концентрация примесей намного ниже активности чистого компонента. Кроме того, растворы примесей в металле не являются идеальными.
. Во вторых, расплав меди покрыт шлаком, в котором активная концентрация примесей намного ниже активности чистого компонента. Кроме того, растворы примесей в металле не являются идеальными.
Рассчитаем остаточную концентрацию примесей с учетом их окисления, растворенным в объеме расплава меди кислородом по брутто-реакции
П+у/х[О]= 1/х ПхОу. (2.18)
Запишем
 , (2.19)
, (2.19)
где:  -активности примеси и кислорода, равные соответственно
-активности примеси и кислорода, равные соответственно  и
и  ;
; 
 - мольные доли кислорода и примесей в меди;
- мольные доли кислорода и примесей в меди;  -коэффициент активности примеси и кислорода.
-коэффициент активности примеси и кислорода.
Тогда, конечная концентрация, выраженная в мольных долях, составит
 . (2.20)
. (2.20)
Предположим, что суммарное содержание кислорода и мышьяка в расплаве меди составляет 1 % , тогда коэффициент активности компонентов в таком разбавленном растворе равны единице и остаточное содержание П может быть рассчитано по уравнению
 , (2.21)
, (2.21)
где:  -мольная доля оксида примеси определенная из условия образования идеального шлака состава, % (по массе): 29 SiO2; 70 Cu2O; 1ПхОу.
-мольная доля оксида примеси определенная из условия образования идеального шлака состава, % (по массе): 29 SiO2; 70 Cu2O; 1ПхОу.
| № | Реакция | ΔGo, кДж/моль | Кр | lg Kp |
| 1 | As+1,5[O]=0.5As2O3 | -170,93/-165,55/-160,20 | (11,70/7,54/4,87)∙105 | 6,07/5,88/5,69 |
| 2 | Sb+1,5[O]=0.5Sb2O3 | -180,14/-174,64/-169,17 | (24,86/15,85 /10,14)∙105 | 6,40/6,20/6,01 |
| 3 | Bi+1,5[O]=0.5Bi2O3 | -102,99/-97,47/-92,02 | (4,53/2,88/1,85)∙103 | 3,66/3,46/3,27 |
| 4 | Co+[O]=CoO | -130,44/-133,97/-137,50 | (4,22 /8,27 /17,02)∙104 | 4,63/4,92/5,23 |
| 5 | Fe+[O]=FeO | -174,24/-170,95/-167,68 | (4,25/1,88)∙106 /8,83∙105 | 6,63/6,27/5,95 |
| 6 | Ni+[O]=NiO | -117,40/-113,18/-108,96 | (2,93/1,43)∙104/7,31∙103 | 4,47/4,15/3,86 |
| 7 | Pb+[O]= PbO | -87,91/-84,34/-80,81 | (2,21/1,25)∙103/7,33∙102 | 3,34/3,09/2,86 |
| 8 | Sn+ [O]=SnO | -145,65/-141,89/-138,16 | (3,48/1,62)∙105 /7,93∙104 | 5,54/5,21/4,90 |
В таблице 2.3 показаны значения величин изменения свободной энергии Гиббса, константы равновесия и ее логарифма для реакций окисления примесей кислородом по реакции 2.18 при различных температурах.
Таблица 2.3.
Изменение свободной энергии Гиббса ΔGo , константы равновесия Кр , lg Кр окисления
примесей расплава черновой меди по реакции 2.19 при температуре, К: 1373/1423/1473
После подстановки численных значений для As величин N[O]=0.0158 мол. (0,4 %, по массе) и  =0,0055 мол. (1 %,по массе), Кр=7,54∙105, 1423 К (табл.2.3) и соответственно для свинца
=0,0055 мол. (1 %,по массе), Кр=7,54∙105, 1423 К (табл.2.3) и соответственно для свинца  =0,0048 мол. и Кр=1,25∙103, получим:
=0,0048 мол. и Кр=1,25∙103, получим:
 =
= =
= мол, или 5,76 ∙10-3 %, по массе;
мол, или 5,76 ∙10-3 %, по массе;

 =
= =
= мол, или 0,079 %, по массе.
мол, или 0,079 %, по массе.
В случае образования реальных растворов, например, содержащих 0,7 % [O] и 0,5 % Pb проведем аналогичные расчеты с использованием мольных параметров взаимодействия. Величины  определяем по уравнениям
определяем по уравнениям
 (2.22)
(2.22)
 , (2.23)
, (2.23)
где: 
 -коэффициенты активности примеси и кислорода в бесконечно разбавленном растворе жидкой меди;
-коэффициенты активности примеси и кислорода в бесконечно разбавленном растворе жидкой меди;  ,
, параметры взаимодействия одноименных и разноименных частиц.
параметры взаимодействия одноименных и разноименных частиц.
Определим конечную концентрацию, например, мышьяка и свинца в меди при 1423 К, характерной для окислительной стадии рафинирования. Максимальная растворимость кислорода, рассчитанная по уравнению 2,12 составляет 0,8 %. Допускаем, что за счет непрерывного ввода дутья поддерживается постоянная концентрация кислорода в объеме меди 0,7 % (по массе) и расплав находится в равновесии с идеальным шлаком ( =
= ) состава, % (по массе): 80 Cu2O; 19 SiO2; ≤1 ПхОу. Принимаем максимальные исходные содержания (%, по массе) As (0,4), Pb (0,5). При этих концентрациях примеси незначительно влияют на физико-химические свойства расплава, растворимы в жидкой меди и не образуют химических соединений и эвтектик. Вместе с тем, они в состоянии изменять величину активности растворенного кислорода, что учитывается соответствующими параметрами взаимодействия. Параметром взаимодействия одноименных примесей
) состава, % (по массе): 80 Cu2O; 19 SiO2; ≤1 ПхОу. Принимаем максимальные исходные содержания (%, по массе) As (0,4), Pb (0,5). При этих концентрациях примеси незначительно влияют на физико-химические свойства расплава, растворимы в жидкой меди и не образуют химических соединений и эвтектик. Вместе с тем, они в состоянии изменять величину активности растворенного кислорода, что учитывается соответствующими параметрами взаимодействия. Параметром взаимодействия одноименных примесей  пренебрегаем.
пренебрегаем.
Выполняем расчеты в следующей последовательности. Первоначально из данных табл. 2.1. и 2.3 выбираем следующие термодинамические характеристики (1423 К):
 =-7,7;
=-7,7;  ;
;  ;
;  (по уравнению 2.13); Кр=7,54∙105;
(по уравнению 2.13); Кр=7,54∙105; 
 =-7,7;
=-7,7;  ;
;  ;
;  (по уравнению 2.13); Кр=733;
(по уравнению 2.13); Кр=733;
Выразим состав расплава меди и шлака в мольных долях.
Медный расплав
Cu As [O] Cu Pb [O]
% ( по массе)…… 98,9 0,4 0,7 98,8 0,5 0,7
А ( %/ Мв)………..1,5453 0,0053 0,0438 1,5438 0,0024 0,0438
Мв………………..64 75 16 64 207 16
Ni …………………………..0,9692 0,0033 0,0274 0,9710 0,0015 0,0275
Идеальный шлаковый раствор
Cu2O SiO2 As2O3 Cu2O SiO2 PbO
% ( по массе)…... 70,9350 29,0 0,0650 70,0 29,0 1,0
А ( %/ Мв)………..0,4433 0,4833 0,0003 0,4375 0,4833 0,0045
Мв………………..140 60 198 140 60 223
Ni …………………………..0,4783 0,5214 0,0004 0,4728 0,5224 0,0048
Рассчитаем коэффициенты активности компонентов.
Кислород: Мышьяк:

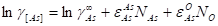



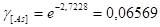
Кислород: Свинец:

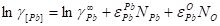



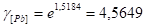
Подставляя полученные величины в уравнение 2.20, получим:
 =
= =0,001542,
=0,001542,
 =
= =0,000374.
=0,000374.
После пересчета размерности концентраций, выраженных в мольных долях на % (по массе), окончательно имеем [As]кон= 0,18 % и [Pb]кон=0,12 %, что по порядку величин в большей степени соответствует практическим данным. Предлагаем читателям самостоятельно выполнить аналогичные расчеты применительно к остальным компонентам черновой меди.
Таким образом, остаточная концентрация примеси в меди снижается с увеличением ее сродства к кислороду, т.е. ростом Кр реакции 2.18, уменьшением активности ее оксида в шлаке ( ), повышением активности кислорода (
), повышением активности кислорода ( ) и коэффициента активности примесей (
) и коэффициента активности примесей ( ) в меди. В общем случае предельное содержание удаляемых металлов и элементов определяется технологическими условиями огневого рафинирования, среди которых наибольшее значение приобретают температура, степень окисленности расплава и состав шлака.
) в меди. В общем случае предельное содержание удаляемых металлов и элементов определяется технологическими условиями огневого рафинирования, среди которых наибольшее значение приобретают температура, степень окисленности расплава и состав шлака.
Вопрос 3. Система Cu2O-SiO2 . Основой медерафинировочного шлака является система Cu2O-SiO2, в которой обнаружены следующие соединения c температурой плавления, К: Cu2O∙SiO2 (1393); 2Cu2O∙SiO2 (1343); 3Cu2O∙SiO2 (1363); 5Cu2O∙SiO2 (1383). При содержании 8 % SiO2 (по массе) в системе Cu2O-SiO2 имеется эвтектика (рис. 2.1.) с температурой плавления 1333 К. Наличие оксидов железа, свинца, СаО+MgO (<6 %) расширяет область гомогенности, и такой шлак сравнительно легко плавится до концентрации SiO2 40 %. По мере растворения в расплаве других компонентов (NiO, SnO, ZnO), происходит разрыв смесимости и появляется твердая фаза (гетерогенизация расплава). В этом случае образуется «свернутый» шлак, представляющий собой полурасплавленную массу смеси оксидов, которую удаляют из печи в виде съемов.
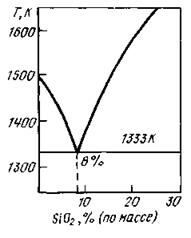
Рис. 2.1. Диаграмма состояния Cu2O-SiO2
В соответствии с современными положениями теории о строении шлаковых расплавов, его составляющие находятся в состоянии электролитической диссоциации, продуктами которой могут являться катионы металлов (Pb2+, Ni2+, Сu+,Са2+), анионы неметаллов (О2-) и комплексные анионы ( ). Для гомогенной системы Cu2O-SiO2 ( <30 % SiO2) уравнения для констант равновесия реакций взаимодействия компонентов металла ([Me],[O]) и шлака (О2-)
). Для гомогенной системы Cu2O-SiO2 ( <30 % SiO2) уравнения для констант равновесия реакций взаимодействия компонентов металла ([Me],[O]) и шлака (О2-)
[Me]+[O]=(Me2+)+(O2-) (2.24)
[Me]+3/2[O]+3/2(О2-)=(MeО3)3- (2.25)
можно записать следующим образом:
- для элементов, оксиды которых диссоциируют на катион Меn+и анион О2- (1-ая группа примесей)
 (2.26)
(2.26)
-для элементов, образующих комплексные анионы (2-ая группа примесей)
 . (2.27)
. (2.27)
Обозначим за L Me коэффициент распределения примесей между шлаком и металлом, равный отношению их активностей (концентраций) в шлаке и металле, т.е.
 . (2.26)
. (2.26)
Тогда, коэффициент распределения может быть рассчитан по уравнениям:
 (2.27)
(2.27)
 . (2.28)
. (2.28)
Из выражений 2.27, 2.28 следует, что переводу примесей в шлак способствуют более высокое сродство примеси к кислороду, повышение окисленности меди и снижение в металле активности (концентрации) свободных ионов кислорода для элементов 1-ой группы. Последнее достигается добавкой в шлак оксидов, имеющих высокие комплексообразующие свойства (SiO2, P2O5, B2O3, Fe2O3) за счет ковалентной связи кислорода с катионами металлов. Для примесей 2-ой группы (As, Sb, Bi) более эффективно использование флюсов на основе оксидов щелочных и щелочноземельных с ионным характером связи между кислородом и катионами (Li2O, K2O, Na2O, MgO, CaO, Ba2O). По этой причине степень удаления примесей в процессе огневого рафинирования зависит от характера футеровки печи, составляющие которой, принимают участие в процессах шлакообразования. В этой связи известно, что с использованием кислых огнеупоров (динас) происходит более полный перевод в шлак свинца, никеля и кобальта, а основных (магнезит) мышьяка и сурьмы. При отсутствии шлакового расплава активность оксида примеси близка к единице (чистый оксид) и согласно уравнения 2.20, степень рафинирования становится невысокой.
В практике рафинирования удаление меди от железа, цинка, олова и фосфора осуществляют без наведения специальных шлаков, т.к. оксиды данных примесей образуются непосредственно в расплаве меди. По этой причине возможно также достаточно полное рафинирование меди от никеля, кобальта и свинца.
Наибольшие трудности при огневом рафинировании возникают при удалении висмута, мышьяка, сурьмы, где коэффициент распределения составляет относительно низкую величину в частности, для висмута 1.4, мышьяка 4.1, сурьмы 7.5 и не зависит от концентрации примеси в расплаве меди (рис.2.2). Аналогично поведение теллура селена, где величины LMe приобретают значения 3.9, 5.5, соответственно. Данное обстоятельство свидетельствует о протекании реакций рафинирования преимущественно с участием шлака по реакции 2.25 и объясняется тем, что Bi, As, Sb, Te, Se в разных фазах имеют одинаковое структурное состояние: молекулярное или ионное.
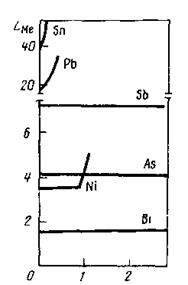
[Me], % (по массе)
Рис.2.2. Зависимость коэффициента распределения LMe
Sn, Pb, Sb, As, Ni, Bi между металлом и шлаком при 1523 К
от концентрации в меди
Увеличение значений LМе можно достигнуть, нарушив ближний порядок в расположении атомов воздействием на их структуру сильным энергетическим полем катионов-модификаторов щелочных и щелочноземельных металлов. При этом, большая часть жестких ковалентных связей Ме-О в шлаке заменяется ионными Меп+-О, что снижает активность оксидов-примесей в шлаковой фазе. Этот принцип в определенной степени реализован при удалении мышьяка и сурьмы, когда ошлакование Аs2O5 и Sb2O5 осуществляется в форме нерастворимых в меди арсенатов и антимонатов. Активность Sb2O5 в шлаке системы Na2O-Sb2O5 при мольной доле  =0.7 и температуре 1523 К, снижается до 1.42∙10-6, а стандартная свободная энергия образования Na3AsO4 и Na3SbO4 по реакциям
=0.7 и температуре 1523 К, снижается до 1.42∙10-6, а стандартная свободная энергия образования Na3AsO4 и Na3SbO4 по реакциям
3(Na2O) + (As2O5) = 2(Na3AsO4) (2.29)
3(Na2O) + (Sb2O5) = 2(Na3SbO4) (2.30)
составляет 504,8 кДж/моль As2O5 и 466, 8 кДж/моль Sb2O5.
Поэтому для более глубокого удаления мышьяка, сурьмы, висмута необходимо дополнительно вводить щелочные флюсы, что снижает активность оксидов примесей. Такой технологический прием относится к методу реагентного рафинирования и основан на переводе (ПхОу) в устойчивые соединения шлаковой фазы (ПхО ∙RО) за счет их взаимодействия с реагентами (RО) по реакции:
(RО) + (ПхОу) = (ПхОу ∙RО) (2.31)
В этом случае активность ПхОу зависит от изменения свободной энергии Гиббса образования и активности ПхОу∙RО, активности RO согласно уравнения
 , (2.32)
, (2.32)
и чем прочнее (ПхОу∙RО), выше активность реагента  , тем меньше величина
, тем меньше величина  .
.
Активность ПхОу в шлаковой фазе можно уменьшить, связывая основные оксиды примесей (РbО, NiO, СоО, РЬО, ZnО), добавками SiO2 и Fe2O3 в силикаты или ферриты. При образовании кислых оксидов (SnО2, Аs2O3, Sb2O3, Вi2O3, Р2O5) эффективность рафинирования повышается добавкой оксидов щелочных и щелочноземельных металлов. Применение в качестве рафинирующих флюсов Na2СО3, СаО обеспечивает перевод Аs2O5 в устойчивые формы Са3(АsO4), Na3(АsO4) и снижает концентрацию мышьяка в анодной меди <0.08%.
Вопрос 4. Распределение примесей. Коэффициенты распределения селена и теллура в рассматриваемом интервале концентраций рис. 2.2. (кривые не приводятся) также постоянны. Селен и теллур при обычном окислении меди на стадии огневого рафинирования не выводятся и только при электролизе они переходят в шлам. Изменение структуры шлакового расплава может быть достигнуто добавкой Nа2СO3, что приводит к образованию теллуридов (селенидов) натрия
[Те(Sе)] + (Na2O) = Nа2Те (Na2Sе) +1/2 O2 (2.33)
При создании восстановительных условий, применения шлаков, содержащих карбонат натрия, можно повысить коэффициент распределения селена и теллура до 1000.
Коэффициент распределения свинца и олова зависит от исходной концентрации (активности) этих металлов в медном расплаве. В большей мере эта закономерность проявляется для системы Сu-Sn-О, когда величина LSn в узком интервале начальных концентраций Sn возрастает практически в несколько раз (рис.2.2). Такой эффект объясняется образованием твердой суспензии SnO2 и достижением условий тройного равновесия фаз жидкой меди, расплава оксидов и твердой SnO2.
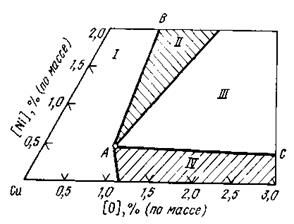
Рис.2.3. Разрез при 1423 К медного угла диаграммы Cu-Ni-O
Коэффициент распределения никеля остается постоянным (LNi~3.1) до содержания его в металле ~0.9% (по массе). Данному значению соответствует предельная растворимость NiO в Си2O (1523 К), при достижении которой выделяется твердая закись никеля в форме самостоятельной фазы. Равновесная концентрация никеля в меди, соответствующая трехфазной области (NiOт+ Сu2От+ Сuж) согласно диаграмме состояния Cu-Ni-O (рис.2.3.) составляет 0.5% (1423 К). При уменьшении температуры до 1373 К растворимость никеля в меди снижается до предельного значения 0.4%, (по массе), когда сохраняется возможность выделения закиси никеля из медного расплава. ээээээРассмотрим потенциальные возможности термодинамики для удаления никеля на основе анализа медного угла диаграммы Сu-Ni-O при 1423 К (рис.2.3). В поле диаграммы отмечены четыре области составов, различающихся поведением оксидов никеля и меди. В области Ι, характерной для низкой окисленности расплава независимо от концентрации никеля фазы Cu2O и NiO отсутствуют. Удаление никеля здесь происходит в результате протекания реакции 2.24 на границе раздела меди и шлака. Коэффициент распределения никеля между металлом и шлаком в этой области постоянный и равен 3-5. На этом участке целесообразно введение в шлак флюсующих добавок, что несколько увеличивает коэффициент распределения никеля. Известно, что использование с этой целью оксида железа III повышает LNi до 6-8 за счет протекания реакции
Ni+ [O]+ Fе2О3 = (NiО∙Fе2O3) (2.34)
образуется нерастворимый в расплаве меди феррит никеля и снижается активность NiO в шлаке. Диоксид кремния увеличивает LNi только при температурах выше 1473 К, т.к. при более низких SiO2 выделяется из шлака в виде самостоятельной фазы, что увеличивает вязкость шлака и затрудняет протекание реакции между компонентами шлака и металла. Наиболее эффективной для рафинирования меди от никеля является область диаграммы ΙΙ. В этом случае образуется шлак с повышенным содержанием NiO, поскольку при достижении некоторого предела насыщения расплава меди кислородом в объеме металла появляется фаза NiOт , который всплывает на поверхность ванны и ассимилируется шлаком. Вместе с тем концентрации кислорода в меди выше 0.9% является нецелесообразной, т. к. сопровождается дополнительным переводом меди в шлак без изменения состава металлической фазы.
В области ΙΙΙ диаграммы, соответствующей большее высокой концентрации кислорода из расплава меди наряду с оксидом никеля, выделяется CuO, что увеличивает выход шлака и снижает коэффициент распределения никеля. При низких концентрациях никеля в меди (область IV) его удаление возможно в результате взаимодействия на границе раздела металл-шлак с коэффициентом распределения LNi < 5.
Нижнему пределу содержания никеля, при котором из расплава меди выделяется NiOт, соответствует излом на кривой распределения (рис.2.2). С повышением температуры линия АВ (минимальной эффективной окисленности расплава) смещается вправо, а граница наиболее низкой концентрации никеля АС вверх. Таким образом, снижение температуры является эффективным технологическим приемом для удаления никеля из расплава при минимальной окисленности меди. В зависимости от температуры минимальная концентрация никеля, при которой из расплава меди выделяется NiO, составляет, % (по массе): 0,4-0,5(1423 К); 0,6-0,7 (1473 К); 0,9-1,0 (1523 К).
Практически концентрация никеля в анодной меди составляет 0.35-0.45, а в отдельных случаях повышается до 0.8-0.9%, что объясняется также, сравнительно небольшим различием меди и никеля в сродстве к кислороду. Кроме того в присутствии мышьяка и сурьмы, возможно образование растворимых в меди арсенатов, антимонатов меди и никеля в частности, прочного халькофиллита (слюдки) ЗСи2О∙4NiO∙Sb2O5 (Тпл=1653 К). Снижение активности закиси никеля в шлаке за счет введения специальных флюсов предотвращает образование антимоната и повышает коэффициент распределения никеля.
В общем случае, образование оксидов примесей в расплаве меди, или гетерогенизация шлака приводят к возрастанию коэффициента распределения практически всех удаляемых металлов и элементов.
Вопрос 5. Термодинамика дегазации и раскисления
Раскисление меди («дразнение на ковкость») осуществляют с целью удаления, находящегося в расплаве меди после окислительной стадии рафинирования кислорода. Концентрация кислорода в расплаве меди перед ее восстановлением обычно в среднем составляет 0,4 % (по массе). Удаление кислорода осуществляют до его остаточной концентрации 0,10-0,15 %, что ниже эвтектического состава сплава системы Cu-O,содержащего 0,39 % [O]. Наличие эвтектики нежелательно, т.к. ее распад сопровождается образованием дисперсной меди, которая при электролизе переходит в шлам, а также ухудшает качество катодного осадка..
Наиболее распространенными раскислителями являются древесина, мазут, дизельное топливо, природный газ, пропан, бутан, а также продукты неполного сжигания топлива. Применяют сырой (нереформированный) газ или осуществляют его высокотемпературную конверсию, тогда восстановителями кислорода являются углеводороды (СН4, СnНm) или продукты пиролиза (СО, Н2, С).
Термодинамические условия для восстановления оксида меди (1) газообразными восстановителями
Cu2O+H2(CO)=2Cu+H2O(CO2), (2.35) определяются соотношением кислородных потенциалов газовой фазы и Сu2O при условии
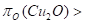
 . (2.36)
. (2.36)
Поскольку система "Cu-O-г.ф." стремится к выравниванию потенциалов, кислород переходит из оксидной фазы в газовую. При участии в процессе восстановления закиси меди водорода образуется смесь Н2-Н2О, а монооксида углерода СО-СО2. Величина кислородного потенциала  этих смесей (кДж/моль О2) рассчитывается по уравнениям, включающих зависимость
этих смесей (кДж/моль О2) рассчитывается по уравнениям, включающих зависимость  ,
,  образования 2Н2О и СО2 от температуры:
образования 2Н2О и СО2 от температуры:
 +2RTln(% H2/% H2O)=-492230+Т∙[108,24-38,24 ∙lg(% H2/% H2O)] (2.37)
+2RTln(% H2/% H2O)=-492230+Т∙[108,24-38,24 ∙lg(% H2/% H2O)] (2.37)
 +RT ln (% CO/% CO2)=-393260-T [2.29-19,12lg (% CO/% CO2)] (2.38)
+RT ln (% CO/% CO2)=-393260-T [2.29-19,12lg (% CO/% CO2)] (2.38)
Зависимость πо(Сu2О) от температуры описывается уравнением
πо(Сu2О)=-293210+100.82Т (2.39)
При температуре 1423 К равенство кислородных потенциалов
 =
= (2.40)
(2.40)
 =
= (2.41)
(2.41)
наступает при отношениях (% Н2 / % Н2О) =3,5∙10-4 и (% СО/ % СО2)=8,9∙10-4.
Решая уравнения: % Н2/(100 - % Н2) = 3,5∙10-4; % СО/(100 - % СО)= 8,9∙10-4 относительно % Н2 и % СО, получим величину минимальной концентрации водорода для восстановления закиси меди 0,035 %, а монооксида углерода 0,089 % , об. Таким образом, в рассматриваемой системе имеются благоприятные термодинамические предпосылки для раскисления меди водородом и монооксидом углерода.
В качестве восстановителей также применяются природный газ и аммиак (NH3). В этом случае протекают реакции
СН4+4[O]=CO2+2H2O (2.42)
NH3+3/2[O]=1/2N2+3/2H2O (2.43)
Для удаления кислорода могут использоваться любые элементы, имеющие высокое сродство к кислороду. Твердые раскислители (фосфор, бор, литий, углерод) нашли применение в практике плавки литейных и деформируемых медных сплавов. В процессе огневого рафинирования на различных предприятиях использовались алюминий, кремний, бериллий, цинк, олово, лигатуры Cu-Si, Fe-Si-Al, Fe-Si-Ca, СаС2, СаВ6.
Процесс восстановления с участием таких раскислителей (R) в общем виде записывается следующим образом
Сu2О + R = RО + 2Cu (2.41)
Термодинамическим условием протекания реакции 2.41 является
 <
<  , (2.42)
, (2.42)
т.е. кислородный потенциал оксида раскислителя должен быть меньше, чем у закиси меди. Практически любые металлы, имеющие более высокое сродство к кислороду, чем у меди, могут являться потенциальными раскислителями. Вместе с тем, к ним предъявляются особые требования. Реагент не должен снижать эксплуатационные характеристики меди (электропроводность, пластические свойства), а продукт раскисления (RО) - растворяться в металле. Кроме того, RO должен хорошо удаляться из меди.
В процессе огневого рафинирования на стадиях плавления и окисления черновой меди расплав абсорбирует газы из атмосферы печи и газообразные продукты реакций взаимодействий кислорода с примесями. Источниками газов могут быть также шихтовые материалы и футеровка. Растворенные в меди газы выделяются при последующем охлаждении расплава и его затвердевании, что приводит к образованию пор, внутренних дефектов, снижающих качество анодов и показатели электролиза. Дегазацию меди или «дразнение на плотность» протекает одновременно с ее восстановлением древесиной. Обычно после обработки расплава мазутом или смесью мазута с водяным паром в ванну печи вводят одну или несколько «дразнилок» для окончательного удаления растворенных газов.
Поскольку остаточный кислород находится в форме закиси меди и не может являться источником пор, то на стадии дегазации преимущественно удаляют водород и SO2.
Процесс растворения водорода в меди протекает по реакции
Н2(г) = 2 [Н]Сu (2.43)
и соответствует закону Сивертса:
S=(-13.94+0.01841∙t) , (2.44)
, (2.44)
где: S — растворимость, см3/100 г; Р — давление, МПа; t— температура, °С.
Расплав меди в процессе рафинирования контактирует с атмосферой печи, компонентами которой являются водород и водяной пар. Парциальное давление паров воды в зависимости от условий сжигания топлива может изменяться в широких пределах. Обычно медерафинировочные печи отапливаются природным газом с применением воздуха, коэффициент расхода которого α, варьируют от 0.6 (стадия восстановления) до 1.3 (окисление). Расчетные значения без учета подсосов воздуха парциальных давлений водяного пара (МПа) в атмосфере печи составляют: =0.012 (α= 0.6),
=0.012 (α= 0.6),  =0.018 (α= =1.05),
=0.018 (α= =1.05),  = 0.0165 МПа (α = 1.15),
= 0.0165 МПа (α = 1.15),  =0.0143 (α = 1.3). При использовании воздуха, обогащенного кислородом 35%, величина
=0.0143 (α = 1.3). При использовании воздуха, обогащенного кислородом 35%, величина  = 0.026 МПа (α= =1.15), а на технологическом кислороде возрастает до
= 0.026 МПа (α= =1.15), а на технологическом кислороде возрастает до  =0.040 МПа.
=0.040 МПа.
Пары воды при контакте с расплавом металла разлагаются с образованием водорода и кислорода, ассимилируемых жидкой медью
Н2О(г) =2 [Н] + [О] (2.45)
Брутто-реакция 2.45 состоит в свою очередь из частных реакций
Н2О(г)=H2 (г)+1/2О2 (г) (2.46)
1/2Н2 = [Н] (2.47)
1/2 О2=[О] (2.48)
Учитывая взаимодействие меди с кислородом газовой фазы в поверхностном слое, общее равновесие в системе определяется реакцией
Н2(г) + [О]Сu = Н2O(г) (2.49)
Константа равновесия реакции 2.49
 (2.50)
(2.50)
Допустим, что в начальной газовой фазе парциальное давление водяного пара составляет  , а после взаимодействия с медью объем газов согласно (2.49), остается постоянным, т.е.
, а после взаимодействия с медью объем газов согласно (2.49), остается постоянным, т.е.
 , (2.51)
, (2.51)
где: -равновесные парциальные давления газов для реакции 2.46.
-равновесные парциальные давления газов для реакции 2.46.
Комбинируя выражения для констант равновесия реакций 2.43, 2.50 и с учетом уравнения 2.51, получаем
 (2.52)
(2.52)
Сопоставление уравнений 2.52 и 2.44 показывает, что пары воды оказывают аналогичной влияние на поглощение водорода расплавом меди, как и чистый водород.
Температурная зависимость изменения свободной энергии Гиббса реакции 2.45, записанной обратном направлении выражается уравнением
ΔG°=-246115+54,12Т. (2.53)
С учетом зависимости изменения свободной энергии Гиббса от температуры для растворения атомарного водорода в жидкой меди
ΔG°=- 177851+5,54Т (2.54)
переходим к уравнению для константы равновесия
lg Кр= 22171/Т - 3,12 (2.55)
С другой стороны,
 , (2.56)
, (2.56)
откуда с учетом уравнения 2.55 получим
lg a[H]=1/2 lg  -1/2 lg a[O]- 22171/Т-3,12. (2.57)
-1/2 lg a[O]- 22171/Т-3,12. (2.57)
Растворимость водорода, находящегося в равновесии с газовой фазой, содержащей водяной пар в зависимости от его парциального давления и температуры определяется уравнением 2.57.
Рассчитаем по уравнению 2.57 предельную концентрацию водорода в меди для различных рассмотренных выше условий сжигания природного газа при 1423 К и концентрации кислорода 0.2 % (по массе). Коэффициент активности водорода принимаем γ[H]=1 (для бесконечно разбавленного раствора), кислорода, согласно данным таблицы 2.1. равной γ[О]=0,175, тогда
a[O] = γ[О ∙ N[O]=0,0014. (2.58)
Влиянием других компонентов раствора на величину активности кислорода и водорода пренебрегаем.
Расчетные значения концентрации водорода ( %, по массе) изменяются от 2,7∙10-6 (α=0.6) до 3,4∙10 -6 (α =1.05) при использовании воздушного окислителя. Применение воздуха, обогащенного кислородом 35 % О2 (α=1.15) концентрация водорода в анодной меди может достигать 4,0∙10-6, а с использованием технологического кислорода 4,9∙10-6 % .
Фактическая концентрация водорода в меди обычно больше равновесной и составляет величину порядка ~ 10-4 %. Высокие литейные свойства меди при разливке анодов (отсутствие «водородных раковин, пор ») обеспечиваются при содержании водорода менее 0,5 г/т или 5∙10-6 % (по массе) [H]. Поэтому необходимо обращать внимание на степень насыщения кислородом меди, поддержание оптимального соотношение коэффициента избытка окислителя (α) при сжигании топлива на горелках в печи, обеспечивающее минимальную концентрацию в атмосфере агрегата паров воды.
Источником газовых включений диоксида серы в металле является сера черновой меди, получаемой из сульфидного сырья и атмосфера печи. Зависимость изменения свободной энергии Гиббса от температуры для реакции
[S]+ 2 [О] = SO2 (2.57)
выражается уравнением
ΔG°= -178567+36.26∙Т, (2.58)
с учетом зависимости ΔG o от температуры реакции растворения атомарного кислорода в меди
ΔG°= -159000+20∙Т, (2.59)
переходим к уравнению
lg Kp=17653-2,94. (2.60)
Равновесная концентрация серы в зависимости от парциального давления диоксида серы, кислорода и температуры в этом случае описывается уравнением
 =
=  - 17653/Т +1.89 (2.61)
- 17653/Т +1.89 (2.61)
При сжигании природного газа парциальное давление SO2 в атмосфере печи составляет 0.0003 МПа. Для этих условий, а также при [О]=0.2 (% массе), активности кислорода a[O]= 0,0014,  =1 и температуре 1423 К, равновесная концентрация серы в меди составляет 2,7∙ 10-6 % ( по массе).
=1 и температуре 1423 К, равновесная концентрация серы в меди составляет 2,7∙ 10-6 % ( по массе).
Результаты выполненных расчетов свидетельствуют о возможности достижения требуемых остаточных концентраций серы в меди ( < 0,005 %) за счет выделения из расплава пузырьков SO2 . В этом момент наблюдается характерное «кипение ванны». Однако для более полного протекания процесса десульфурации металла необходимо поддерживать соответствующую степень окисленности меди ( 0,1-0,2 % [O]) и температуру (1415-1435 К).
В условиях барботажа расплава газообразными восстановителями одновременно протекает и десорбция жидкой меди. Дегазирующее действие основано на разнице парциальных давлений газов в меди и в пузырях, вследствие чего последние поглощают растворенные газообразные продукты реакций и выносят их на поверхность ванны. Использование в качестве восстановителя аммиака способствует десорбции газов, т.к. его взаимодействие с кислородом меди сопровождается образованием азота, являющимся дегазатором металла.
Эффективность дегазации может быть повышена вакуумированием меди или с использованием опыта предприятий черной металлургии продувкой расплава инертными газами. Рассчитаем, например, потребное количество аргона для удаления 50% серы из анодной меди с исходной равновесной концентрацией 2,7∙10-6 % , содержащей 0.2 % (по массе) кислорода при 1423 К.
газами. Рассчитаем, например, потребное количество аргона для удаления 50% серы из анодной меди с исходной равновесной концентрацией 2,7∙10-6 % , содержащей 0.2 % (по массе) кислорода при 1423 К.
Масса удаляемой серы в виде SO2, с одним бесконечно малым объемом dV пузырьком аргона составит
 , (2.61)
, (2.61)
где:  - равновесное парциальное давление SO2 в пузырьке аргона в момент его отделения от металла; dV — объем пузырька аргона, содержащий равновесное количество SO2.
- равновесное парциальное давление SO2 в пузырьке аргона в момент его отделения от металла; dV — объем пузырька аргона, содержащий равновесное количество SO2.
Переход серы из меди в пузырек аргона в виде SO2, приводит к изменению количества растворенной серы в 1 т меди на величину
(1000/100) d[S] (2.62)
Подставляя в выражение 2.61 величину  = Кp [S]∙[О]2, приравнивая 2.61 к 2.62 и интегрируя полученное уравнение относительно dV
= Кp [S]∙[О]2, приравнивая 2.61 к 2.62 и интегрируя полученное уравнение относительно dV

 =
= (2.63)
(2.63)
Получим
 (2.64)
(2.64)
Допуская, что пузырек аргона, выходя из металла, имеет парциальное давление SO2, соответствующее равновесному состоянию c величиной Кp, рассчитанной по уравнению 2.59 и равной 45808 (1423 К). После подстановки численных значений Кр, концентраций кислорода (0.008 мол.), серы [S]псх = =5,3∙10-8 мол, [S]кон =2,65∙10-8 мол. в уравнение 2.64, окончательно получим
V= =13,2 дм3/т. . (2.64)
=13,2 дм3/т. . (2.64)
Лекция 19. Практика рафинирования.
Вопрос 1. Типы печей.
В настоящее время на отечественных и зарубежных меде-рафинеровочных предприятиях преимущественно используют три разновидности печи:
1. Стационарные пламенные печи, типа отражательных.
2. Цилиндрические поворотные печи, типа конвертора.
3. Вращающиеся барабанные печи
Стационарная отражательная печь
Агрегаты вместимостью от 100 до 500 тонн. ОАО Уралэлектромедь. Парк печей с садкой 350 тонн. Удельный вес их в производстве рафинированной меди на предприятиях России и СНГ составляет 50-60% от общего парка печей. Применяют для переработки твердой и жидкой меди конструкция печей за многолетнюю практику их использования не изменилась.
Применяют энерготехнологические агрегаты с внедрением пара-испарительного охлаждения наиболее теплонапряженных узлов конструкции, с последующим применением пара для нужд производства. В частности возможен подогрев дутьевого воздуха вторичным паром до температуры 300-350 градусов. Весь комплекс и называется теплоэнергетическим агрегатом. Использование такого агрегата позволяет на 4,5-5% сократить расход топлива на газо-мазутной горелке. Применяют более качественные огнеупоры, кессонированные элементы (позволяет уменьшить расход огнеупоров) большинство отражательных печей оборудованных двумя торцевыми газо-мазутными горелками (мазут – резервное топливо ) и, на стадии плавления сжигают 2000-2200м3 газа. Газы идут в сборный боров, далее в котел-утилизатор, где осуществляется отъем теплоты, после чего происходит выброс в атмосферу. Футеровка – хромомагнезит и переклазо-хромитовые огнеупоры. Футеровке отводится главная роль в процессе шлакообразования, так как при типичном огневом, безреагентном рафинировании флюсы не вводят, поэтому шлакообразующими работают оксиды огнеупоров, заправочные материалы для наведения кварцевых откосов.
Технические характеристики пламенных печей
| Характеристики | |||
| Загрузка | 100 тонн | 200 тонн | 350 тонн |
| Размеры по кладке м. длина | - | 9,7 | 17,85 |
| Ширина | - | 5 | 5,96 |
| Высота- | - | - | 4 |
| Глубина ванны | - | 0,7 | 0,988 |
| Тип загрузки | Мостовой кран | Мостовой кран | Шаржерный кран |
| Тепловая нагрузка мДж/ч | 36,0 | 60,2 | 72,2 |
| Число гарелок | 1 | 2 | 2 |
| Подогрев дутья | - | - | 200-250 град |
| Съем шлака | ручную | ручную | Авто |
| Футеровка | переклазохромит | динас | форстерит |
Разновидностью стационарной отражательной печи является пламенная печка поворотного типа МЕРЦ см. мерседесс на заводе Люнен. Вместимость 300-350 тонн в России см.Кыштым, Новгород.
Наклоняющаяся печь конвертерного типа, для предприятий с полным циклом, когда анодный передел входит в структуру медеплавильного цеха и располагается рядом с конвертерным отделением. Это позволяет с помощью ковшей транспортировать медь в жидком виде в анодный передел. Для предприятий продуцентов, только черновой меди, когда рафинирование идет централизованно на 1 предприятии. То пользуют отражательные печи повышенной емкости.
Наклоняющиеся печи конвертерного типа - основные для США и Японии, емкость 160-400 тонн. Балхаш и Алмалык, Норильск, применяют цилиндрические печи по 200 тонн, на ОАО НН установлена 1 цилиндрическая печь оутокумпу 250 тонн.
Наклоняющиеся печи, по сравнению с отражательными печами, имеют преимущества:
1. Заливка черновой меди в них менее трудоемка и менее продолжительна
2. Цилиндрическая печь при необходимости может выполнять роль адского миксера. Это дает гибкость в управлении потоками расплава.
3. Сокращается продолжительность окислительного периода и восстановления меди за счет более высокой степени усвоения кислорода и восстановителя расплавом при подаче реагентов через фурмы. При обычной практике окисления и восстановления в стационарных печах процесс ведут с помощью трубок 50 мм, вводимых в расплав меди через рабочие окна печи. Под воздействием дутья, архимедовых сил, противодавления расплава погрузить трубки более чем на 10 см невозможно (всплывают). Поэтому газообразное формирование (струя, пузырьки газа реагируют с медью в процессе всплытия) с глубины 10 см и при этом время контакта газа очень мало. Поэтому окислитель (восстановитель) не успевает прореагировать с расплавом и степень его использования низка при операции восстановления природным газом. При использовании цилиндрической печи, а так же поворотной типа Мертс фурмы без особой сложности можно заглубить на любую глубину в расплав, определяемую углом поворота печи. Так время контакта и полнота использования реагента растет.
4. Занимает меньшую площадь и имеет меньшие ремонтные затраты.
5. Для стационарной печи надо 500 тонн огнеупоров, а для цилиндрической 150 тонн
6. Более оперативное. Возможность решения в случае аварийных ситуаций при утечке меди. Суть в сливе меди.
Недостаток – недостаточная герметичность печи.
Футеровка цилиндрических печей- хромомагнезит и магнезитохромит
Печь фирмы оутокумпу так же сохраняет элементы горизонтального конвертора пирсосмитта, но отличается способом эвакуации газов. С этой целью на противоположной от горелки торцевой части печи предусмотрено отверстие диаметром 900мм. Газы через горловину не выбрасываются. Дополнительно идет продувка расплава 2 погружными фурмами. Шлак удаляют шлакосъемной машиной, через горловину при повороте печи. Хромито-переклазовые огнеупоры.
Вопрос 2. Характеристика печи «Мерц»
Печь состоит из жестко-сваренных стальных сегментов опирающихся на обойму с роликами. Для поворота печи применена гидравлика, она дает при разливке меди скорость поворота 6*10^-3 м/с, а слив шлака и возврат печи в исходное положение 15*10^-3м/с. Печь топится двумя горелками, причем горелки снабжены инфракрасными датчиками светимости факела, в зависимости от которой поддерживается соотношение избытка окислителя. Подача воздуха и природного газа идет с помощью блока фурм(4шт.) в задней стенке печи фурмы могут быть при повороте печи погружены в расплав на глубину до 1 м. Футеровка – хромомагнезит.
Технические характеристики печей:
| Характеристики | АМ 200 | Оутокумпу | Мерц |
| Емкость печи | 200 | 250 | 220-350 |
| Размеры кладки длинна | Длинна 9,2 | 9,2 | 13,8 |
| ширина | - | - | 6 |
| высота | - | - | 4,5 |
| Глубина ванны | 1,29 | 1,4 | 1,1 |
| Площадь пода м2 | - | - | 60 |
| Диаметр корпуса | 3,9 | 3,9 | - |
| Тепловая нагрузка мДж/ч | 32 | 46,2 | 96 |
| Расход воздуха на окисление м3/ч | - | - | 1400 |
| Давление воздуха мПа | 0,25 | ||
| Расход газа на восстановление м3/ч | - | 600-800 | До 1200 |
| Масса футеровки тонн | - | - | 450 |
Используя опыт предприятий черной металлургии, разработаны конструкции огнеупорных пористых втулок, которые устанавливаются в нижней части печи, ближе к поду. Применяется на заводе Люнен. Подача природного газа через пористые втулки позволяет получать большой объем мелких диспергированных в расплаве пузырьков восстановителя с высокоразвитой поверхностью контакта. Практика показала, что степень использования восстановителя растет до 90%. Причем пористая втулка находится в рабочем состоянии и при отсутствии дутья. Расплав не проникает в поры втулки, так как благодаря высокому межфазному натяжению жидкая медь-огнеупор, расплав только прикрывает поверхность пор, не проникая внутрь. Так при остановке дутья и следующей его подаче проблемы не возникают.
Вращающиеся печи барабанного типа не применяются в России и стоят всего на 4 заводах Хитачи Япония, Швеция, Лакаридат(Мексика), Мантос-бланкос(Чили). Емкость печей 60т. Представляет собой горизонтальный цилиндр с конусными торцевыми частями. Корпус из стали стоит на роликах, футерован хромомагнезитом или шамотом. Воздух дают фурмами.
Вопрос 3. Оборудование для разливки анодов
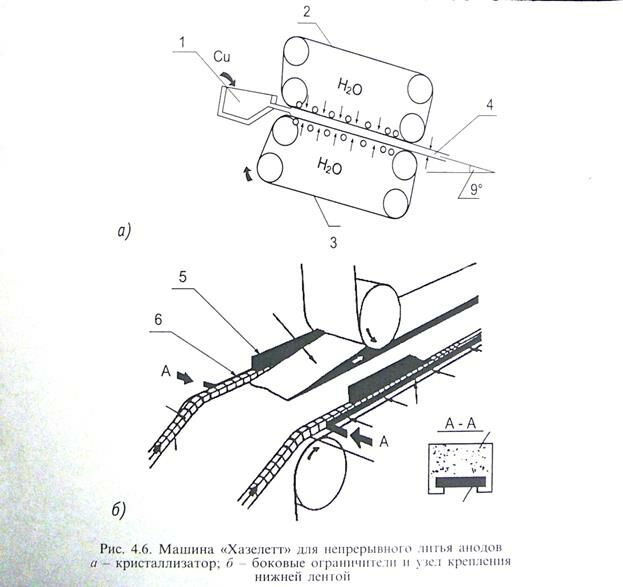
Непрерывная разливка анодов на машине хазелет с двойной лентой применяется на 6 зарубежных заводах. Принцип действия показана на рисунке на рисунке.
Презентация.
Машина ставится под углом 9 градусов к горизонту, и расплав подают в воронку 1 из щели, через которую металл поступает в машину. Машина работает по принципу подвижной изложницы. Литье происходит между двумя стальными, водоохлаждаемыми лентам толщиной 1,27 мм, шириной 1650 мм верхний, позиция 2 и нижний позиция 3. Ширина полосы 4 регулируется цепями-ограничителями 5 (Брусы), жесткозакрепленными на боковых стальных лентах 6 приводимых в движение нижней лентой 3. Максимальная ширина ленты 1650 мм, толщина 12,7, длинна 2260мм. Производительность машины 60 тонн в час по металлу и 4,45 погонных метров в минуту. Скорость подачи расплава меди в машину поддерживают постоянной, с помощью автоматики контроля уровня расплава, поэтому нет необходимости в регулировании скорости движения ленты. Температура меди при литье 1413-1423 кельвина, а температура анода на выходе из кристаллизатора 1073-1123 кельвина. Система охлаждения кристаллизатора обеспечивает впрыскивание воды при давлении 0,52мПа через форсунки на поверхность лент 2-3 расход 2300м3 в час. Температура отходящей воды менее 328 градусов, а температура лент на участке менее 463 кельвина. Отлитая лента опирается на водоохлаждаемый стол, проходит через протяжные валки, которые синхронизируют скорость разливочной машины с учетом усадки меди при затвердевании.
Резку готовой анодной полосы ведут плазмотронами или штампуют на гильотине, которые перемещаются вместе с полосой анода.
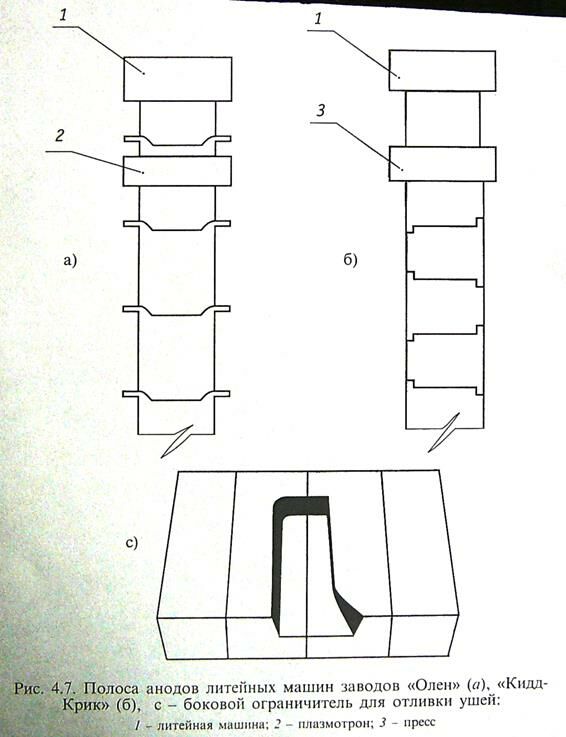
ПРЕЗЕНТАЦИЯ
Капитальные затраты на оборудование плазменной резки на 60% меньше, но качество механической штамповки выше.
На заводе ОЛЕН резку ведут 4-мя плазмотронами с производительностью 80 тонн в час. Особенностью производства является то , что отливка анодных ушей (позиция А) в отличии от завода кит-крит Б происходит непосредственно на полосе с применением специального профиля бус, предусмотренных в цепи-бортике фрагмент С. После охлаждения аноды идут по цепному транспортеру к штабелеукладчику, который формирует 2 пакета анодов по 10 штук в каждом, далее они едут в цех электролиза меди.
Люди также интересуются этой лекцией: 5 Массовая коммуникация.
Преимуществом процесса является получение анодов правильной формы, что повышает вертикальность их установки в электролизной ванне и уменьшает межэлектродное расстояние. Кроме того, аноды отлитые таким способом характеризуются постоянством масс, симметричностью структуры при кристаллизации и равномерностью распределения кислорода. Недостаток – высокие капитальные и эксплуатационные затраты. Современные агрегаты непрерывной разливки имеют мощность 130-140 тысяч анодов в год.
Вопрос 4. Разливочная машина.
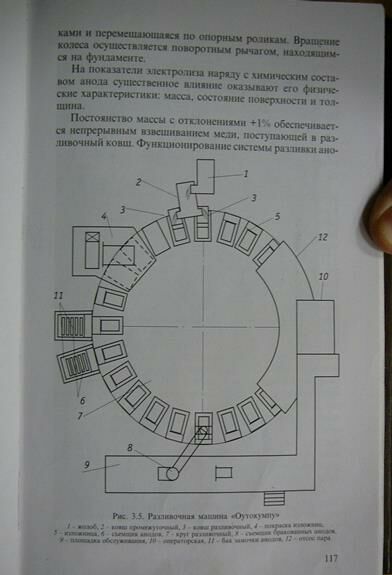
Презентация
Часто применяются машины карусельного типа, методом дополнительного литья в горизонтальные изложницы. На большинстве заводов используют машины с диаметром колеса от 9,5 до 21 метра. Оборудование, унифицированное с разным количеством изложниц 12-16-10-24-28 и производительностью 30-35-41-45-60-70-75 тонн в час. В мире работает более 100 таких комплексов фирмы оутокумпу. В комплексе карусельная машина с 1-2 разливочными ковшами, карусели, устройство для охлаждения подъемника для отбраковки анодов, оборудование их съема и укладки в ванны для охлаждения, кроме того предусмотрена обработка изложниц. И прочие управляющие системы. Разливочная машина состоит из радиально расположенных балок, на которых стоят смонтированные балки с изложницами, есть возможность двигать изложницы по вертикали в нижней части стоит рельсовое колесо, жестко-связанное с радиальными балками, которое перемещается по опорным роликам. Оутокумпу обеспечивает постоянство массы с отклонением +/- 1%, контроль за массой расплава в промежуточном ковше идет тэнза-датчиками. От них сигнал идет к исполнительным механизмам, который осуществляет соответствующий наклон разливочного ковша в соответствующую сторону по мере их заполнения медью.
Технические характеристики
Анодо-разливочный комплекс М24 карусельного типа. Возможно, что такая машина стоит в Норильске, производительность 58 тонн/час, масса анода 200-350 кг. Гарантируемая точность массы анода - процент от числа разлитых анодов 85. Допуск по массе 1%. Система управления- электроника + компьютер. По анодам допускается пористость поверхности диаметром 2-3 мм на 35% от общей рабочей части изложниц. Срок жизни изложниц 15-20 плавок. Отработанные переплавляют, масса изложниц 3,7 тонны.
Самостоятельно мы должны проработать непрерывные процессы огневого рафинирования, устройство и схема работы рафинировочной печи митсубиси, описание процесса Гумбольд и процесс КОНТИМЕЛТ. Схема процесса и показатели.