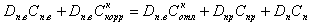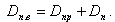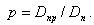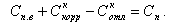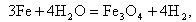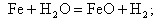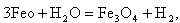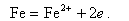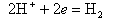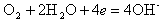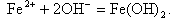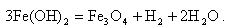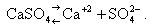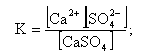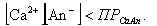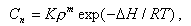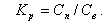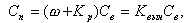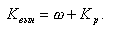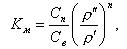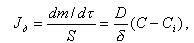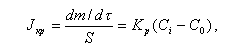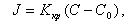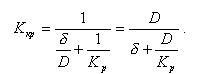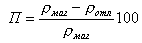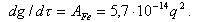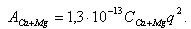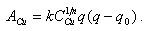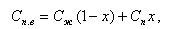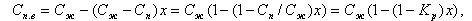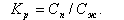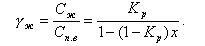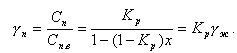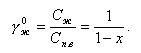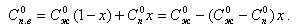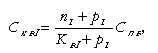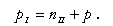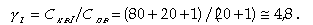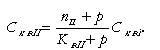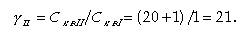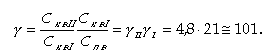Физико-химические процессы в пароводяном тракте парового котла
11.Физико-химические процессы в пароводяном тракте парового котла
11.1.Материальный баланс примесей в пароводяном тракте парового котла
Питательная вода, поступающая в паровой котел, представляет собой раствор в воде различных веществ неорганического и органического характера. В ней содержатся катионы Na+, Ca2+, Mg2+; анионы Cl-, SO42-, SiO32-, OH-, CO32- и др; продукты коррозии конструкционных материалов (оксиды Fe, Si, Cr, Ni, Zn, Co, Al и др.); летучие примеси O2, CO2, NH3, H2, N2 и др. Кроме растворенных веществ в питательной воде содержатся и взвешенные частицы различной дисперсности.
На (рис. 11.1) представлена принципиальная тепловая схема блока ТЭС и указаны пути поступления примесей в пароводяной тракт. (На этой схеме не указаны места ввода корректирующих реагентов).
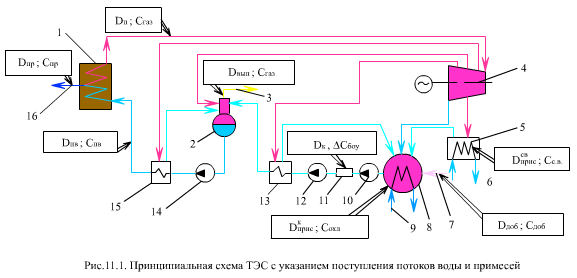
Из (рис. 11.1) видно, что питательная вода в паровой котел 1 вносит за единицу времени (секунду, час, год и т.д.) примеси в количестве Dп.в Сп.в, где Сп.в - концентрация примесей в питательной воде.
В паровом котле концентрация примесей увеличивается за счет продуктов коррозии (+Cкоррн) и уменьшается за счет отложения ее на поверхности нагрева (-Cкоррн) и продувки котла в количестве DпрСпр, где Dпр количество продувочной воды 16, Спр - концентрация примесей в ней. Из котла уходит перегретый пар Dп с концентрацией примесей Сп. В результате для парового котла материальный баланс примесей запишется в следующем виде
|
| (11.1) |
Материальный баланс по рабочей среде
Доля продувки
|
| (11.3) |
Коррозия металла в паровом котле увеличивает концентрацию примесей в воде, снижает механическую прочность металла.
Отложение примесей на внутренней поверхности трубы вызывает повышение температуры стенки вплоть до разрушения и снижает коэффициент теплопередачи.
Концентрация примесей в перегретом паре Сп ограничивается условиями работы турбины 4. При отложении примеси в проточной части турбины увеличивается ее шероховатость и коэффициент сопротивления трению, скорость пара за счет сужения проходного сечения, что приводит к росту перепада давления на ступенях турбины и к увеличению осевого сдвига ротора. Приходится уменьшать расход пара на турбину и ее мощность. Лопатки турбины в зоне начала конденсации водяных паров подвержены коррозионному растрескиванию, что может привести к отрыву лопатки с тяжелыми аварийными последствиями.
В барабанных паровых котлах Сп зависит от Сп.в, доли продувки р, интенсивности процессов коррозии и отложения примеси. Для снижения скорости отложения примеси концентрацию Сп.в необходимо уменьшить. Повышенные требования к чистоте пара (снижение Сп) требуют увеличения доли продувки и, соответственно, приводят к снижению экономичности парового котла.
При наличии продувки в котле концентрация примеси в питательной воде Сп.в может быть значительно выше, чем в паре Сп, что снижает требования к подготовке воды для барабанных котлов. В прямоточных котлах докритического давления, в принципе, можно организовать продувку котла. Для этого в конце испарительного участка при влагосодержании 1…2% (x = 0,98…0,99) устанавливается сепаратор, в котором влага отделяется от пара и удаляется из цикла. Но при этом возникает ряд трудностей:
1) в прямоточном котле граница между испарительным и перегревательным участками четко не зафиксирована, она при изменении режима работы котла перемещается по длине теплопередающих труб; следовательно, в сепаратор при одном режиме будет поступать пароводяная смесь с большим водосодержанием, в другом - перегретый пар; система регулирования водосодержания на входе в сепаратор получается сложной и дорогой;
2) продувка в прямоточном котле малоэффективна, так как основное количество примеси образует отложения на стенках трубы на более ранних этапах испарения воды. Поэтому в прямоточных котлах докритического давления продувка не делается. При сверхкритическом давлении продувку котла в принципе сделать нельзя. Для прямоточных котлов материальный баланс примесей будет следующим
|
| (11.4) |
Считая, что Cкоррн и Cотлн должны быть сведены до минимально возможных значений, получим, что Сп.в ≈ Сп, т.е. качество питательной воды должно быть близким к качеству пара.
Рассмотрим основные пути поступления и частичного удаления примесей в пароводяном тракте энергетического блока.
Примеси вносятся водой, поступающей в пароводяной тракт через неплотности в сетевых подогревателях 5 и конденсаторе 8.
Сетевая вода 6 химически обрабатывается, концентрация примесей в ней Сс.в. При нормальной работе подогревателей Cприссв=0.
Переток охлаждающей воды 9 в конденсаторе Dприс составляет обычно 0,001…0,002%, но иногда доходит до 0,01…0,02% и выше. На охлаждение конденсатора подается вода из рек и озер (Сохл ≤ 800…1000 мг/кг), в ряде случаев - из морей (Сохл ≤ 30000 мг/кг). В итоге количество поступающей примеси может быть значительным - до 1…3 мг/кг.
Добавочная вода 7 (в количестве Dдоб) подается, как правило, в паровое пространство конденсатора, где происходит ее деаэрация. Количество добавочной воды зависит от типа ТЭС. На конденсационной электростанции и отопительной ТЭЦ добавочная вода восполняет потери на продувку котла, в уплотнениях турбины, через неплотности во фланцах и арматуре. Все эти потери составляют 1…3% от паропроизводительности котла Dп. В этом случае проводят полное химическое обессоливание добавочной воды, концентрация примесей Сдоб в ней мала (50 мкг/кг). На ТЭЦ производственного типа возможна безвозвратная отдача пара на технологические нужды, и на его восполнение требуется большое количество добавочной воды (до 20…40% и более), которая проходит более дешевую обработку - глубокое умягчение с частичным обескремниванием.
Современные блоки СКД на ТЭС в целях уменьшения Сп.в оборудуются блочными обессоливающими установками (БОУ) 11, через которые проходит весь конденсат Dк. В БОУ происходит улавливание части примесей. После БОУ располагается конденсатный насос II подъема 12.
Из турбины отбирается пар ΣDотб на ПНД 13, деаэратор 2, ПВД 15, турбопривод питательного насоса 14. Конденсат этого пара с концентрацией примесей Сотб направляется в конденсатор или деаэратор.
Из деаэратора отбирается часть пара Dвып с газами Сгаз, перешедшими в пар из конденсата (О2 СО2 и др.), так называемый выпар.
Продукты коррозии конденсатного тракта и тракта питательной воды поступают в котел с питательной водой.
Летучие примеси потоков воды, направляемых в конденсатор, частично удаляются в конденсаторе, БОУ и деаэраторе; поступают эти примеси с присосами воды, через неплотности в конденсаторе и на всасе конденсатного насоса I подъема 10, образуются в результате коррозии, процессов радиолиза на АЭС, направляются как корректирующие добавки.
Таким образом, водно-химический режим паровых котлов необходимо рассматривать как часть водно-химического режима энергетических блоков. В общем виде задачей водно-химического режима блока является обеспечение надежности и экономичности работы всего оборудования блока. Эта задача может быть решена при обеспечении необходимой чистоты питательной воды и перегретого пара, при ограничении образования отложений в паровом котле, турбине, в трубопроводах (отложения примесей в трубопроводах более опасны на одноконтурных и двухконтурных АЭС, так как они радиоактивны), при снижении до безопасного уровня интенсивности коррозионных процессов в оборудовании и трубопроводах.
11.2.Коррозия металла в пароводяном тракте парового котла
Коррозией называется процесс разрушения металлов или сплавов при протекании физико-химических процессов на границе раздела металл-среда. Коррозия приводит к частичному или полному разрушению кристаллической решетки и изменению свойств материала, вплоть до его разрушения. Коррозия может вызываться химическими, электрохимическими, механическими причинами, влиянием нейтронного поля и другими факторами.
Различают общую и местную коррозию. Общая коррозия охватывает всю поверхность металла, смачиваемую теплоносителем; местная коррозия проявляется на отдельных участках поверхности и разделяется на питтинг-коррозию, крекинг-коррозию и избирательную.
Питтинг-коррозия протекает на отдельных небольших участках поверхности нагрева и проявляется в виде язв, коррозионных точек или пятен.
Крекинг-коррозия (коррозионное растрескивание) возникает на участках металла, находящихся под большим механическим напряжением. Проявляется крекинг-коррозия в виде трещин, проходящих по границам зерен металла или через сами зерна.
Избирательная коррозия представляет собой растворение какого-либо элемента, входящего в сплав.
Химическая коррозия подчиняется законам химических гетерогенных реакций и не сопровождается возникновением электрического тока, является результатом протекания химических реакций между металлом и рабочим телом (теплоносителем), когда теплоноситель не является электролитом (сухие газы, перегретый пар). Трубы, поступающие на изготовление поверхностей нагрева и соединительных участков, подвержены химической коррозии на воздухе при их изготовлении и хранении. Полученный при этом слой оксидов железа имеет переменную толщину и плотность, неустойчив. Перед пуском оборудования этот слой оксидов удаляется химической промывкой. В процессе пуска и работы оборудования необходимо создать условия для образования устойчивой защитной пленки.
Химическая коррозия протекает в пароперегревателях при t = 500…570°С (в этом случае ее называют также пароводяной коррозией) и может быть описана реакцией Шодрона
|
| (11.5) |
в результате которой на поверхности металла образуется магнетит Fe3O4, который стабилен и создает защитную пленку. При температуре на стенке свыше 570°С протекают реакции:
|
| (11.6) |
|
| (11.7) |
в результате которых образуется не только магнетит, но и вюстит FeO, оксидная пленка при этом имеет пониженные защитные свойства.
Хорошая защитная пленка магнетита должна быть плотной и иметь толщину (0,4…1,0)∙10-4 мм. При большей толщине оксидов пленка имеет малую механическую прочность и может разрушаться. Разрушение пленок наиболее интенсивно происходит при переменных режимах.
Оксидная пленка в пароперегревателях может разрушаться при попадании и осаждении на стенках различных солей (в результате нарушения режима работы барабана - вспенивания, заброса воды в пароперегреватель). При попадании на стенку пароперегревателя NaOH происходит не только разрушение защитной пленки, но и щелочная коррозия, коррозионное растрескивание аустенитной стали происходит и под воздействием хлоридов.
Для предотвращения разрушения оксидных пленок ограничивают скорость протекания пароводяной коррозии за счет хромирования, никелирования или насыщения алюминием поверхности стали, стремятся не допускать попадания в пароперегреватель едкого натра, хлоридов и других примесей.
Электрохимическая коррозия - это химическая коррозия, которая сопровождается протеканием электрического тока, возникает в случае, когда теплоноситель является электролитом, при этом на границе металл - рабочее тело возникают микрогальванические (коррозионные) элементы. Электрохимической коррозии подвержены все поверхности энергетических блоков, омываемые водой и пароводяной смесью. Деление на химическую и электрохимическую коррозию условно, во многих случаях оба процесса протекают одновременно, влияя друг на друга.
Особенностью коррозии является возникновение микрогальванических элементов на границе металл - рабочее тело. Анодный и катодный процессы могут протекать поочередно на одном и том же месте, или, в большинстве случаев, они разделены пространственно (рис. 11.2).
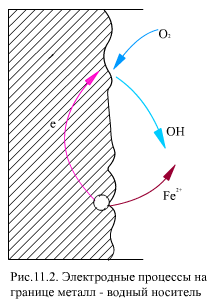
Анодный процесс - окисление металла, в результате чего ион металла Fe2+ переходит в воду, а электроны накапливаются в металле
|
| (11.8) |
На катоде происходит ассимиляция (поглощение) электронов деполяризаторами, в качестве которых могут выступать H+ или О2-,
|
| (11.9) |
|
| (11.10) |
На аноде создается двойной электрический слой, электроны в металле образуют отрицательную внутреннюю часть, гидратированные ионы металла - положительную внешнюю часть. При этом появляется электрохимический (электродный) потенциал катодного или анодного процесса j и в растворе возникает движение ионов, а в металле - электронов, т.е. в системе возникает ток i. Анодный ток характеризуется удалением от металла его ионов, т.е. анодный ток пропорционален скорости анодного растворения металла, скорости его коррозии. На катодном участке электроны передаются деполяризаторам, находящимся в растворе, которые восстанавливаются. Для анализа свойств системы железо-вода-кислород используются диаграммы j =f(pH) или диаграммы Пурбэ.
Эти диаграммы показывают связь между электродным потенциалом металла φ, водородным показателем рН водного раствора и термодинамически устойчивыми формами оксидов железа, при этом учитывается и растворимость получаемых оксидов или гидроксидов железа.
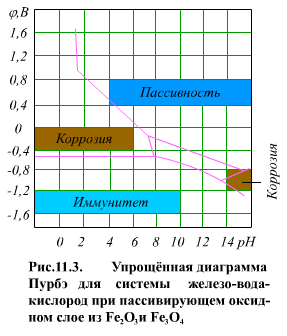
На (рис. 11.3) показана упрощенная диаграмма Пурбэ для системы железо-вода-кислород. При определенных сочетаниях φ и рН могут быть: зона коррозии металла (присутствуют ионы Fe+2, Fe+3, HFeO-2 ); зона иммунитета (железо не корродирует); зона пассивности (зона пассивации; в этой зоне: железо не корродирует, так как образуется защитная оксидная пленка из Fe2O3 или из смеси Fe2O3 и Fe3O4).
Из диаграммы Пурбэ (рис. 11.3) видно, что для системы железо-вода-кислород имеются две коррозионные зоны - при высоком и низком значениях рН. Коррозия металла в этих зонах равномерна. Воздействуя на среду каким-либо восстановителем, потенциал электрода можно понизить до значений зоны иммунитета. Металл в зоне иммунитета термодинамически устойчив и не корродирует. Второй способ защиты металла: введение в систему окислителя с увеличением окислительно-восстановительного потенциала поверхности металла до перехода в зону пассивности. Железо в зоне пассивности термодинамически неустойчиво. Увеличение концентрации окислителя улучшает защитные свойства пленки.
При температуре свыше 200°С образование защитной пленки на поверхности металла протекает одновременно по двум механизмам - химической и электрохимической коррозии.
В поверхностном слое металла происходит окисление железа по уравнению химической коррозии (11.5).
Слой магнетита растет от начальной границы металла а (рис. 11.4) внутрь основного металла, образуя так называемый топотактический слой б (внутренний слой) защитной пленки.
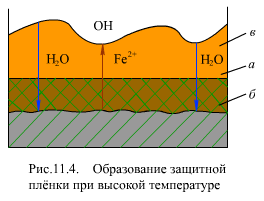
Образовавшиеся ионы Fe2+ (в результате электрохимической коррозии поверхности металла) диффундируют через защитную пленку и в растворе реагируют с гидроксильными ионами, образовавшимися на катодном участке
|
| (11.11) |
Это соединение превращается в магнетит (по реакции Шикорра)
|
| (11.12) |
Образовавшийся в растворе магнетит кристаллизуется и адсорбируется на поверхности и образует менее плотный внешний слой в (эпитактический слой) защитной пленки.
Таким образом, при высокой температуре защитная оксидная пленка состоит из двух слоев: внутреннего слоя, по своим характеристикам (плотность, теплопроводность) близкого к основному материалу, и внешнего слоя, состоящего из более или менее плотноупакованных кристаллов магнетита, пропитанных теплоносителем, плотность его и теплопроводность меньше основного металла и внутреннего слоя.
Разновидностями электрохимической коррозии являются щелочная и кислотная коррозии, которые определяются локальным изменением показателя рН среды. Минимальная скорость растворения защитной пленки Fe3O4 соответствует значениям показателя рН300 (при t = 300°С) от 6 до 9. При показателе рН < 6 пленка магнетита начинает интенсивно растворяться, металл корродирует (кислотная коррозия), аналогично при показателе рН300 > 9 (щелочная коррозия). Но при общем допустимом значении рН возможны места концентрирования кислоты или основания на границе металл - вода. Концентрирование электролитов происходит в пористых отложениях примесей, шлама, имеющих определенную площадь распространения. При этом коррозия будет равномерной по этой площади.
Щелочная равномерная коррозия возникает при фосфатном водном режиме, когда возможно появление свободного едкого натра. При концентрации в порах NaOH 15…20% сталь начинает растворяться.
11.3.Растворимость примесей в водном теплоносителе
Примеси, поступающие в водный теплоноситель, можно разделить на две группы: естественные примеси и продукты коррозии. Естественные примеси поступают в водяной тракт за счет присосов воды в конденсаторе и сетевых подогревателях, с добавочной водой; остаточная концентрация катионов Na, К, Са, Mg не изменяется после БОУ (после конденсатора, если нет БОУ). Продукты коррозии (катионы Fe, Cu, Al и др.) образуются в самом водяном тракте, их количество увеличивается по мере прохождения среды по тракту.
Естественные примеси делятся на две группы: трудно (мало) растворимые и легко (хорошо)растворимые.
К труднорастворимым соединениям относятся соединения Са и Mg: сульфат CaSO4, карбонаты СаСО3, MgCO3, силикаты СаSiO3, MgSiO3, гидроксиды Са(ОН)3, Mg(OH)2.
К легкорастворимым соединениям Са и Mg относятся: сульфат MgSO4, хлориды CaCI2, MgCL2, бикарбонаты Са(НСО3)2, Mg(HCO3)2. Все натриевые соединения обладают высокой растворимостью в воде.
Поступление в паровой котел труднорастворимых соединений кальция и магния с питательной водой лимитируется на достаточно низком уровне. При нарушениях в работе конденсатоочистки, увеличении присосов воды в конденсаторе количество поступающих соединений Са и Mg значительно возрастает.
Такие соединения, как CaSO4, CaCO3, Mg(OH)2, имеют отрицательный температурный коэффициент растворимости, т.е. с ростом температуры растворимость падает (рис. 11.5). В природных водах содержание Са существенно выше, чем Mg, поэтому при анализе поведения труднорастворимых соединений обычно рассматривают только соединения Са.
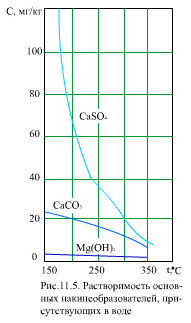
Труднорастворимые соединения в воде частично диссоциируют на ионы (катионы Mem+ и анионы Ann-). Например:
|
| (11.13) |
Степень диссоциации К равна (вместо активностей рассматриваем концентрации ионов, что для разбавленных растворов допустимо)
|
| (11.14) |
|
| (11.15) |
Произведение концентрации (активностей) ионов труднорастворимой соли в насыщенном растворе, называемое произведением растворимости ПР, постоянно при данной температуре и зависит от температуры системы.
При упаривании воды в испарительных поверхностях нагрева концентрация всех ионов повышается и может достигнуть насыщения. В первую очередь кристаллизоваться из водного раствора будут те соединения, произведение растворимости которых минимально. Соединения с отрицательным коэффициентом растворимости кристаллизуются в основном на поверхности нагрева, образуя накипь. Такие вещества называют накипеобразователями. Другие вещества, с положительным коэффициентом растворимости, кристаллизуются в объеме раствора на грубодисперсных и коллоидных частицах, образуя шлам, т.е. мелкие взвешенные в воде частички (вещества - шламообразователи).
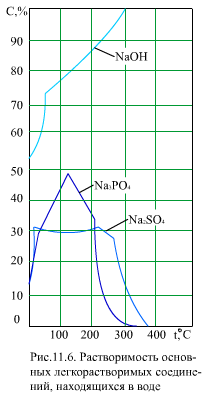
На (рис. 11.6) приведены значения растворимости для некоторых легкорастворимых соединений. Видно, что некоторые из них (NaOH) имеют положительный коэффициент растворимости во всем приведенном диапазоне температур, другие (Na3PO4, Na2SO4) - только до 100…150°С, а при температуре свыше 200°С имеют отрицательный коэффициент растворимости. При нормальной работе барабанных котлов концентрация этих примесей обычно значительно меньше их растворимости, и кристаллизоваться на стенках трубы или в объеме среды они не будут. Только в местах упаривания воды (в отложениях на стенке, в прикипевшем к стенке шламе) и в зоне кризиса теплообмена возможно достижение насыщения и выпадение легкорастворимых соединений.
Растворимость веществ в воде и паре определяется физико-химическими свойствами вещества и водного теплоносителя, которые, в свою очередь, зависят от температуры и давления. В области, примыкающей к температуре кипения при ДКД и в зоне большой теплоемкости при СКД, плотность водного теплоносителя резко падает до относительно низких значений в паровой фазе. Соответственно растворяющая способность теплоносителя снижается.
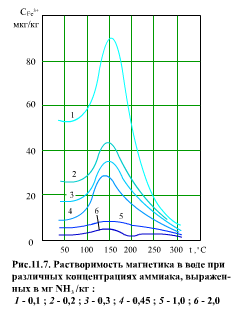
В питательной воде содержится заметное количество различных продуктов коррозии конструкционных материалов. Наиболее важную роль в образовании внутритрубных отложений, в интенсивности коррозии играет магнетит Fe3O4. Растворимость магнетита в воде представлена на (рис. 11.7). Видно, что максимум растворимости магнетита приходится на температуру порядка 150°С, а затем растворимость уменьшается до температуры 300…350°С. С увеличением концентрации аммиака (при этом рН растет с 8,75 до 9,7) растворимость магнетита падает.
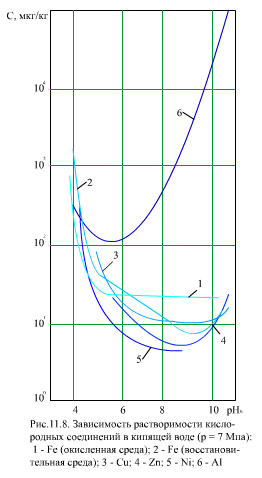
В действительности концентрация магнетита в питательной воде может быть в несколько раз выше растворимости. Это означает, что в воде магнетит находится не только в растворенной форме, но и имеются коллоидные и грубодисперсные частицы. Растворимость других оксидов металлов в воде имеет такой же порядок, что и растворимость магнетита (рис. 11.8).
Растворимость веществ в перегретом паре описывается формулой
|
| (11.16) |
где К - постоянная для данного вещества величина; m - координационное число, показывающее среднестатистическое количество молекул воды, скоординированных около одной частицы растворяющегося вещества; ∆Н - тепловой эффект реакции растворения. Так как плотность пара ρ с ростом температуры уменьшается, а экспонента увеличивается, то можно ожидать, что растворимость веществ в паре будет иметь минимум при какой-то температуре.
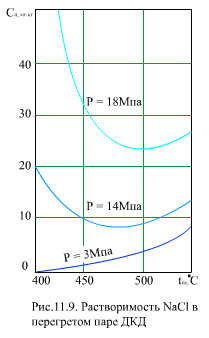
На (рис. 11.9) для примера показана растворимость NaCI в перегретом паре для нескольких значений давления. Видно, что при р = 14 МПа и 18 МПа, имеются минимумы растворимости при температуре 470…500°С. С увеличением давления плотность пара и растворимость веществ растет.
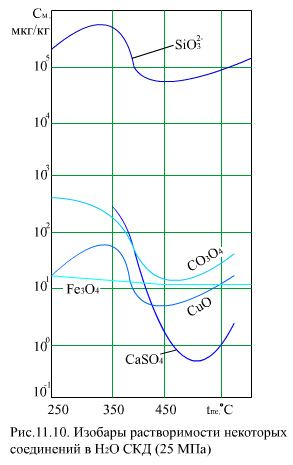
При сверхкритическом давлении плотность среды плавно изменяется от плотности воды до плотности пара, наиболее интенсивное (по температуре) изменение плотности происходит в ЗБТ. Поэтому растворимость веществ в жидкой фазе (до ЗБТ) при СКД аналогично растворимости в воде при ДКД, т.е. может иметь положительный или отрицательный температурный коэффициент растворимости. В зоне большой теплоемкости растворимость веществ из-за резкого уменьшения плотности среды снижается, а затем, при переходе в область перегретого пара, может дальше снижаться или, после прохождения минимума, расти (рис. 11.10).
11.4.Переход примесей из воды в насыщенный пар
Примеси, содержащиеся в воде, могут перейти в равновесный с ней насыщенный пар за счет уноса влаги паром (влажность пара ω) и за счет растворимости в насыщенном паре. В двухфазной равновесной системе между концентрациями растворенного вещества в паре Сп и воде Св поддерживается определенное соотношение, которое называется коэффициентом распределения Kp
|
| (11.17) |
С учетом влажности пара количество примесей в паре
|
| (11.18) |
где Kвын - суммарный коэффициент выноса примесей в пар
|
| (11.19) |
Унос влаги паром - гидродинамический процесс, рассматривался в гл.9.
Коэффициент распределения Кp характеризует физико-химические процессы, зависит от давления (температуры) в системе, свойств растворенного вещества и раствора, в котором кроме данного вещества обычно содержатся другие компоненты.
Коэффициент распределения Kp, рассчитанный по (11.17), называют еще видимым коэффициентом распределения (иногда обозначают Kpвид ). Коэффициент Kp не учитывает формы существования вещества в растворе: молекулярную и ионную.
Аналогично вводятся понятия истинных коэффициентов распределения для молекулярной Км и ионной Ки форм.
Формула для расчета молекулярного коэффициента распределения
|
| (11.20) |
где n - координационное число, зависящее от природы растворенного вещества.
В логарифмических координатах
|
| (11.21) |
зависимость (11.20) представляет собой прямую линию, выходящую из точки р = ркр, ρ′ = ρ″, Км = 1, угол наклона которой определяется числом n. На (рис. 11.11) показана часть лучевой диаграммы.
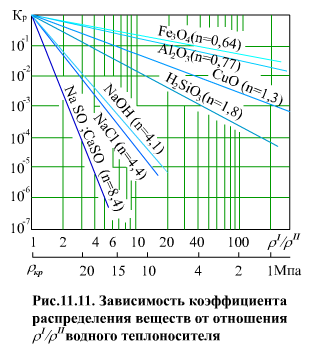
I - весьма слабые электролиты (n < 1), в водных растворах почти недиссоциированы, коэффициент распределения при p = 11 МПа и выше составляет десятки процентов (типа гидратированных оксидов железа, алюминия и т.п.);
II - менее слабые электролиты (n = 1…3), коэффициент распределения в том же диапазоне - проценты (типа кремнекислоты);
III - сильные электролиты (n > 3), практически полностью диссоциированы, коэффициент распределения - десятые, сотые и меньшие доли процента (силикаты, сульфаты, фосфаты натрия, кальция).
Ионные формы растворенных веществ более гидратированы, координационное число n у них больше, а коэффициент распределения - меньше, чем у молекулярной формы. Видимый коэффициент распределения Кp зависит от Км, Ки и доли диссоциированных молекул.
Для слабых электролитов видимый коэффициент
|
| (11.22) |
где β - доля молекулярной формы в общей концентрации растворенного вещества; (1 – β) - доля ионной формы.
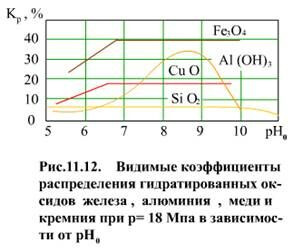
На β влияет не только давление, но и показатель рН. Поэтому при одном и том же давлении Кр будет различным в зависимости от показателя рН (рис. 11.12). Однако Кp для Fe3O4, SiO2, CuO в широких пределах изменения показателя рН (в рабочем диапазоне для паровых котлов) постоянен. Объясняется это тем, что для слабых электролитов β ≈ 1, (1-β) ≈ 0, т.е. Кp ≈ Kм.
Для сильных электролитов (соли сильных оснований и кислот) определяется степень диссоциации α (доля ионной формы вещества), которая зависит от концентрации электролита и давления (плотности), но не зависит от показателя рН. Коэффициент распределения (видимый) выражается через степень диссоциации в воде αв и средние коэффициенты активности в воде fв и паре fп:
|
| (11.23) |
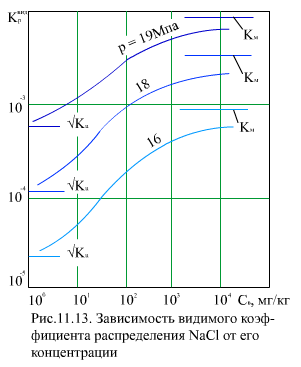
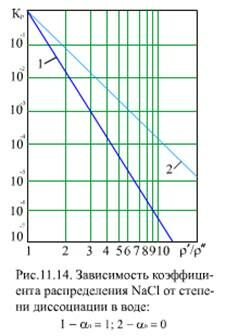
Из (11.23) видно, что Kp изменяется от значения  при αв =1 до Км при αв = 0 (рис. 11.13). Соответствующие лучи для
при αв =1 до Км при αв = 0 (рис. 11.13). Соответствующие лучи для  и Км представлены на (рис. 11.14).
и Км представлены на (рис. 11.14).
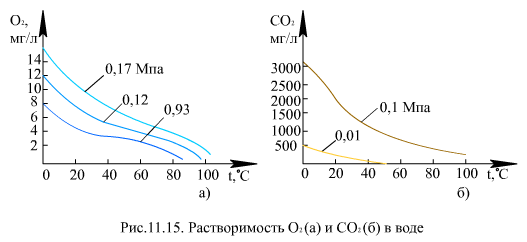
При 0 < αв<1 кривые для Kp расположены между этими лучами. Коэффициенты  и Км при ρ′/ρ″ = 10 (р = 12 МПа) отличаются на два порядка (в 100 раз). Растворимость в воде тазов Н2, Не, Ne, молекулы которых имеют небольшие размеры, весьма мала. Газы СО2 Cl, H2S, SO2 NH3, молекулы которых образуют водородные связи и химические соединения с молекулами воды, растворяются хорошо. В области низких и умеренных температур (рис. 11.15) растворимость газов уменьшается с ростом температуры, достигая минимального значения для легких газов (гелий, водород, неон) при 50°С, для кислорода - при 90…100°С, для оксида углерода СО2 - при 150°С, затем происходит увеличение растворимости. Для аммиака NH3 минимума растворимости нет. В диапазоне давлений (до 30…35 МПа), при которых работают энергетические блоки, растворимость газов пропорциональна давлению.
и Км при ρ′/ρ″ = 10 (р = 12 МПа) отличаются на два порядка (в 100 раз). Растворимость в воде тазов Н2, Не, Ne, молекулы которых имеют небольшие размеры, весьма мала. Газы СО2 Cl, H2S, SO2 NH3, молекулы которых образуют водородные связи и химические соединения с молекулами воды, растворяются хорошо. В области низких и умеренных температур (рис. 11.15) растворимость газов уменьшается с ростом температуры, достигая минимального значения для легких газов (гелий, водород, неон) при 50°С, для кислорода - при 90…100°С, для оксида углерода СО2 - при 150°С, затем происходит увеличение растворимости. Для аммиака NH3 минимума растворимости нет. В диапазоне давлений (до 30…35 МПа), при которых работают энергетические блоки, растворимость газов пропорциональна давлению.
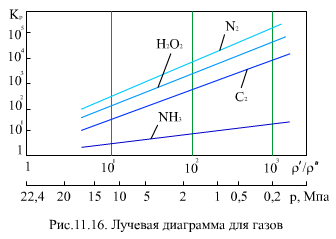
Коэффициент распределения летучих веществ между водой и паром больше 1 (рис. 11.16), т.е. при кипении воды летучие вещества переходят в пар. С одной стороны, на этом процессе основывается деаэрация воды, но, с другой стороны, это затрудняет поддержание в воде на необходимом уровне показателя рН, так как аммиак и летучие амины переходят в пар.
Для правильного выбора водно-химического режима парового котла и внутрибарабанных устройств необходимо знать не только Кp и ω, но и соотношение между ними.
На (рис. 11.17) показаны значения Кp для разных давлений в зависимости от силы электролита - показателя координатного числа n. Там же приведены обычные для барабанных котлов значения влажности пара ω = 0,02…0,05% (в долях ω = 0,0002…0,0005).
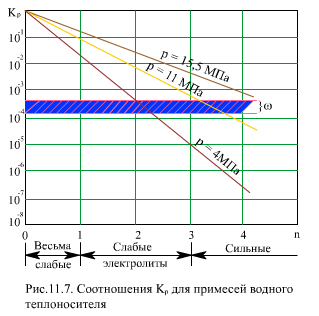
При низком давлении в барабане (р = 4 МПа) коэффициент распределения Кp выше влажности ω при n < 2 ((рис. 11.17), т.е. для весьма слабых и некоторых слабых электролитов. К ним относятся Fe3O4, А12O3, CuO, B2O3, SiO3. Продукты коррозии (Fe3O4, А12O3 и др.) имеют малую растворимость в воде, поэтому даже при высоком значении Kp концентрация их в паре мала.
Особое значение имеет кремнекислота H2SiO3 - в воде ее заметное количество, и в паре она хорошо растворяется. Сильные электролиты имеют Кp << ω, и их концентрация в воде особого влияния на качество пара не оказывает, если предусмотреть достаточную эффективность сепарации пара. По содержанию SiO2, в воде устанавливается предельно допустимое значение.
При среднем давлении (р = 11 МПа) весьма слабые и слабые электролиты (n < 3) имеют Кp > ω, причем для Fe3O4, А12O3 это превышение составляет примерно три порядка, для SiO2 - два порядка. Сильные электролиты имеют еще Кp < ω. Для этого давления становится актуальным для получения чистого пара снижение концентрации слабых электролитов в воде, улучшение сепарации и промывки пара.
При высоком давлении в барабане (р = 15,5 МПа) только очень сильные электролиты (n > 5) имеют коэффициент распределения Кр ниже, чем влажность пара ω, т.е. в насыщенный пар основное количество примесей поступает не с влажностью пара, а путем их растворения. Отсюда возникает задача обязательной промывки пара водой более чистой, чем котловая. Но при этом не следует принижать роль сепарации - в котловой воде часто содержатся не только растворенные примеси, но и взвеси, шлам с концентрацией Cввзв. Эта часть примеси уносится вместе с каплями воды.
11.5.Внутритрубные отложения примесей водного теплоносителя
Примеси водного теплоносителя могут быть в ионно-молекулярной форме, образуя раствор, или в виде частиц, составляя с теплоносителем дисперсную систему. Дисперсная система включает дисперсную фазу (частицы) и дисперсионную среду (теплоноситель).
Продукты коррозии в начале своего существования в водном теплоносителе находятся в ионно-молекулярной форме. В результате окисления и других реакций образуется твердая фаза в виде частиц оксидов, гидроксидов и других соединений. Дисперсные системы обладают избытком поверхностей энергии и термодинамически неустойчивы. Дисперсные частицы могут слипаться между собой, адсорбироваться на поверхности труб.
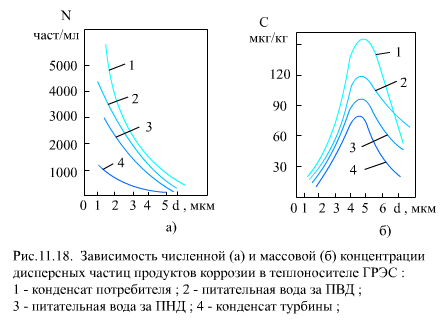
В водном теплоносителе основное количество (по числу частиц) продуктов коррозии состоит из частиц менее 2-3 мкм, но относительно небольшое число крупных частиц (до 10 мкм и более) имеют значительную массу, поэтому максимум по массовой концентрации С, мкг/кг, приходится на частицы с dr = 4ё5 мкм (рис. 11.18).
Поведение примесей водного теплоносителя, проходящего по обогреваемым и необогреваемым каналам (трубам) парового котла, характеризуется процессами: кристаллизация и растворение в потоке теплоносителя, в пристенном слое и на поверхности стенки, объединение частиц в агломераты и распад их, адсорбция на частичках и стенке, десорбция с частичек и стенок, химическое взаимодействие между веществами и т.д. Концентрация примесей изменяется по длине и сечению трубы.
Процесс кристаллизации состоит из двух стадий: образование центров кристаллизации (зародышей) и рост кристалла. Зародышами могут служить не только самопроизвольно образовавшиеся частицы самого кристаллизующегося вещества, но и любые другие частицы, способные адсорбировать на своей поверхности молекулы или ионы кристаллизующегося вещества. Такого типа зародыши всегда присутствуют на поверхности труб и в объеме водного теплоносителя. Поэтому первая стадия кристаллизации в реальных условиях не лимитирует скорость всего процесса.
Рост кристаллов определяется диффузией строительных частиц к поверхности кристалла и введением их в определенное место кристалла. Интенсивность доставки вещества к поверхности кристалла Jд, кг/(м2Чс), расчитывается по формуле
|
| (11.24) |
где d - толщина диффузионного слоя, м; S- поверхность кристаллов, м2; т - масса кристаллов, кг; D - коэффициент диффузии, м2/с; С, Сi - концентрация растворенного вещества вдали от кристалла и около его поверхности, кг/м3.
Процесс собственно кристаллизации вещества можно разделить на этапы: адсорбция частицы поверхностью, миграция ее вдоль поверхности, внедрение в кристаллическую решетку. Интенсивность этого процесса Jкр, кг/(м2Чс), обычно описывается уравнением химической реакции первой степени
|
| (11.25) |
где Кp - константа скорости реакции, м/с; С0 - растворимость вещества, кг/м3.
В стационарном режиме Jд = Jкр = J. При этом условии из (11.24) и (11.25) исключаем величину Сi, в результате получаем формулу для расчета скорости роста кристалла
|
| (11.26) |
где Ккр - коэффициент скорости кристаллизации, м/с,
|
| (11.27) |
При больших пересыщениях (С>>С0) скорость собственно кристаллизации высока и лимитирующей стадией становится диффузия вещества к поверхности кристалла. Доставка вещества к кристаллу ограничивает скорость его роста и при высоких температурах, так как с ростом температуры Кp увеличивается (для водных растворов солей и некоторых веществ органического происхождения диффузия контролирует рост кристаллов при температуре выше 45-50°С).
С уменьшением пересыщения возрастает роль процесса собственно кристаллизации.
Внутритрубные отложения различаются своей структурой и химическим составом.
Структура отложений и их количество зависят от определяющих при данных условиях процессов (механизмов) доставки примеси, осаждения и закрепления ее на поверхности трубы.
В общем случае отложения примесей разделяются на два слоя: верхний слой (наружный,эпитаксический) - рыхлый, слабо сцепленный с нижним слоем, легко снимается при механическом воздействии; состоит из хаотично расположенных кристаллов размером 1-6 мкм и из конгломератов округлых частиц размером в десятые доли микрона; поры пронизывают весь слой в разных направлениях; нижний слой (внутренний, топотактический) прочно сцеплен с поверхностью металла, состоит из сросшихся кристаллов размером 1-2 мкм, плотный с малым количеством пор.
Соотношение удельных количеств отложений в наружном gн и внутреннем gвн слоях зависит от их общего количества g (рис. 11.19). Линейный характер этой зависимости говорит о том, что продолжительность формирования отложений не влияет на закономерность распределения примеси между слоями.
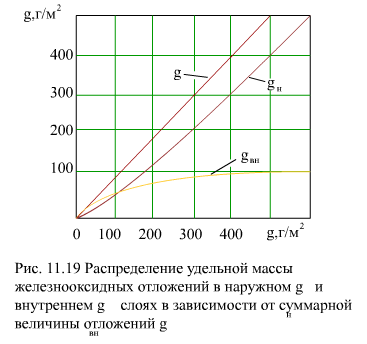
Зависимость толщин наружного dн и внутреннего dвн слоев от массы отложений также линейна, т.е. пористость и плотность слоев от массы отложений также линейна, т.е. пористость и плотность слоев остаются практически постоянными при увеличении массы отложений.
Средняя пористость слоев отложений П, %, определяется по плотности отложений rотл и собственно магнетита rмаг (rмаг = 5,18 г/см3)
|
| (11.28) |
Пористость наружного слоя Пн = 30ё50%, внутреннего слоя Пвн = 10ё30%, соответственно теплопроводность наружного слоя lотлн = 0,3ё1,5 Вт/(мЧК) меньше, чем внутреннего lотлн =0,85ё3,0 Вт/(мЧК).
Адгезионная прочность наружного (эпитаксического) слоя существенно ниже, чем внутреннего (топотаксического). Поэтому при различных изменениях скорости потока (при пуске и останове котла, переменных режимах и т.д.) происходит частичный смыв примеси с наружного слоя отложений. Поступившие при этом в водный теплоноситель частицы примеси разносятся по контуру блока и, если их не удаляют из цикла, образуют рыхлые отложения на поверхности труб.
Большое разнообразие состава примесей и условий их существования в пароводяном тракте котла приводит, соответственно, к различным по химическому составу и своим характеристикам отложениям. По химическому составу выделяют пять основных групп отложений.
1.Железооксидные отложения. При 100%-ной конденсатоочистке и подготовке питательной воды по схеме глубокого обессоливания около половины примесей питательной воды котлов СКД составляют продукты коррозии железа. В составе отложений оксидов железа более 90-95%. При докритическом давлении в барабанных и прямоточных котлах по мере увеличения давления и улучшения системы подготовки воды доля железооксидных отложений также растет.
Оксиды железа, поступающие в котловую воду, превращаются в магнетит Fe3O4, который и является основой железооксидных отложений. Другие формы оксидов (Fe2O3) образуют в основном шламовые осадки.
С ростом температуры растворимость магнетита снижается, значительная часть оксидов железа находится в дисперсном, а не истинно-растворенном состоянии. Поэтому отложения образуются не только за счет кристаллизации, но и за счет электрокинетических процессов. Дисперсные частицы несут электрический заряд (адсорбция ионов из теплоносителя, диссоциация собственных молекул), под воздействием электрофоретических сил осаждаются на поверхности нагрева и образуют отложения.
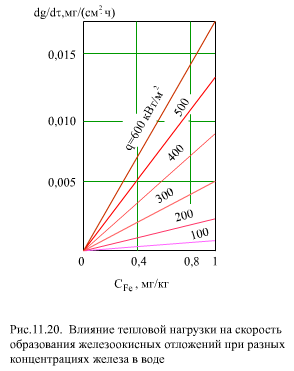
Скорость образования отложения А,мг/(см2Чч), зависит линейно от концентрации СFe, мг/кг, и от теплового потока q, Вт/м2, во второй степени
|
| (11.29) |
Зависимость А от СFe и q показана на (рис. 11.20)
2. Щелочноземельные отложения, состоящие из соединений кальция и магния. Соединения кальция и магния попадают в питательную воду с присосами в конденсаторе и с добавочной водой. В котловой воде обычно присутствуют различные соединения кальция: CaSiO3, CaSO4, CaCO3, CaCI2 и др. Интенсивное отложение соединений кальция (аналогично и магния) происходит при превышении концентрации Са2+ анионов произведения растворимости.
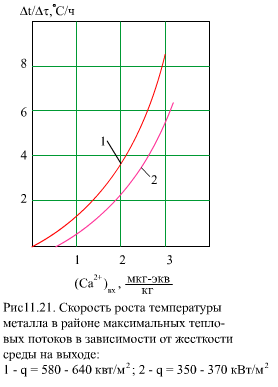
Скорость образования отложений Са и Mg от их концентрации не линейная (рис. 11.21), но для оценки можно использовать формулу
|
| (11.30) |
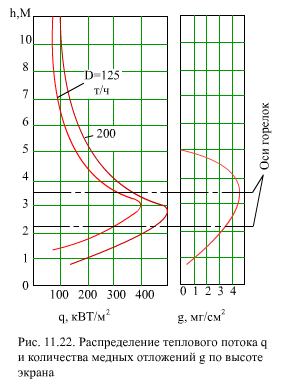
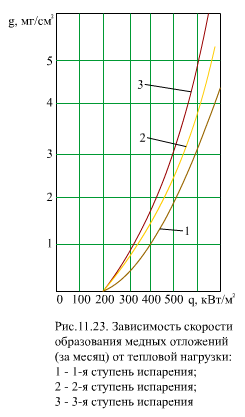
3.Отложения соединений меди. Оксиды меди в питательной воде появляются в результате коррозии латунных труб конденсатора, ПНД или деталей насоса, содержащих медь. При концентрации меди 2 мкг/кг происходит интенсивное отложение меди на участках с высокими тепловыми потоками или в местах глубокого упаривания воды (рис. 11.22). В отложениях присутствует главным образом чистая медь. Восстановление ионов меди до чистой меди присходит при контакте их с чистым железом. Процесс этот электрохимический, для его осуществления необходима достаточно высокая разность потенциалов. Поэтому медные отложения образуются в заметных количествах в зоне тепловых потоков выше порогового значения q0 (рис. 11.23). Скорость образования отложений меди описывается формулами
|
| (11.31) |
4. Алюминиевые отложения (алюмосиликатные, силикатные с преобладанием свободной SiO2). Реальная концентрация кремниевой кислоты меньше ее растворимости в питательной воде (изменяется от 10 мкг/кг SiO2 при непрерывной длительной эксплуатации до 100 мкг/кг при пуске). Однако крем-некислота всегда присутствует в отложениях при высоких давлениях. Возможно, кремниевая кислота способна вступать в различные реакции, например, с оксидами железа с образованием ферросиликатов.
5. Отложения легкорастворимых солей. В питательной воде паровых котлов могут присутствовать соединения натрия в виде NaOH, NaCl, Na2SO4, Na2SiO3. Эти соединения обладают большой растворимостью при высоких параметрах, но за счет адсорбции на поверхностях нагрева, за счет химического взаимодействия с отложениями соединения натрия присутствуют в составе отложившихся веществ.
Интенсивное отложение соединений натрия происходит при глубоком упаривании воды, сопровождающемся концентрированием примеси, в пристенном слое (при высоком тепловом потоке, малой скорости потока и т.п.) или в потоке теплоносителя в испарительных поверхностях. В этом случае концентрация растворенных веществ превышает их растворимость, и они кристаллизуются на поверхности трубы или в потоке теплоносителя.
11.6.Образование отложений примесей в пароводяном тракте прямоточного котла
Наибольшие сложности в работе котла вызывают отложения, образовавшиеся в зоне высоких тепловых потоков (топочная камера, область горелок) из-за значительного увеличения термического сопротивления теплопередачи и повышения температуры металла.
Характер распределения отложений по длине труб парового котла зависит от типа котла (барабанный или прямоточный), давления (ДКД или СКД), водно-химического режима и других факторов.
Особенности отложения примесей в прямоточных котлах СКД связаны с изменением характеристик массопереноса в зоне большой теплоемкости.
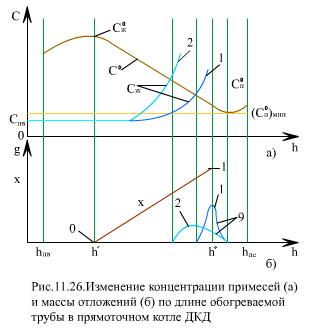
На (рис. 11.24) показано изменение скорости W, температуры t и концентрации примеси С по сечению трубы, а также изменения средней энтальпии потока hср, температуры ядра потока Тя и внутренней поверхности стенки Тст. В сечениях трубы Zя и Zст эти температуры равны температуре максимальной теплоемкости Тмт.
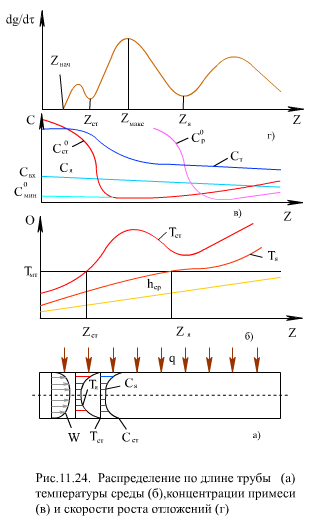
Растворимость веществ в ЗБТ уменьшается с ростом температуры. Характер изменения растворимости вещества в двух сечениях трубы (Cотл0, Cл0) по длине трубы показан на (рис. 11.24). Здесь же показано изменение концентрации примеси в ядре потока Ся (при Z = 0 Ся = Свх) и вблизи стенки Сст. С учетом адсорбции вещества на стенке принято Сст > Ся, где Cмин0 соответствует минимуму растворимости.
Для продуктов коррозии железа характерен второй случай, который и представлен на (рис. 11.24). В сечении Zнач, где Cстен ≥ Cстенo, на стенке трубы начинается процесс кристаллизации вещества (рис. 11.24). При увеличении концентрационного напора Cстен-Cстенo скорость роста отложении dg/dt возрастает. Здесь g - масса отложений. При приближении Тст к температуре максимальной теплоемкости Тмт (ЗБТ) скорость диффузии резко падает, и это приводит к торможению процесса кристаллизации, dg/dt снижается (рис. 11.24) сечение Zст). При этом в пристенном слое создается избыток примеси и может начаться кристаллизация в объеме слоя. Когда Тст > Тмт, кристаллизация на стенке ускоряется и dg/dt растет. Кристаллы из объема пристенного слоя частично осаждаются на эпитактическом слое отложений. Максимальная скорость отложений достигается в зоне сечения Zмакс, последующее снижение dg/dt вызвано достижением ЗБТ ядра потока (Тя →Tмт), когда массообменные процессы в ядре потока замедляются (скорость диффузии падает) и уменьшается доставка примеси из ядра в пристенный слой. Второй минимум dg/dt находится в области сечения Zя (Тя ≈ Тмт). При дальнейшем прогреве ядра потока массообменные процессы улучшаются, dg/dt снова растет, достигает третьего максимума. Последующее снижение скорости роста отложений связано с уменьшением концентрации в ядре потока Ся, на стенке Сст и концентрационного напора (Сст-Сстo).
Таким образом, при СКД зону отложения примесей в пароводяном тракте котла можно разделить на три участка: z < Zст (Тст < Тмт ); Zст<z < Zя(Тя < Тмт < Тст); Zя < z(Тя > Тмт)- в пределах каждого из участков скорость роста отложений достигает максимального значения (dg/dt)макс. Зависимость (dg/dt)макс от q, ρw и других параметров на разных участках различается.
Первый участок зоны отложений соответствует экономайзеру и началу нижней радиационной части топочной камеры, где тепловые потоки относительно невелики. Второй участок с максимальными отложениями расположен в середине и конце НРЧ, что соответствует зоне максимальных тепловых потоков. Такое неблагоприятное сочетание (максимум отложений - максимум тепловых потоков) может привести к большой скорости роста температуры металла трубы. Третий участок характеризуется снижением скорости роста отложений и расположен в зоне СРЧ, ВРЧ.
Особенностью отложения примеси в прямоточном котле докритического давления является упаривание воды в испарительных поверхностях нагрева и, соответственно, повышение концентрации примесей в жидкой фазе.
Запишем баланс примесей в пароводяной смеси
|
| (11.32) |
где Сп, Сж - концентрация примесей в жидкой и паровой фазах;
х - массовое паросодержание. Преобразуем формулу (11.32)
|
| (11.33) |
где Кp - коэффициент распределения примесей,
|
|
Из (11.33) определим относительное изменение концентрации примесей γж в жидкой фазе
|
| (11.34) |
Для паровой фазы
|
| (11.35) |
Для сильных электролитов Кp ≈ 0, тогда
|
| (11.36) |
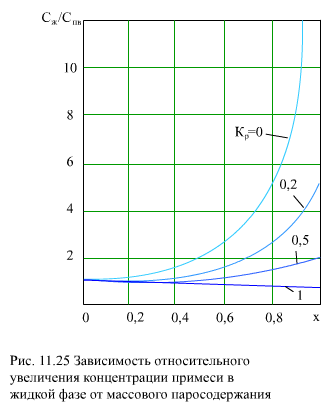
В этом случае при х → 1 концентрация Сж бесконечно растет (рис. 11.25).
Для слабых электролитов Kp составляет сотые и десятые доли, что существенно снижает концентрацию примесей в жидкой фазе и увеличивает в паровой (рис. 11.25).При Kp=1 gж = gп = 1, все примеси из воды, в принципе, могут перейти в пар. Это условие отвечает критическому давлению.
Из (рис. 11.25) видно, что при Кp = 0,2 концентрация примесей в жидкой фазе при х = 1 в 5 раз больше концентрации в питательной воде.
Растворимость примесей в пароводяной смеси уменьшается от растворимости в воде на линии насыщения Cжo до растворимости в паре Cжп :
|
| (11.37) |
На (рис. 11.26) показано изменение растворимости по длине обогреваемой трубы при концентрации примесей в питательной воде Сп.в, меньше, чем минимальная растворимость в паре (Cпп)мин. По мере испарения воды Сж увеличивается и в каком-то сечении Cж ≥ Cпвo , и начинается отложение примесей на стенке трубы. Отложение примесей будет происходить до сечения, где достигается Сж = Спво.
На (рис. 11.26) показаны две кривые для Сж. Для кривой 1 диапазон энтальпии рабочей среды, где происходит отложение примесей, узок (рис. 11.26). Для кривой 2 зона отложений шире, но максимальное их количество на единицу длины трубы меньше.
При малых тепловых нагрузках (паровые котлы малой мощности на низкое давление), когда кризис кипения происходит при больших значениях х, характер отложений аналогичен кривым 1 на (рис. 11.26). В этом случае имеет смысл зону интенсивных отложений (x > 0,75…0,8) вынести из топки в конвективную шахту, где тепловой поток ниже в несколько раз. Такую поверхность нагрева называют переходной зоной. В переходной зоне происходит доиспарение воды и частичный (на 20…30°С) перегрев пара.
В переходной зоне на единицу поверхности можно допустить отложений больше во столько раз, во сколько раз в ней меньше тепловой поток по сравнению с топочными экранами, при одинаковых марках стали и температуре металла труб.
При высоких тепловых потоках и высоком давлении среды диапазон отложений сильно расширяется и организовать переходную зону практически не удается.
На (рис. 11.27) показана зависимость скорости роста отложений продуктов коррозии dg/dt от массового паросодержания х для разных значений массовой скорости ρw. При ρw = 2960 кг/(м2∙с) отложение примесей начинается при х = 0,10…0,15. Отложения примесей в первую очередь зависят от упаривания и срыва микропленки на поверхности трубы, где происходит концентрирование примеси. Максимум отложений соответствует области кризиса теплообмена.
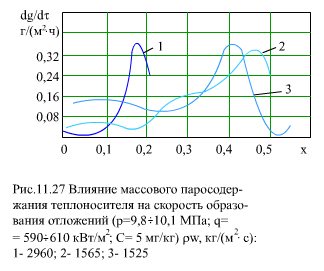
Экспериментальные данные показывают, что максимальная интенсивность отложений продуктов коррозии имеет место при массовой скорости пара (ρwx) < 500 кг/(м2 ∙с), поэтому необходимо иметь (ρwx) > 500 кг/(м2∙с).
11.7.Образование отложений примесей в пароводяном тракте барабанного котла
11.7.1.Удаление примесей с непрерывной продувкой воды из водяного тракта барабанного котла
Для того чтобы ограничить рост отложений, в барабанных котлах организуется непрерывная продувка- удаление из водяного тракта барабанного котла небольшого количества котловой воды Dпр с большей концентрацией примесей Спр.
На (рис. 11.29) показана принципиальная схема устройства продувки воды из барабана котла, в которую включены расширитель 6 и поверхностный теплообменник 9 для утилизации теплоты продувочной воды и, частично, для сокращения потерь воды путем подачи пара 7, образовавшегося в расширителе, в деаэратор.
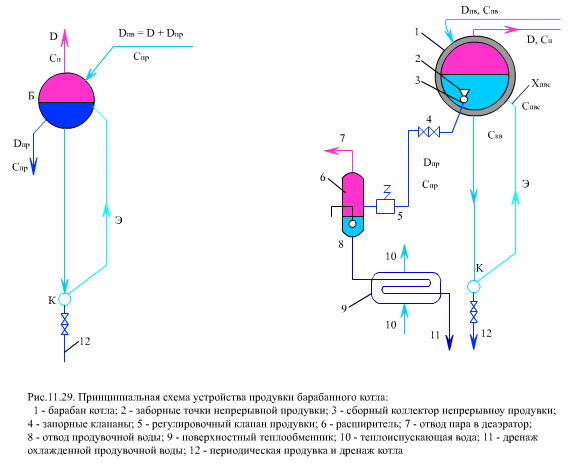
Составим баланс потоков воды и пара с указанием соответствующих концентраций. В барабан с питательной водой за 1 ч вносятся примеси в количестве Dп.в Сп.в, а уходят: с паром DСп, с продувочной водой DпрСпр. Часть примесей образует отложения в трубах Dп.в DСотл. С учетом этих потоков примесей составим солевой баланс барабана
11.7.2.Организация ступенчатого испарения в барабанном котле
Увеличение доли продувки приводит к уменьшению примесей в котловой воде Ск.в (11.42) и в насыщенном паре Сп (11.41), но увеличивает потери теплоты и воды с продувочной водой. Улучшить качество котловой воды и пара без увеличения продувки барабанного котла можно путем организации ступенчатого испарения.
Существуют различные способы организации ступенчатого испарения, в частности внутри барабана устанавливают перегородку (рис.11.31,а,б, рис.11.31,в,г)
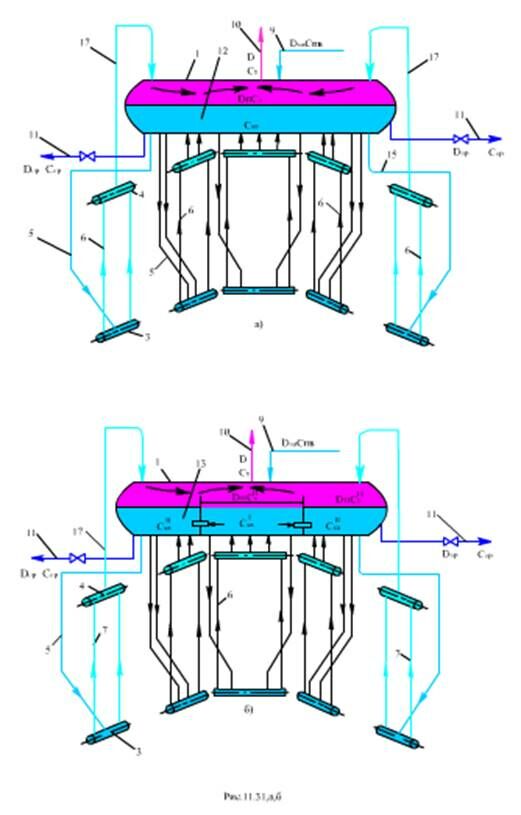
Питательная вода поступает в отсек 7, в который включены некоторые контуры циркуляции. Часть воды испаряется в них, при этом образуется пар в количестве DI (доля его nI = DI /D). Оставшаяся вода перетекает через отверстие в перегородке во второй отсек. В контурах циркуляции, включенных в этот отсек, вода испаряется с образованием пара DII (nII = DI1/D). Продувка котла производится из второго отсека, причем Ск.вI = Cк..вII
Определим Ск.вI и Ск.вII. Для первого отсека по (11.42)
|
| (11.44) |
где продувка первого отсека равна паропроизводительности второго отсека nII и продувке котла
|
| (11.45) |
Если принять при двухступенчатой схеме nII = 20%, nI = 80%, КвI = 0, р = 1%, то получим степень концентрации γI примеси в первом отсеке
|
| (11.46) |
Следовательно, в первом отсеке котловая вода стала чище примерно в 20 раз (101:4,8) по сравнению с одноступенчатой схемой.
Для второго отсека питательной водой является котловая вода первого отсека с концентрацией примесей Ск.вI
|
| (11.47) |
Отношение γII при КвII = 0 и р = 1 %
| В лекции "Баллады Жуковского" также много полезной информации.
| (11.48) |
По отношению к Сп.в
|
| (11.49) |
Концентрация примесей в котловой воде второй ступени значительно выше, чем в первой ступени (в 21 раз), и соответствует концентрации в одноступенчатой схеме. Поэтому первый отсек называют чистым, а второй отсек - солевым. Выигрыш ступенчатого испарения заключается в том, что 80% котловой воды и, следовательно, пара получаются значительно чище (в 20 раз при р = 1%, Кв = 0, nI = =80%), только 20% котловой воды и пара имеют такую же концентрацию.