Испускание и поглощение энергии атомами и молекулами
1.1 Испускание и поглощение энергии атомами и молекулами
Уровни энергии в атомах. Любой комбинации квантовых чисел п, l, ml соответствует определённый энергетический уровень. На рис. 3.6 представлена в качестве примера система энергетических уровней атома водорода. Поглощение и испускание энергии атомом связано с переходом электрона между энергетическими уровнями. Такие переходы называются чисто электронными переходами. В случае многоэлектронных атомов и молекул следует говорить об энергетических уровнях атома или молекулы, а не об уровнях отдельных электронов, так как энергию поглощают или испускают атом или молекула в целом. Если все электроны в атоме находятся на своих основных уровнях, то атом находится в основном состоянии. Если один из электронов находится на более высоком энергетическом уровне, то атом находится в возбуждённом состоянии.
В многоэлектронных атомах испускание света связано с переходами валентных электронов. Переходы более близких к ядру электронов приводят к возникновению рентгеновского излучения. Длина волны излучения может быть определена по формуле:  где Wк и Wi – энергии соответствующих уровней. Так как система энергетических уровней у атомов каждого элемента своя, спектр атомов имеет линейчатый характер и является характерным для данного элемента.
где Wк и Wi – энергии соответствующих уровней. Так как система энергетических уровней у атомов каждого элемента своя, спектр атомов имеет линейчатый характер и является характерным для данного элемента.

Рис. 1.6. Энергетические уровни атома водорода
Однако детальное изучение линейчатых спектров различных элементов показало, что в ряде случаев линия не является единичной, а состоит из нескольких близко расположенных компонент. Например, характерная для натрия жёлтая линия на самом деле состоит из двух близких линий с длинами волн 589 нм и 589,6 нм. Сложные линии называются мультиплетами. Число компонентов в мультиплете может быть равно двум (дублеты как у натрия), трем (триплеты), четырем (квартеты) и т. п. Расщепление спектральных линий на мультиплеты обусловлено, очевидно, расщеплением энергетических уровней. Система энергетических уровней, представленная на рис. 1.6, получена на основании решения уравнения Шредингера без учёта спина электрона. Само понятие спина и было введено для объяснения расщепления энергетических уровней.
Для многоэлектронных атомов энергетические уровни можно классифицировать в зависимости от суммарного спина атома. В атомах с чётным числом электронов при антипараллельной ориентации электронных спинов суммарный спин s = 0. Примером может служить основное состояние атома Не. Такому состоянию атома соответствует вполне определённое значение энергии. Подобный энергетический уровень называется синглетным. Его мультиплетность равна единице.
Если в атоме имеется один неспаренный электрон, то суммарный спин атома может принимать одно значение  Проекция спина принимает два значения – ms = ±1/2. При них энергия атома будет немного различаться, а это означает, что соответствующий энергетический уровень расщепляется на два близких подуровня. Такой уровень называется дублетным. В спектре ему соответствуют две близкие линии. Дублетные уровни характерны для всех щелочных металлов.
Проекция спина принимает два значения – ms = ±1/2. При них энергия атома будет немного различаться, а это означает, что соответствующий энергетический уровень расщепляется на два близких подуровня. Такой уровень называется дублетным. В спектре ему соответствуют две близкие линии. Дублетные уровни характерны для всех щелочных металлов.
При наличии в атоме двух неспаренных электронов суммарный спин может принимать два значения: s1 = 0 (спины антипараллельны, синглетное состояние) и s2 = 1 (спины параллельны, триплетное состояние). В первом случае ms = 0, во втором – ms = 0, +1, -1, то есть проекция полного спина принимает три значения. Триплетному состоянию в спектре соответствуют три близкие линии. Мультиплетность спектральных линий, связанная со спином, называется тонкой структурой спектра.
Правила отбора, метастабильные уровни. Система энергетических уровней атома является достаточно сложной и предполагает большое число различных переходов. Однако далеко не все переходы возможны. Существуют специальные правила отбора, которые определяют, какие квантовые переходы являются разрешёнными (вероятность перехода велика), а какие запрещены. Запрет может быть строгим (вероятность перехода равна нулю) и приближённым (вероятность перехода мала, но отлична от нуля). Правила отбора определяют возможные изменения квантовых чисел при переходе, поскольку состояния атома характеризуются с помощью этих чисел. Так, при испускании или поглощении кванта света возможен только такой переход электрона с одного уровня на другой, при котором орбитальное квантовое число изменяется на единицу: Dl = ±1. Стало быть, электрон не может перейти с уровня s (l = 0) на уровень d (l = 2), а может перейти на уровень р (l = 1). Это правило отбора является следствием закона сохранения момента импульса. Дело в том, что фотон имеет собственный момент импульса (спин), равный единице. При испускании фотон уносит из атома этот момент, а при поглощении его привносит.
Рекомендуемые материалы
Другое правило отбора связано с изменением мультиплетности состояния. Разрешёнными являются переходы, при которых общий спин атома не изменяется: Ds = 0. В соответствии с этим правилом переход из синглетного состояния в триплетное (или наоборот) является запрещённым. Однако этот запрет не является строгим, просто вероятность такого перехода очень мала. Уровень, переход с которого на более низкие уровни имеет малую вероятность (запрещён), называется метастабильным. Вследствие малой вероятности перехода в основное состояние атомы могут находиться в метастабильном состоянии значительно дольше, чем в любом другом возбуждённом состоянии.
Уровни энергии в молекулах. Схема уровней энергии молекул является гораздо более сложной, чем у атомов. Это связано с тем, что в молекулах возможны помимо движения электронов также колебательное и вращательное движения. При колебательном движении периодически изменяется относительное расположение ядер в молекуле. При вращательном движении изменяется положение в пространстве всей молекулы целиком. Полная энергия молекулы складывается из трех частей:
W = Wэл+ Wкол+ Wвр. (1.23)
Вклад каждого вида движения в полную энергию молекулы является существенно различным: Wэл >> Wкол >> Wвр. Энергия колебательного движения частицы также квантуется, поэтому колебательная энергия молекул принимает только дискретные значения, характеризуемые квантовым числом υ.
В квантовой механике показано, что и энергия вращающейся микросистемы (ротатора) квантуется. Следовательно, вращательная энергия молекулы тоже принимает дискретные значения, определяемые квантовым числом j. При поглощении молекулой энергии могут изменяться все виды энергии. Поэтому полное изменение энергии молекулы равно:
DW = DWэл+ DWкол+ DWвр, (1.24)
причём DWэл >> DWкол >> DWвр.
Система энергетических уровней молекулы представляет собой совокупность далеко отстоящих друг от друга электронных уровней энергии. Каждому электронному уровню соответствует набор более близко расположенных колебательных уровней (рис. 1.7, а), а каждому колебательному уровню соответствует совокупность ещё более тесно расположенных вращательных уровней (рис. 1.7, б). Такая система энергетических уровней определяет значительно более сложный характер молекулярных спектров по сравнению с атомными. Изменение Wэл (электронный переход) связано с поглощением или испусканием кванта в видимой или ультрафиолетовой области. Но наряду с Wэл при этом процессе могут измениться Wкол и Wвр. Поэтому данному электронному переходу в спектре соответствует не одна линия, а ряд близко расположенных линий, образующих полосу. В случае простых молекул при исследовании спектра при помощи приборов с большей разрешающей способностью видны линии, составляющие полосу. В спектре сложных молекул обычно наблюдается одна или несколько довольно широких сплошных полос. Такие спектры называются электронно-колебательно-вращательными. Они, как правило, характеризуют молекулу в целом и служат для идентификации веществ.
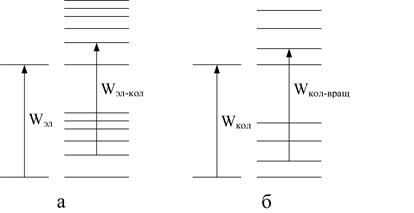
Рис. 1.7. Энергетические уровни молекул: а – электронные и колебательные уровни; б – колебательные и вращательные уровни.
При поглощении молекулой небольшой порции энергии не изменяется Wэл, тогда как колебательная и вращательная энергии могут возрасти. При поглощении энергии в дальней инфракрасной области (l = 0,1 – 1 мм) изменяется только вращательная энергия молекул, и имеет место чисто вращательный спектр. Колебательным переходам соответствует поглощение в ближней и средней инфракрасной области (l = 1 – 100 мкм). При данном DWкол в спектре получается полоса, состоящая из близко расположенных вращательных линий – колебательно-вращательный спектр. Эти спектры широко применяются для изучения структуры сложных молекул. Многие группы, входящие в сложные молекулы (гидроксильная, карбонильная и карбоксильная группы, водородная связь и др.), характеризуются вполне определёнными частотами колебательных переходов. Наличие в инфракрасном спектре поглощения полос, соответствующих этим частотам, говорит о присутствии в молекуле определённых групп.
В молекуле, как и в атоме, различные переходы имеют разную вероятность, и существуют определённые правила отбора. Электронные состояния молекулы, как и атома, могут быть классифицированы в зависимости от суммарного спина молекулы. Два электрона, соответствующие одной молекулярной орбитали, имеют антипараллельные спины. При переходе одного из этих электронов с основного энергетического уровня на более высокий антипараллельная ориентация спинов обычно сохраняется. Такое возбуждённое состояние называется синглетным, а переход – синглет-синглетным переходом. Однако возможны случаи, когда электрон при переходе изменяет первоначальную ориентацию спина на противоположную. В результате на высшем энергетическом уровне появляется электрон, не спаренный с оставшимся на основном уровне. Такое возбуждённое состояние называется триплетным. Непосредственный переход из основного состояния в триплетное запрещён, но возможен процесс, изображенный на рис. 1.8: электрон из основного состояния переходит в первое возбуждённое синглетное состояние. Находясь в возбуждённом состоянии, молекула взаимодействует с соседними молекулами и безызлучательно теряет часть своей энергии; в результате этого взаимодействия электрон оказывается на триплетном уровне Т, который является метастабильным, так как переход между триплетным и синглетным состояниями запрещён. Молекула может находиться в таком состоянии довольно долго, но поскольку запрет является не строгим, электрон способен в конце концов перейти с уровня Т на основной уровень.
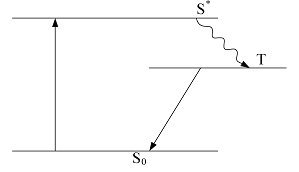
Рис. 1.8. Синглетные (S) и триплетные уровни (T) в молекуле и схема переходов между ними
У свободных радикалов, имеющих один неспаренный электрон, суммарный спин равен  и для них характерны дублетные состояния. Следует отметить, что молекулы, находящиеся в триплетном состоянии, имеют два неспаренных электрона и могут рассматриваться как бирадикалы. Молекулы в дублетном и триплетном состояниях обладают повышенной химической активностью.
и для них характерны дублетные состояния. Следует отметить, что молекулы, находящиеся в триплетном состоянии, имеют два неспаренных электрона и могут рассматриваться как бирадикалы. Молекулы в дублетном и триплетном состояниях обладают повышенной химической активностью.
Время жизни возбуждённого состояния. Если вещество подвергается воздействию определённой энергии, то часть его атомов или молекул перейдет в возбуждённое состояние или, иначе говоря, увеличится заселённость высших энергетических уровней. Затем число возбуждённых атомов или молекул будет постепенно самопроизвольно (спонтанно) уменьшаться. Число атомов dNki, перешедших за время dt из состояния k в состояние i, пропорционально заселённости уровня k (Nk) и может быть выражено формулой:
- dNki = AkiNkdt, (1.25)
где Aki – коэффициент Эйнштейна для спонтанного излучения. Он определяет вероятность того, что атом в течение 1 с самопроизвольно перейдёт из состояния k в состояние i. Запишем формулу (1.25) в следующем виде:
 (1.26)
(1.26)
Проинтегрировав это выражение, получим формулу:
 (1.27)
(1.27)
Обратите внимание на лекцию "2.1 Особенности русской культуры нового времени".
которая позволяет определить, сколько атомов или молекул осталось в возбуждённом состоянии по прошествии времени t.
Вместо коэффициента Aki часто пользуются величиной t, которая носит название среднего времени жизни возбуждённого состояния. Величины t и Aki связаны соотношением:
 (1.28)
(1.28)
Введя величину t, можно формулу (1.27) записать следующим образом:
 (1.29)
(1.29)
Из формулы (1.29) становится ясным физический смысл t. Очевидно, это время, в течение которого количество возбуждённых атомов или молекул за счёт спонтанного излучения уменьшается в е раз. Для разрешённых переходов среднее время жизни возбуждённого состояния составляет порядка 10-8 – 10-9 с. В метастабильном состоянии атом или молекула могут находиться значительно дольше, так как переход из метастабильного состояния в основное имеет малую вероятность. Поэтому в веществах, атомы или молекулы которых имеют метастабильные уровни, электроны задерживаются на этих уровнях, и в веществе создается повышенная (инверсная) заселённость высших энергетических уровней.




















