Методы расстановки коэффициентов в окислительно-восстановительных реакциях
6.3. Методы расстановки коэффициентов в окислительно-восстановительных реакциях
Существуют два метода расстановки коэффициентов в окислительно-восстановительных реакциях:
1) метод электронного баланса (МЭБ);
2) метод полуреакций.
В данном пособии будет рассмотрен только метод электронного баланса, при котором учитываются:
а) сумма электронов, отдаваемых всеми восстановителями, которая равна сумме электронов, принимаемых всеми окислителями;
б) одинаковое число одноименных атомов в левой и правой частях уравнения;
в) число молекул воды (в кислой среде) или ионов гидроксида (в щелочной среде), если в реакции участвуют атомы кислорода.
Составление уравнений ОВР легче провести в несколько стадий:
Рекомендуемые материалы
1) установление формул исходных веществ и продуктов реакции;
2) определение степени окисления элементов в исходных веществах и продуктах реакции;
3) определение числа электронов, отдаваемых восстановителем и принимаемых окислителем, и коэффициентов при восстановителях и окислителях;
4) определение коэффициентов при всех исходных веществах и продуктах реакции исходя из баланса атомов в левой и правой частях уравнения.
Пример 1
1. Записываем уравнение реакции:
К2Сг2O7 + K2SO3 + H2SO4 ® Cr2(SO4)3 + K2SO4 + Н2О.
2. Определяем элементы, изменяющие свою степень окисления в процессе реакции:
К2Сг2 +6О7 + K2S+4O3 + H2SO4 ® Cr2+3(SO4)3 + К2S+6O4 + Н2О и условно записываем процессы окисления н восстановления элементов в их соединениях:
окислитель Cr+6 ® Сг+3 - процесс восстановления;
восстановитель S+4 ® S+6 - процесс окисления.
3. Затем составляем электронный баланс. Для этого подсчитываем
число электронов, которое нужно присоединить всеми атомами окислителя, входящими в состав молекулы-окислителя, и прибавляем их число в левой части схемы процесса восстановлении. В данном приме
ре хром из степени окисления +6 переходит в степень окислении +3, поэтому нужно прибавить 3 электрона. Однако в молекуле окислителя К2Сr2O7 содержатся два атома хрома, тогда и в соответствующей схеме указываются эти два атома хрома слева и справа и увеличивается в 2 раза число присоединяемых электронов. Аналогично поступаем и с восстановителем, только теперь в левой части схемы отнимаем электроны. В результате имеем:
2Сr+6 +Зе×2 ® 2Сr +3;
S+4-2e ® S+6.
Электронный баланс достигается тогда, когда числа электронов в каждой из этих схем, взятых целое число раз, равны друг другу. Для этого находим наименьшее общее кратное для числа отданных и принятых электронов - это 6. Видно, что молекула окислителя присоединяет в 3 раза больше электронов, чем молекула восстановителя их отдает. Поэтому, чтобы соблюдался электронный баланс, второй процесс - окисление восстановителя - должен осуществляться в три раза чаше, чем первый. Это отражается коэффициентами справа от записанных схем:
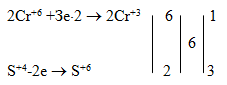
4. Полученные коэффициенты ставим перед окислителем и вос
становителем в левой части уравнения (коэффициент 1 не пишется):
К2Сr2O7 + 3K2SO3 + H2SO4 ® Cr2(SO4)3 + K2SO4 + H2O.
5. Далее, сначала уравниваем ионы металла, не изменяющие своей
степени окисления, а участвующие лишь в связывании анионов среды.
В данном примере такими ионами являются ионы К+, входившие в со
став бихромата калия:
К2Сr2O7 + 3K2SO3 + H2SO4 ® Cr2(SO4)3 + 4K2SO4 + Н2О.
6. Определяем коэффициент перед средой. Средой является серная кислота, которая поставляет сульфатные группы SO42- для связывания катионов в виде солей. В правой части уравнения видно, что в составе солей находится семь сульфатных групп, причем три из них получили в результате окисления сульфита калия. Значит, на солеобразование потребовались оставшиеся четыре сульфатные группы. Поэтому перед формулой серной кислоты в уравнении реакции ставим коэффициент 4:
К2Сr2O7 + 3K2SO3 + 4H2SO4 ® Cr2(SO4)3 + 4K2SO4 + H2O.
7. Уравниваем число атомов водорода подбором коэффициентов в правой части уравнения перед водой (коэффициент равен 4):
К2Сr2O7 + 3K2SO3 + 4H2SO4 ® Cr2(SO4)3 + 4K2SO4 + 4H2O.
8. Проверяем правильность подбора коэффициентов подсчетом числа атомов кислорода слева и справа в уравнении реакции:
7 + 9+16=12+16 + 4; 32 = 32.
Равенство имеется, значит, в уравнении реакции стрелку ® можно заменить знаком равенства. Уравнение реакции составлено:
К2Сr2O7 + 3K2SO3 + 4H2SO4 = Cr2(SO4)3 + 4K2SO4 + 4H2O.
Пример 2
1. Записываем схему реакции без коэффициентов
KMnO4 + FeSO4 + H2SO4 ® MnSO4 + Fe2(SO4)3 + K2SO4 + H2O.
2. Определяем степени окисления элементов
KMn+7O4 + Fe +2SO4 + H2SO4 ® Mn +2SO4 + Fe2+3(SO4)3 + K2SO4 + H2O.
Как видно, степень окисления меняется только у марганца и железа, у первого она понижается (восстановление), у второго - повышается (окисление).
3. Определяем число электронов, отдаваемых восстановителем FeSO4 и принимаемых окислителем КМnО4:
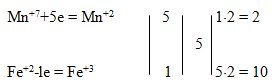
По уравнению реакции число атомов железа до и после реакции нечетное, для того чтобы их привести к кратным четным значениям, коэффициенты удваиваются:
2KMnO4 + 10FeSO4 + H2SO4 ® MnSO4 + Fe2(SO4)3 + K2SO4 + H2O.
4. Последовательность расстановки коэффициентов в дальнейшем следующая:
- уравниваем число атомов, изменивших степень окисления;
- уравниваем количество атомов щелочных металлов до и после реакции;
- подсчитываем число атомов серы после и до реакции, разность между этими значениями - коэффициент перед серной кислотой равен 8;
-последними уравниваем атомы водорода: подсчитываем число атомов водорода после и до реакции; коэффициент перед водой равен 8:
2KMnO4 + 10FeSO4 + 8H2SO4 ® 2MnSO4 + 5Fe2(SO4)3 + K2SO4 + 8H2O.
5. Проверяем правильность подбора коэффициентов подсчетом числа атомов кислорода слева и справа в уравнении реакции:
2KMnO4 + 10FeSO4 + 8H2SO4 ® 2MnSO4 + 5Fe2(SO4)3 + K2SO4 + 8H2O.
Число атомов кислорода в левой и правой частях уравнения одинаково, поэтому данное уравнение является окончательным:
2KMnO4 + l0FeSO4 + 8H2SO4 = 2MnSO4 + 5Fe2(SO4)3 + K2SO4 + 8H2O.
Люди также интересуются этой лекцией: Быстро развивающиеся страны мировой политики.
Пример 3
Fe+2S2-1 + O20 ® Fe2+3O3-2 + S+4O2-2.
В таких случаях, если больше чем два элемента изменяют степень окисления, определяем суммарное число электронов отданных или присоединенных элементами:
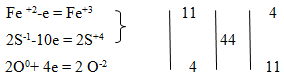
Конечное уравнение этой реакции:
4FeS2 + 11O2 = 2Fe2O3 + 8SO2.






















