Краткие сведения из равновесной термодинамики. Понятие о рабочем теле
Лекция 1.
Краткие сведения из равновесной термодинамики. Понятие о рабочем теле.
Рабочим телом термодинамической системы называют макроскопическое тело, обычно газ или жидкость реже парожидкостную среду, которая выделяется с помощью контрольной поверхности, и находится во взаимодействии со внешней средой.
Контрольная поверхность – условное понятие, она может геометрически совпадать со стенками некоторого технического устройства, но это не обязательно. Контрольная поверхность может быть подвижной или неподвижной, может допускать теплообмен с окружающей средой, а может быть адиабатической, может обмениваться с окружающей средой (открытая термодинамическая система), а может не обмениваться (закрытая система).
Состояние рабочего тела определяется совокупностью ряда параметров, которые делят на экстенсивные и интенсивные.
Если параметр зависит от количества вещества, то он – экстенсивный, наоборот – интенсивный.
Экстенсивные: W- объем; m; U – внутренняя энергия.
Интенсивные: p; w – удельный объем; T; u – удельная внутренняя энергия.
Рекомендуемые материалы
Различают термические и калорические параметры тела.
К термическим относятся: давление (p), объем, T; к калорическим – S (энтропия), U, I (интальпия).
Если параметр отнесен к единице массы, то он называется удельным (u – удельная внутренняя энергия, s – удельная энтропия, i – удельная интальпия).
Если при изоляции термодинамической системы, от воздействий внешней среды параметры ее состояния не меняются, то такое состояние является равновесным.
Если внутри контрольной поверхности химический состав и физические свойства системы повсюду одинаковы, то такая система называется однородной (гомогенной), если наоборот, то гетерогенной.
Уравнения состояний.
Если однородное рабочее тело находится в равновесном состоянии, то его параметры  - связаны термическим уравнением состояния
- связаны термическим уравнением состояния
 (1.1)
(1.1)
В пространстве  уравнение (1.1) воспроизводит некоторую поверхность, которую называют термодинамической поверхностью состояния.
уравнение (1.1) воспроизводит некоторую поверхность, которую называют термодинамической поверхностью состояния.
В рамках термодинамического подхода найти аналитическое выражение для зависимости (1.1) не представляется возможным.
Уравнение состояния может быть получено на основе экспериментальных данных или устанавливается теоретически на основе кинетической теории газов.
Практически используемые аналитические выражения для уравнения состояния воспроизводят выражение (1.1) с той или иной точностью, в ом или ином диапазоне параметров  .
.
Если объем молекул пренебрежимо мал по сравнению с объемом, занимаемым газом, а силы возникающие между молекулами также пренебрежимо малы, то в качестве уравнения состояния используют:
 (1.2)
(1.2)
 (1.3)
(1.3)
где:
 - универсальная газовая постоянная
- универсальная газовая постоянная
 - газовая постоянная
- газовая постоянная
 - молекулярная масса
- молекулярная масса
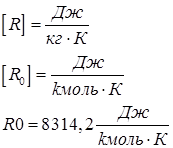
Уравнение (1.2) называется уравнением Клайперона.
Газ, который подчиняется (1.2) называют идеальным.
Физический смысл газовой постоянной это работа, совершаемая 1 кг идеального газа при нагревании его на 10 при изобарическом процессе. Эта величина считается константой, которая не зависит от давления и температуры.
Допущение об идеальности газа широко используется при решении инженерных задач, в большинстве случаев оно не ведет к значительным числовым ошибкам, а решение получается достаточно простым.
На практике часто рабочим телом является не одноатомный газ, а смесь газов. Смесь идеальных газов ведет себя в целом как идеальный газ и подчиняется уравнению состояния Клайперона.
При определении значения газовой постоянной по (1.3) под величиной  для смеси газов понимают условную величину
для смеси газов понимают условную величину  , которая относится к такому однородному газу, у которого число молекул и их масса в физическом объеме равна числу молекул и массе смеси газов.
, которая относится к такому однородному газу, у которого число молекул и их масса в физическом объеме равна числу молекул и массе смеси газов.
Концентрация компонентов смеси газов может быть задана массовыми долями или объемными долями.
 - массовая доля.
- массовая доля.
 - масса iго компонента
- масса iго компонента
 - масса смеси
- масса смеси
 - объемная доля
- объемная доля
 - объем, который занимает iый компонент при тех давлении и температуре, которые имеет смесь.
- объем, который занимает iый компонент при тех давлении и температуре, которые имеет смесь.
 (1.4)
(1.4)
 (1.4.а)
(1.4.а)
Состав смеси газов может быть задан массовыми или объемными долями компонент, при решении различных задач может оказаться удобен тот или иной способ; если известны массовые доли, то могут быль определены и объемные доли. Задача легко решается если компоненты являются идеальными газами. Покажем это.
Задача.
Пусть рабочее тело – смесь 2х газов с молекулярными массами  и
и 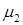 массовые доли компонент смеси соответственно
массовые доли компонент смеси соответственно  и
и  . Найдем их объемные доли.
. Найдем их объемные доли.
Дано
 ,
, 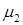
 ,
,  .
.
Найти:
 ,
,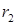
Решение:
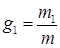
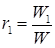
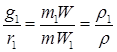
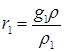
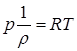
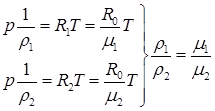
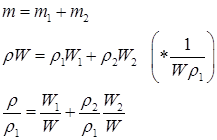
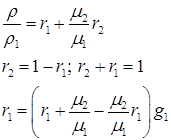
 (а)
(а)
 (б)
(б)
При высокой плотности рабочего тела его свойства могут существенно отличаться от свойств идеального газа поэтому для некоторого класса технических устройств задачи проектирования должны решаться с учетом реальных физических свойств рабочего тела.
Известно довольно большое число аналитических зависимостей для воспроизведения взаимосвязи  . Наиболее точное уравнение состояния это уравнение состояния с вариационными коэффициентами.
. Наиболее точное уравнение состояния это уравнение состояния с вариационными коэффициентами.
 (1.5)
(1.5)
Все вариационные коэффициенты B2, B3 и т.д. являются функциями температуры.
Из всех уравнений состояний реального газа наиболее употребимы в инженерной практике уравнения состояния Ван-Дер Вальса, Дюпре-Абеля, Редлиха-Квонга.
 (1.6) – уравнение Ван-Дер Вальса
(1.6) – уравнение Ван-Дер Вальса
 - объем занимаемый самими молекулами
- объем занимаемый самими молекулами
Уравнение (1.6) отличается от уравнения Клайперона 2мя поправками: объемной ( ), учитывающей собственный объем молекул, и поправкой на так называемое внутреннее давление.
), учитывающей собственный объем молекул, и поправкой на так называемое внутреннее давление.
Если учитывать лишь влияние собственного объема молекул, то полагая  из (1.6) получим:
из (1.6) получим:
 (1.7) – уравнение состояния Дюпре-Абеля
(1.7) – уравнение состояния Дюпре-Абеля
 (1.8) уравнение состояния Редлиха-Квонга
(1.8) уравнение состояния Редлиха-Квонга
Константы, входящие в уравнения состояния (1.6), (1.7) и (1.8) могут быть рассчитаны если известны значения параметров газа в критическом состоянии.
Для уравнения (1.6) Ван-Дер Вальса:
 (1.9)
(1.9)
Более сложно определяются величины  и
и  для смеси газов; один из методов их определения основан на понятии псевдокритических параметров смеси.
для смеси газов; один из методов их определения основан на понятии псевдокритических параметров смеси.
Приведем таблицу со значением критических параметров некоторых газов, а так же псевдокритических параметров для воздуха.
| параметры | N2 | He | воздух |
| pкр, Мпа | 3,400 | 0,2275 | 3,766 |
| Tкр, К | 126,2 | 5,190 | 132,5 |
|
| Если Вам понравилась эта лекция, то понравится и эта - Чацкий как комическое и трагическое лицо. 3,194 | 14,36 | 3,160 |
Уравнение (1.7) обычно используется при решении задач внутренней баллистики
 - для продуктов сгорания дымного пороха.
- для продуктов сгорания дымного пороха.
 - для продуктов сгорания пероксимнового пороха.
- для продуктов сгорания пероксимнового пороха.



 , м3/кг
, м3/кг
















