Термодинамические политропные процессы
ГЛАВА 12. ТЕРМОДИНАМИЧЕСКИЕ ПОЛИТРОПНЫЕ ПРОЦЕССЫ С ИДЕАЛЬНЫМИ ГАЗАМИ
12.1. Вывод уравнения политропного процесса в р-v координатах
Политропные процессы – это равновесные, обратимые процессы, которые протекают при постоянной теплоемкости c=const. Многие реальные процессы могут быть приближенно описаны уравнениями для политропных процессов.
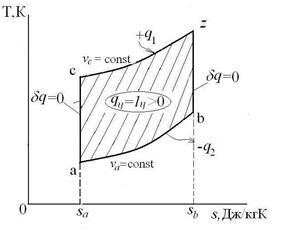
Каждый политропный термодинамический процесс (ТП) имеет вполне определенный, присущий ему характер распределения энергетических составляющих, входящих в уравнение первого закона термодинамики:  , Дж/кг. Это распределение энергетических составляющих будем интерпретировать графически. Например, для процесса V=const имеем:
, Дж/кг. Это распределение энергетических составляющих будем интерпретировать графически. Например, для процесса V=const имеем:
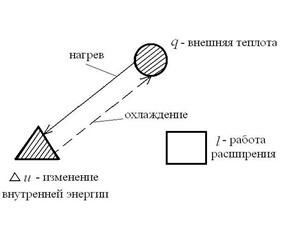
Штриховка на рисунке означает изменение данной энергетической составляющей, а стрелка – направление ее изменения.
Политропный процесс – это процесс изменения состояния рабочего тела, в котором во внутреннюю энергию в течение всего процесса превращается одна и та же доля количества внешней теплоты:
 , Дж/кг, где
, Дж/кг, где  .
.
Рекомендуемые материалы
При этом на совершение внешней механической работы приходится доля теплоты, равная:
 , Дж/кг,
, Дж/кг,
где  - коэффициент распределения теплоты в политропном процессе.
- коэффициент распределения теплоты в политропном процессе.
Теплота, сообщенная газу в бесконечно малом политропном процессе, равна:
 , Дж/кг
, Дж/кг
или для конечного процесса 1-2:  .
.
Таким образом, получим теплоемкость политропного процесса:  , Дж/кгК.
, Дж/кгК.
Зная значение коэффициента  в политропном процессе, можно определить теплоемкость c, теплоту q, изменение внутренней энергии
в политропном процессе, можно определить теплоемкость c, теплоту q, изменение внутренней энергии  и работу расширения (сжатия) l.
и работу расширения (сжатия) l.
Для вывода уравнения политропного процесса в p-v координатах используем уравнения первого закона термодинамики, выраженные через энтальпию и внутреннюю энергию:
 , (1)
, (1)
 , (2)
, (2)
или
 , (3)
, (3)
 . (4)
. (4)
Отсюда имеем:
 , (5)
, (5)
 . (6)
. (6)
Разделив почленно уравнение (5) на уравнение (6), имеем:
 , (7)
, (7)
где  - показатель политропного процесса, который не изменяется в течение всего данного ТП. Из уравнения (7) имеем:
- показатель политропного процесса, который не изменяется в течение всего данного ТП. Из уравнения (7) имеем:
 .
.
Тогда после интегрирования для конечного участка процесса 1-2 получим:
 , или после потенцирования:
, или после потенцирования:
 , или
, или  . (8)
. (8)
Это уравнение политропного процесса в координатах p-v. Показатель политропного процесса может иметь любое значение в интервале  .
.
Из выражения (7)можно получить формулу для расчета теплоемкости политропного процесса
 , или
, или  . Отсюда имеем
. Отсюда имеем  , или
, или  , где к=сp/сV – показатель адиабатного процесса. Окончательно имеем:
, где к=сp/сV – показатель адиабатного процесса. Окончательно имеем:
 . (9)
. (9)
Таким образом, теплоемкость политропного процесса зависит от показателя политропы  . Используя термическое уравнение состояния для идеального газа
. Используя термическое уравнение состояния для идеального газа  и уравнение (8), можно получить соотношения между параметрами для конечного процесса 1-2:
и уравнение (8), можно получить соотношения между параметрами для конечного процесса 1-2:
 . (10)
. (10)
Учитывая, что  , имеем:
, имеем:
 . (11)
. (11)
12.2. Расчет теплоты, работы, изменений внутренней энергии, энтальпии и энтропии. Уравнение политропных процессов в T-s координатах
Коэффициент распределения теплоты равен:  . Поскольку
. Поскольку  , то коэффициент
, то коэффициент
 . (12)
. (12)
Тогда изменение внутренней энергии в ТП 1-2 и теплота процесса могут быть рассчитаны по формулам:
 , (13)
, (13)
 , (14)
, (14)
а изменение энтальпии по формуле:
 . (15)
. (15)
Работа расширения в политропном процессе 1-2 равна:
 .
.
После интегрирования, учитывая, что  , имеем различные выражения для расчета работы расширения:
, имеем различные выражения для расчета работы расширения:
 , (16)
, (16)
или
 , (17)
, (17)
или
 . (18)
. (18)
Расчет располагаемой работы l0 проводятся, используя следующее выражение:
 , (19)
, (19)
Зная l0 по (19) и l по (16) можно определить показатель политропы  . Это один из способов опытного определения величины
. Это один из способов опытного определения величины  . С другими способами студенты будут ознакомлены при выполнении лабораторных работ.
. С другими способами студенты будут ознакомлены при выполнении лабораторных работ.
Для расчета изменения удельной энтропии в политропном процессе используем объединенное выражение 1-го и 2-го законов термодинамики для обратимых процессов:
 . (20)
. (20)
или  .
.
После интегрирования для конечного процесса 1-2 имеем:
 . (21)
. (21)
Если учесть, что  и
и  , то получим:
, то получим:
 . (22)
. (22)
Выразим  и подставим в (22).
и подставим в (22).
Тогда  . (23)
. (23)
Уравнение политропного процесса в координатах T-s будет иметь вид:
 - для бесконечно малого ТП. После интегрирования получим:
- для бесконечно малого ТП. После интегрирования получим:
 . (24)
. (24)
Зная показатель политропы  , можно рассчитать величину
, можно рассчитать величину  и построить данный ТП в T-s координатах. Из соотношений для политропных процессов вытекают, как частные случаи соотношения и уравнения изохорного, изобарного, изотермического и адиабатного процессов.
и построить данный ТП в T-s координатах. Из соотношений для политропных процессов вытекают, как частные случаи соотношения и уравнения изохорного, изобарного, изотермического и адиабатного процессов.
12.3. Частные случаи политропных процессов (изохорный, изобарный, изотермический и адиабатный)
Изохорный процесс – это процесс сообщения или отнятия теплоты от газа при постоянном объеме v=const.

Этот процесс используется как подготовительный процесс в циклах.
Соотношение между параметрами для конечного участка процесса 1-2 определяется законом Шарля: , который следует из уравнений состояния для точек 1 и 2:
, который следует из уравнений состояния для точек 1 и 2:  и
и  при
при  .
.
Поскольку работа расширения в этом процессе равна нулю:  , т.к.
, т.к.  , то из уравнения 1-го закона термодинамики следует, что:
, то из уравнения 1-го закона термодинамики следует, что:
 .
.
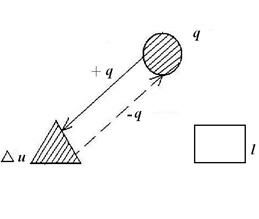
Таким образом, подведенная к газу в изохорном процессе теплота целиком идет на увеличение его внутренней энергии. Для ТП  коэффициент распределения теплоты
коэффициент распределения теплоты  , теплоемкость
, теплоемкость  и показатель политропы:
и показатель политропы:
 .
.
График распределения энергетических составляющих уравнения 1-го закона термодинамики в изохорном процессе имеет вид:
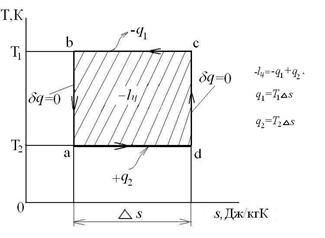
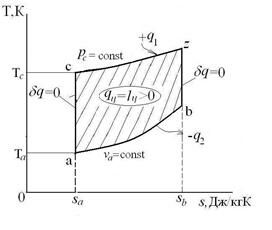
Изобарный процесс – это процесс сообщения или отнятия теплоты от газа при постоянном давлении р=const.

Соотношение между параметрами в процессе р=const:  - закон Гей-Люссака, т.к.:
- закон Гей-Люссака, т.к.:  ,
,  и
и  .
.
Работа расширения  . Т.к.
. Т.к.  , то
, то  .
.
Следовательно, удельная газовая постоянная R- это работа, совершаемая 1кг газа в процессе p=const при его нагревании на один градус. Размерность R: Дж/кгК. Уравнение 1-го закона термодинамики в этом случае имеем вид:
 .
.
Таким образом, вся теплота, подведенная к газу в изобарном процессе, расходуется на увеличение его энтальпии.
Коэффициент распределения теплоты в процессе р=const равен:
 ,
,  .
.
Теплоемкость с=ср и показатель политропы
 .
.
График распределения энергетических составляющих 1-го закона термодинамики в изобарном процессе имеет вид:

В T-s координатах взаимное положение изобары и изохоры имеет вид:
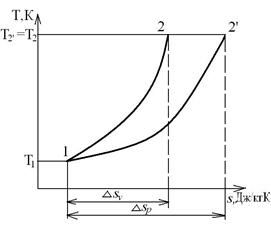
 ,
,  , т.е. изобара более пологая логарифмическая кривая в T-s координатах, чем изохора.
, т.е. изобара более пологая логарифмическая кривая в T-s координатах, чем изохора.
Изотермический процесс – это процесс сообщения или отнятия теплоты от газа при постоянной температуре
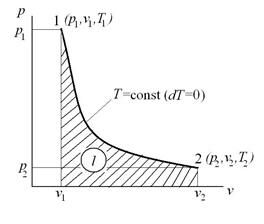

При Т=const из уравнения состояния  имеем:
имеем:  - это уравнение изотермического процесса является уравнением равнобокой гиперболы.
- это уравнение изотермического процесса является уравнением равнобокой гиперболы.
Тогда  , и
, и  - закон Бойля-Мариотта.
- закон Бойля-Мариотта.
Из уравнения 1-го закона термодинамики  при
при  имеем:
имеем:
 и q=l, т.е. вся теплота, сообщаемая газу в изотермическом процессе, целиком идет на работу расширения газа.
и q=l, т.е. вся теплота, сообщаемая газу в изотермическом процессе, целиком идет на работу расширения газа.
Изменение энтальпии в процессе T=const равно:
 .
.
Работа расширения  .
.
Коэффициент распределения теплоты
 .
.
Тогда теплоемкость  и показатель политропы для процесса T=const будет равен
и показатель политропы для процесса T=const будет равен  , т.е.
, т.е.  .
.
График распределения энергии в процессе T=const имеет вид:

Адиабатный процесс – это процесс, протекающий без внешнего теплообмена, т.е. q=0 и  (на конечном и бесконечно малом участке процесса).
(на конечном и бесконечно малом участке процесса).
Если записать для этого случая уравнения 1-го закона термодинамики в виде:
1.  или
или  ,
,
2.  или
или  , то после деления (1) на (2) получим:
, то после деления (1) на (2) получим:
 - показатель адиабаты.
- показатель адиабаты.
Тогда после интегрирования выражения  для конечного процесса 1-2 будем иметь
для конечного процесса 1-2 будем иметь  , или
, или  - это есть уравнение адиабатного процесса в p-v-координатах, которое является уравнением неравнобокой гиперболы.
- это есть уравнение адиабатного процесса в p-v-координатах, которое является уравнением неравнобокой гиперболы.


 , т.к. Т
, т.к. Т , то ds=0 и s=const. Таким образом, адиабатный процесс с идеальным газом есть изоэнтропийный процесс.
, то ds=0 и s=const. Таким образом, адиабатный процесс с идеальным газом есть изоэнтропийный процесс.
Соотношения между параметрами состояния в этом процессе:
 и
и  , а график распределения энергии в процессе имеет вид:
, а график распределения энергии в процессе имеет вид:
Из уравнения 1-го закона термодинамики следует, что  , т.е.
, т.е.  . Таким образом, работа расширения в адиабатном процессе совершается за счет уменьшения внутренней энергии газа, а его температура уменьшается
. Таким образом, работа расширения в адиабатном процессе совершается за счет уменьшения внутренней энергии газа, а его температура уменьшается  .
.
Работа расширения по аналогии с политропным процессом будет равна:
 ,
,
или  .
.
Коэффициент распределения теплоты в процессе q=0:
 , а теплоемкость адиабатного процесса
, а теплоемкость адиабатного процесса  .
.
Показатель адиабаты  для одноатомных газов равен к=1,66, для двухатомных к=1,4 и для трехатомных к=1,3.
для одноатомных газов равен к=1,66, для двухатомных к=1,4 и для трехатомных к=1,3.
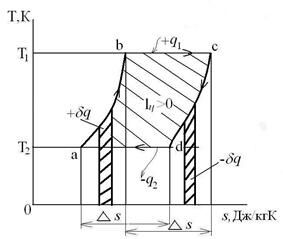
12.4. Исследование политропных процессов
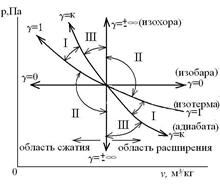
Все политропные процессы можно разделить на три группы:
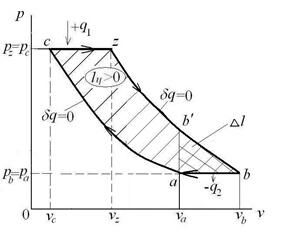
- I группа – политропы, показатель которых изменяется в пределах  , а теплотa q в процессе подводится к рабочему телу (+q);
, а теплотa q в процессе подводится к рабочему телу (+q);
- II группа – политропы, показатели которых лежат в пределах  , с подводом теплоты к рабочему телу (+q);
, с подводом теплоты к рабочему телу (+q);
- III группа – политропы, показатели которых лежат в пределах  с отводом теплоты от системы в холодильник (-q).
с отводом теплоты от системы в холодильник (-q).
Взаимное положение групп политроп в p-v координатах имеет вид:
Взаимное положение групп политроп в T-s координатах имеет вид:
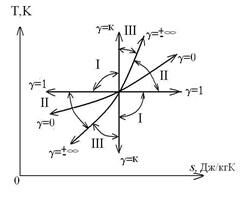
У каждой из групп политроп имеется свой собственный закон распределения энергетических составляющих уравнения 1-го закона термодинамики и собственное значение показателя политропы  .
.
I группа 
При расширении газа с ростом  ослабевает роль источника теплоты и увеличивается роль внутренней энергии в производстве механической работы.
ослабевает роль источника теплоты и увеличивается роль внутренней энергии в производстве механической работы.
II группа ( )
)
При расширении газа с ростом  увеличивается доля теплоты, идущей на работу, и уменьшается доля теплоты, идущей на нагрев газа.
увеличивается доля теплоты, идущей на работу, и уменьшается доля теплоты, идущей на нагрев газа.
III группа ( )
)
При расширении газа с ростом  уменьшается доля внутренней энергии, идущей на работу, и увеличивается доля внутренней энергии, отдаваемая холодильнику.
уменьшается доля внутренней энергии, идущей на работу, и увеличивается доля внутренней энергии, отдаваемая холодильнику.
Глава 13. Тепловые машины и компрессоры
13.1. Классификация тепловых машин. Циклы замкнутые и разомкнутые, прямые и обратные
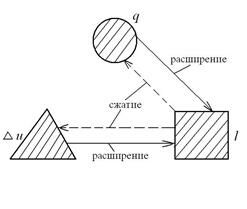
Тепловые машины подразделяются на тепловые двигатели и тепловые трансформаторы, к которым относятся холодильные установки и тепловые насосы. В тепловых двигателях происходит превращение теплоты в работы. Тепловые трансформаторы переносят тепловую энергию от холодных тел к горячим телам при затрате работы. На следующей схеме показано направление переноса теплоты от холодного тела к горячему телу при затрате работы в холодильной установке и тепловом насосе.
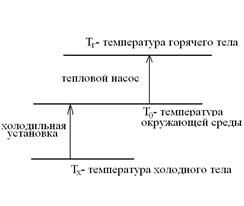
Окружающая среда является горячим телом в холодильных установках и холодным телом в тепловых насосах.
Тепловые машины используют в качестве рабочего тела либо газ, либо пар, которые изменяют свои параметры при изменении своего состояния по циклу.
Циклы тепловых двигателей – прямые циклы, требующие для своего осуществления затраты теплоты. В них линия расширения лежит выше линии сжатия в p-v координатах, т.е. прямые циклы направлены по часовой стрелке, как показано на рисунке

Циклы трансформаторов - обратные циклы, направленные против часовой стрелки в p-v координатах.
Циклы бывают замкнутые и разомкнутые. Циклы двигателей внутреннего сгорания (ДВС) поршневых и реактивных двигателей являются разомкнутыми циклами. При термодинамических расчетах ДВС методом круговых процессов разомкнутые циклы этих двигателей условно рассматриваются как замкнутые циклы. Тепловые двигатели, работающие по замкнутому циклу, являются двигателями внешнего сгорания. Примером двигателя внешнего сгорания является двигатель Стирлинга, в котором рабочее тело (гелий или водород) постоянно находится в замкнутом пространстве и изменяет свой объем при нагревании и охлаждении, а теплота образуется вне этого замкнутого пространства. Этот двигатель разработан Р.Стирлингом в 1816г. в Великобритании.
Принципиальная схема тепловой машины, работающей по замкнутому циклу, имеет вид:
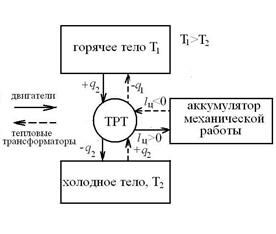
Для кругового процесса ∮du=0 и  . Для теплового двигателя q1 есть сумма теплот, подведенных за цикл к термодинамическому рабочему телу (ТРТ) от источника, а q2 – сумма теплот, отведенных за цикл от ТРТ в холодильник. Результирующая работа двигателя за цикл -
. Для теплового двигателя q1 есть сумма теплот, подведенных за цикл к термодинамическому рабочему телу (ТРТ) от источника, а q2 – сумма теплот, отведенных за цикл от ТРТ в холодильник. Результирующая работа двигателя за цикл -  совершается за счет разности теплот
совершается за счет разности теплот  .
.
Для теплового трансформатора:
q1 - есть теплота, отводимая от ТРТ к горячему телу;
q2 – теплота, подводимая от холодного тела к ТРТ;
lц<0 – работа, затрачиваемая ТС на перенос тепловой энергии от холодного тела к горячему телу;
-lц=-q1+q2 , или q1=lц+q2.
13.2. Термические коэффициенты, характеризующие работу тепловой машины. Термические коэффициенты машин, работающих по циклу Карно
Работа теплового двигателя характеризуется термическим коэффициентом полезного действия (кпд) прямого цикла:
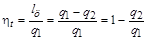
Термический кпд  показывает, какую долю теплоты, подводимой в цикле q1, можно превратить в полезную механическую работу lц. Термический кпд прямого цикла характеризует экономичность теплового двигателя.
показывает, какую долю теплоты, подводимой в цикле q1, можно превратить в полезную механическую работу lц. Термический кпд прямого цикла характеризует экономичность теплового двигателя.
Работа холодильной установки характеризуется холодильным коэффициентом:
 , который показывает сколько нужно затратить работы lц на перенос тепловой энергии от холодного тела к горячему телу (в окружающую среду).
, который показывает сколько нужно затратить работы lц на перенос тепловой энергии от холодного тела к горячему телу (в окружающую среду).
Работа теплового насоса характеризуется нагревательным (отопительным) коэффициентом
 .
.
Нагревательный коэффициент показывает, сколько необходимо затратить работы на перенос тепловой энергии в обогреваемое помещение (к горячему телу).
Определим выражения для расчета термических коэффициентов тепловых машин, работающих по циклу Карно.
13.2.1. Тепловой двигатель
Для теплового двигателя цикл Карно – прямой цикл, состоящий из двух адиабат и двух изотерм, а для тепловых трансформаторов используется обратный цикл Карно. Тепловые машины, работающие по циклу Карно, имеют наибольшие значения термических кпд по сравнению с любым другим циклом при одинаковых предельных температурах цикла Т1 и Т2.
Рассмотрим прямой цикл Карно.
Графически в p-v и T-s координатах этот цикл можно представить в виде:


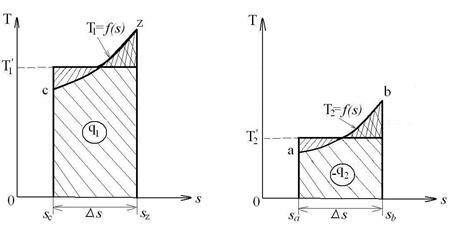
где ab – адиабатное сжатие ТРТ;
bc – подвод теплоты q1 в изотермическом процессе при Т1=const;
cd – адиабатное расширение ТРТ;
da – отвод теплоты  в холодильник при Т2=const;
в холодильник при Т2=const;
q1 = площадь bсFEb – теплота, затраченная на совершение цикла  .
.
q2 = площадь adFЕa – теплота, отведенная в холодильник .
.
Тогда термический кпд прямого цикла Карно будет равен:
 .
.
Таким образом, термический кпд цикла Карно зависит только от предельных температур источника и холодильника и не зависит от рода рабочего тела. (Первая теорема Карно). Температура Т1 и Т2 являются основными параметрами цикла Карно, которые полностью определяют этот цикл.
При Т1=Т2 термический кпд цикла Карно  , т.е. превращение теплоты в работу невозможно.
, т.е. превращение теплоты в работу невозможно.
При Т2=0 или Т1=
 , что невыполнимо. Следовательно, в цикле Карно термический кпд цикла всегда меньше единицы:
, что невыполнимо. Следовательно, в цикле Карно термический кпд цикла всегда меньше единицы:  . Таким образом, для прямого цикла Карно
. Таким образом, для прямого цикла Карно  .
.
Любое заключение, вытекающее из анализа прямого цикла Карно, можно рассматривать как формулировку второго закона термодинамики.
13.2.2. Холодильная установка
Холодильная установка работает по обратному циклу Карно. Для его осуществления необходимо затратить работу (-lц).
Тогда холодильный коэффициент обратного цикла Карно будет равен:
 , или
, или
 .
.
Если  , то
, то  . Если
. Если  , то
, то  . Тогда
. Тогда  , где
, где
Т2 – температура холодильной камеры, Т1 – температура окружающей среды.
13.2.3. Тепловой насос
Тепловой насос передает тепловую энергию в обогреваемое помещение с температурой Т1, отбирая ее от окружающей среды с температурой Т0=Т2. Тогда термический кпд теплового насоса, работающего по обратному циклу Карно, будет равен:
 .
.
Если  , то
, то  . Если
. Если  , то
, то  .
.
Если горячее тело имеет очень высокую температуру Т1, то поступающая к нему теплота содержит в основном работу, а от холодного тела теплота практически не отбирается.
13.2.4. Регенеративные циклы
Регенеративные циклы не являются циклами Карно, но термические коэффициенты этих циклов идентичны термическим коэффициентам цикла Карно. В T-s координатах такие циклы состоят из двух изотерм и двух эквидистантных кривых. Так, для теплового двигателя, работающего по регенеративному циклу, имеем следующее изображение цикла в Т-s координатах:
В процесс cd теплота отбирается от ТРТ и отдается рабочему телу в процессе ab  . Тогда получим выражение для расчета
. Тогда получим выражение для расчета  :
:  .
.
13.2.5. Необратимый цикл Карно
В случае необратимого цикла Карно термический кпд будет меньше, чем термический кпд обратимого цикла, т.е.
 .
.
Действительно, для обратимого цикла
 , т.е. условия обратимости цикла: Т2=Тхол, Т1=Тист. В случае необратимого цикла Тист>Т1 и Тхол<Т2. Тогда имеем:
, т.е. условия обратимости цикла: Т2=Тхол, Т1=Тист. В случае необратимого цикла Тист>Т1 и Тхол<Т2. Тогда имеем:  и термический кпд необратимого цикла Карно, равный
и термический кпд необратимого цикла Карно, равный  , будет меньше
, будет меньше  :
:
 .
.
Таким образом, термический кпд необратимого цикла Карно, осуществляемого при конечных разностях температур (Тист-Т1) и (Т2-Тхол), всегда будет меньше термического кпд обратимого цикла Карно, осуществляемого при тех же самых температурах источника и холодильника (вторая теорема Карно). Это положение обобщается и на произвольные необратимые циклы.
13.3. Газовые циклы поршневых двигателей
Циклы поршневых и реактивных двигателей будем рассматривать как условно замкнутые, идеальные, обратимые циклы., в которых рабочим телом является идеальный газ. При этом принимается, что теплота подводится к рабочему телу извне от внешнего источника и отводится в холодильник, т.е. в окружающую среду в условно замыкающем процессе. В этом случае для расчета процесса сгорания используется понятие теплотворной способности топлива, а энтальпия рабочего тела находится без учета энтальпии образования по формуле:
 .
.
13.3.1. Цикл Отто
Четырехтактный газовый ДВС создан в 1876 году Н.А. Отто (1832-1891) Цикл Отто совершается в 4-х тактном тепловом двигателе внутреннего сгорания с внешним смесеобразованием (карбюраторный ДВС) и кривошипно-шатунным механизмом. При этом поршень совершает возвратно-поступательное движение в цилиндре. Цикл Отто – прямой газовый изохорный цикл неполного расширения представлен в p-v координатах на следующем рисунке.
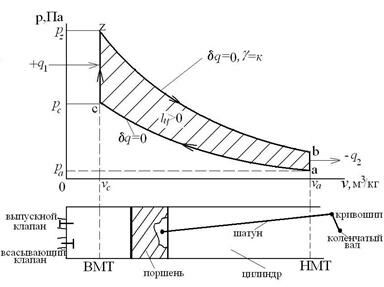
Этот цикл неполного расширения (Рb>Ра) состоит из двух изохорных и двух адиабатных процессов:
где ac – сжатие ТРТ по адиабате;
cz – подвод теплоты q1 к ТРТ по изохоре;
zb – расширение ТРТ по адиабате;
ba – отвод теплоты q2 в холодильник от ТРТ по изохоре.
После прохождения этого цикла ТРТ возвращается в начальное состояние. В результате этого цикла совершается положительная результатирующая работа ( ), равная площадь aczba, которая передается на вал двигателя. В T-s координатах цикла Отто имеет вид:
), равная площадь aczba, которая передается на вал двигателя. В T-s координатах цикла Отто имеет вид:
Основные характеристики (параметры) цикла Отто:
- степень сжатия:  , где va – полный объем цилиндра (в начале процесса сжатия), vc – объем камеры сгорания (в конце процесса сжатия);
, где va – полный объем цилиндра (в начале процесса сжатия), vc – объем камеры сгорания (в конце процесса сжатия);
- степень повышения давления в процессе подвода теплоты (при горении топливо-воздушной смеси):  , где Pz – давление ТРТ в конце подвода теплоты q1 , Pc – давление ТРТ в начале подвода теплоты q1 . Параметрами цикла называются величины, которые полностью определяют цикл. Их число равно числу процессов в цикле без двух. Термический кпд цикла Отто:
, где Pz – давление ТРТ в конце подвода теплоты q1 , Pc – давление ТРТ в начале подвода теплоты q1 . Параметрами цикла называются величины, которые полностью определяют цикл. Их число равно числу процессов в цикле без двух. Термический кпд цикла Отто:
 , где
, где  и
и  . После подстановки q1 и q2 в выражение для
. После подстановки q1 и q2 в выражение для  имеем:
имеем:
 .
.
После подстановки в эту формулу величин:  (для адиабаты ac) и учитывая, что
(для адиабаты ac) и учитывая, что  (для изохоры c-z) и что
(для изохоры c-z) и что  , окончательно имеем:
, окончательно имеем:
 , т.е.
, т.е.  .
.
С ростом степени сжатия  увеличивается максимальная температура в системе Т1 и в соответствии со 2-м законом термодинамики увеличивается термический кпд. С ростом показателя адиабаты к термический кпд увеличивается из-за влияния рода ТРТ, т.е. теплоемкости идеального газа.
увеличивается максимальная температура в системе Т1 и в соответствии со 2-м законом термодинамики увеличивается термический кпд. С ростом показателя адиабаты к термический кпд увеличивается из-за влияния рода ТРТ, т.е. теплоемкости идеального газа.
Недостатком цикла Отто является невозможность применения высоких степеней сжатия. Обычно применяются степени сжатия в диапазоне:  , что определяется температурой воспламенения топлива Ттоп, которую не может превышать температура в конце процесса сжатия Тс из-за опасности взрывного самовозгорания топлива, т.е. Тс<Ттоп и
, что определяется температурой воспламенения топлива Ттоп, которую не может превышать температура в конце процесса сжатия Тс из-за опасности взрывного самовозгорания топлива, т.е. Тс<Ттоп и  . Чем выше октановое число бензина, тем до больших степеней сжатия
. Чем выше октановое число бензина, тем до больших степеней сжатия  можно сжать топливо-воздушную смесь (без взрыва).
можно сжать топливо-воздушную смесь (без взрыва).
13.3.2. Цикл Дизеля
Поршневой двигатель внутреннего сгорания с воспламенением от сжатия с внутренним смесеобразованием был создан в 1897 году немецким инженером Р.Дизелем (1858-1913). В двигателях Дизеля распыление жидкого топлива в цилиндре двигателя производится воздухом высокого давления от специального компрессора из форсунки. При этом давление в конце процесса сжатия может составлять порядка рс=32-36 атм ( ).
).
Идеальный цикл Дизеля состоит из изобарного, двух адиабатных и изохорного процессов и является прямым газовым изобарным циклом неполного расширения, который изображен в p-v и Т-s координатах на следующих рисунках

где ac – адиабатное сжатие чистого воздуха;
cz – изобарный подвод теплоты q1;
zb – адиабатное расширение ТРТ;
ba – изохорный отвод теплоты q2 в холодильник.
Основные характеристики (параметры) цикла:
- степень сжатия  ;
;
- степень предварительного изобарного расширения  в процессе подвода теплоты q1.
в процессе подвода теплоты q1.
Термический кпд цикла Дизеля:

 ,
,
где  (адиабата ac);
(адиабата ac);
 (изобара c-z) – закон Гей-Люссака;
(изобара c-z) – закон Гей-Люссака;
 , - (изохора ba и адиабаты zb и ca).
, - (изохора ba и адиабаты zb и ca).
Окончательно имеем:
 .
.
С ростом степени сжатия  термический кпд цикла Дизеля растет, а с увеличением степени предварительного изобарного расширения
термический кпд цикла Дизеля растет, а с увеличением степени предварительного изобарного расширения 
 цикла Дизеля уменьшается из-за роста температуры ТРТ при выхлопе (из-за роста теплоты q2).
цикла Дизеля уменьшается из-за роста температуры ТРТ при выхлопе (из-за роста теплоты q2).
В двигателе Дизеля сжимается чистой воздух и можно применить большие степени сжатия по сравнению со степенью сжатия в двигателе, работающем по циклу Отто.
13.3.3. Цикл Тринклера
Цикл Тринклера – это цикл безкомпрессорных дизелей (смешанный цикл), состоящий из изобарного, двух изохорных и двух адиабатных процессов, как показано на следующих рисунках в p-v и T-s координатах:


где ac – адиабатное сжатие чистого воздуха; су – подвод теплоты q1v (подача топлива в форкамеру и его сгорание при v=const); yz – подвод теплоты q1p (подача топлива и его сгорание в цилиндре двигателя при p=const); zb - адиабатное расширение продуктов сгорания; ba – отвод теплоты q2 (выхлоп продуктов сгорания по изохоре).
Основные параметры цикла:
- степень сжатия:  ;
;
- степень предварительного (изобарного) расширения:  ;
;
- степень повышения давления в процессе подвода теплоты по изохоре:  .Термический кпд цикла Тринклера:
.Термический кпд цикла Тринклера:
 .
.
Термический кпд растет с увеличением степени сжатия  и степени повышения давления в процессе подвода теплоты по изохоре
и степени повышения давления в процессе подвода теплоты по изохоре  и уменьшается с ростом степени предварительного (изобарного) расширения
и уменьшается с ростом степени предварительного (изобарного) расширения  .
.
Для рассмотренных циклов Отто, Дизеля и Тринклера  . Если
. Если  , то получим цикл Дизеля. Если
, то получим цикл Дизеля. Если  , то получим цикл Отто. Таким образом, цикл Тринклера можно рассматривать как обобщающий цикл.
, то получим цикл Отто. Таким образом, цикл Тринклера можно рассматривать как обобщающий цикл.
Циклы Дизеля и Тринклера имеют более высокие термические кпд, чем цикл Отто, из-за возможности реализовать большие степени сжатия. Преимуществом этих циклов над циклом Отто является также возможность использования более дешевого топлива.
Общее у циклов Отто и Дизеля – адиабатные процессы сжатия и расширения, что позволяет построить методы их сравнения. Сравним эти циклы графическим методом – методом сравнения площадей при помощи Т-s диаграммы.
1. При одинаковых  , одинаковых
, одинаковых  и одинаковом начальном состоянии РТ (точки а и А1)
и одинаковом начальном состоянии РТ (точки а и А1)  , т.к.
, т.к.  на величину пл.NbB1FN
на величину пл.NbB1FN
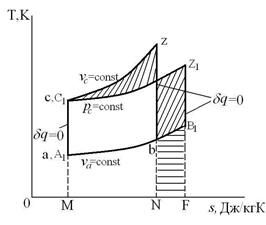
Таким образом, изохорный цикл (цикл Отто) при этих условиях сравнения является более экономичным, чем изобарный цикл (цикл Дизеля).
2. При одинаковых  , одинаковых максимальных давлениях
, одинаковых максимальных давлениях  и одинаковом начальном состоянии РТ (точки а и А1)
и одинаковом начальном состоянии РТ (точки а и А1)  , т.к.
, т.к.  на величину пл.NB1bFN.
на величину пл.NB1bFN.

Следовательно, при этих условиях сравнения циклов изобарный цикл (цикл Дизеля) является более экономичным циклом, чем изохорный цикл (цикл Отто).
13.4. Газовые циклы реактивных двигателей и газотурбинных установок
Недостатки поршневых двигателей внутреннего сгорания: ограниченная мощность из-за периодичности их действия и невозможность полного адиабатного расширения ТРТ до давления окружающей среды, не позволили их использовать при больших скоростях полета. Поэтому при больших дозвуковых и при сверхзвуковых скоростях полета на летательных аппаратах устанавливаются различные типы реактивных двигателей.
Реактивные двигатели и газотурбинные установки обладают тем преимуществом по сравнению с поршневыми ДВС, что это двигатели непрерывного действия и могут реализовать любые потребные мощности. Кроме того, реактивные двигатели и газотурбинные установки позволяют осуществить более экономичные термодинамические циклы полного расширения ТРТ до давления окружающей среды.
13.4.1. Цикл Брайтона
Цикл Брайтона – это прямой газовый изобарный цикл полного расширения, состоящий из двух адиабатных и двух изобарных процессов:

где ac – адиабатное сжатие в диффузоре и компрессоре реактивного двигателя (ТРД);
cz – изобарный подвод теплоты q1 (в камеру сгорания ТРД);
zb – адиабатное расширение продуктов сгорания на турбине и в реактивном сопле двигателя;
ba – изобарный охлаждение выпускных газов в окружающей среде.
Совокупность этих процессов образует цикл с положительной результирующей работой  .
.
Основные характеристики (параметры) цикла:
- степень сжатия  , или степень повышения давления в процессе сжатия
, или степень повышения давления в процессе сжатия  ;
;
- степень предварительного изобарного расширения ТРТ  . Тогда термический кпд цикла Брайтона будет равен:
. Тогда термический кпд цикла Брайтона будет равен:

 ,
,
где  (адиабата a-c);
(адиабата a-c);
 (изобара cz) – закон Гей-Люссака;
(изобара cz) – закон Гей-Люссака;
 , - (изохора ba и адиабаты zb и ac).
, - (изохора ba и адиабаты zb и ac).
Тогда после подстановки этих значений в выражение для термического кпд получим:
 .
.
С ростом степени сжатия  (или степени повышения давления П) термический кпд цикла Брайтона возрастает за счет более глубокого расширения газа, т.к. снижается температура Тb и теплота q2, отданная холодильнику. Результирующая работа цикла Брайтона больше работы цикла неполного расширения (цикла Дизеля) на величину
(или степени повышения давления П) термический кпд цикла Брайтона возрастает за счет более глубокого расширения газа, т.к. снижается температура Тb и теплота q2, отданная холодильнику. Результирующая работа цикла Брайтона больше работы цикла неполного расширения (цикла Дизеля) на величину  при одинаковых степенях сжатия ТРТ и подведенной теплоты q1, что позволяет осуществить более экономичный термодинамический цикл полного расширения.
при одинаковых степенях сжатия ТРТ и подведенной теплоты q1, что позволяет осуществить более экономичный термодинамический цикл полного расширения.
13.4.2. Цикл Гемфри
Цикл Гемфри – это прямой газовый изохорный цикл полного расширения. Этот цикл был реализован в пульсирующем прямоточном воздушно-реактивном двигателе, установленном на немецкой крылатой ракете Фау-1. В p-v и T-s координатах этот цикл представлен на следующих рисунках:


где ac –сжатие воздуха по адиабате в диффузоре или компрессоре; cz –подвод теплоты q1 по изохоре; zb – адиабатное расширение продуктов сгорания на турбине или в реактивном сопле; ba – изобарное охлаждение выхлопных газов в окружающей среде.
Основные характеристики (параметры) цикла:
- степень сжатия  , или степень повышения давления в процессе сжатия П=рс/ра;
, или степень повышения давления в процессе сжатия П=рс/ра;
- степень повышения давления в процессе подвода теплоты q1 по изохоре  .
.
Термический кпд цикла Гемфри равен:

 ,
,
где  (адиабата ac);
(адиабата ac);
 (закон Шарля) –изохора c-z;
(закон Шарля) –изохора c-z;
 , - (изобара ba и адиабаты zb и ac).
, - (изобара ba и адиабаты zb и ac).
После подстановки этих значений в выражение для  получим:
получим:
 .
.
Таким образом, термический кпд цикла Гемфри является прямой функцией степени сжатия  (или П) и степени повышения давления в процессе подвода теплоты q1 по изохоре
(или П) и степени повышения давления в процессе подвода теплоты q1 по изохоре  .
.
13.4.3. Цикл жидкостного ракетного двигателя
ЖРД – это ракетный двигатель, работающий на жидком ракетном топливе. ЖРД был предложен К.Э. Циолковским (1857-1935) как двигатель для полетов в Космосе в 1903 году. Практические работы по созданию ЖРД были начаты в США в 1921 году Р. Годдардом (1882-1945) и в 1926 г. был произведен запуск ракеты с ЖРД. В 1931 г. испытаны первые в СССР ЖРД ОРМ и ОРМ-1 в газодинамической лаборатории (в дальнейшем РНИИ,
НИИ-1, НИИТП) под руководством В.П. Глушко.
Идеальный цикл ЖРД – прямой газовый изобарный цикл полного расширения:
где 1-2 – изохорный процесс сжатия и нагнетания жидких компонентов топлива в камеру сгорания при помощи турбонасосного агрегата (ТНА). Принимается, что объем жидкости  , где vГ – объем газообразных компонентов, т.е. пренебрегается удельным объемом vж по сравнению с удельным объемом vГ, и что энтальпия h1=h2=0, т.к. жидким компонентам топлива теплота не сообщается;
, где vГ – объем газообразных компонентов, т.е. пренебрегается удельным объемом vж по сравнению с удельным объемом vГ, и что энтальпия h1=h2=0, т.к. жидким компонентам топлива теплота не сообщается;
2-3 – изобарный процесс подвода теплоты q1;
3-4 – адиабатное расширение продуктов сгорания в сопле Лаваля;
4-1 – изобарный процесс отвода теплоты q2 в окружающую среду.
Эти процессы образуют цикл с положительной результирующей работой ( ).
).
Термический кпд цикла ЖРД будет равен:
 ,
,
т.к. h1=h2=0. В методе круговых процессов, используемого для анализа цикла ЖРД, при расчете энтальпий теплота образования вещества не учитывается. Поэтому энтальпии  и
и  . Тогда
. Тогда
 ,
,
где  - степень повышения давления. Тогда
- степень повышения давления. Тогда
 .
.
Таким образом, термический кпд цикла ЖРД растет с ростом давления рабочего тела в камере сгорания двигателя (р3=р2).
Представим термический кпд цикла ЖРД в виде:
 .
.
Тогда можно сделать вывод, что при заданной теплоте источника термический кпд цикла ЖРД тем больше, чем больше степень расширения газа в сопле, т.е. чем больше разность энтальпий (h3-h4), а результирующая работа цикла (располагаемая работа) целиком идет на создание кинетической энергии струи, вытекающих из сопла продуктов сгорания.
13.5. Методы сравнения эффективности различных циклов
В разделе 13.3. для сравнения экономичности циклов Отто и Дизеля при различных заданных условиях сравнения использовался графический метод сравнения при помощи T-s диаграммы. В данном разделе рассмотрим метод сравнения, основанный на использовании усредненных температур:
 и
и  , которые графически демонстрируются на следующих рисунках:
, которые графически демонстрируются на следующих рисунках:
Таким образом, сравниваемые циклы заменяются на эквивалентные циклы Карно при использовании усредненных температур. Тогда термический кпд эквивалентного цикла Карно можно представить в виде:  . Сравнение термических кпд различных эквивалентных циклов Карно между собой проводится при одинаковых предельных температурах:T1=Tmax и T2=Tmin. Сравним эквивалентные циклы А, Б, В с К- циклом Карно:
. Сравнение термических кпд различных эквивалентных циклов Карно между собой проводится при одинаковых предельных температурах:T1=Tmax и T2=Tmin. Сравним эквивалентные циклы А, Б, В с К- циклом Карно:


Чем больше термический кпд эквивалентного цикла Карно, тем экономичней двигатель. Чем больше усредненная температура  подвода теплоты и чем меньше эквивалентная температура
подвода теплоты и чем меньше эквивалентная температура  отвода теплоты, тем больше термический кпд цикла. Так как изобара более пологая логарифмическая кривая в T-s координатах, чем изохора, то изобарный цикл
отвода теплоты, тем больше термический кпд цикла. Так как изобара более пологая логарифмическая кривая в T-s координатах, чем изохора, то изобарный цикл  более экономичен, чем изохорный цикл
более экономичен, чем изохорный цикл  , т.е. термический кпд цикла Дизеля больше термического кпд цикла Отто (
, т.е. термический кпд цикла Дизеля больше термического кпд цикла Отто (
 ).
).
13.6. Газовые поршневые компрессоры. Расчет работы сжатия. Характеристики одно- и многоступенчатых компрессоров. Потери на сжатие
Компрессоры предназначаются для сжатия газообразных рабочих тел. На осуществление обратного цикла, по схеме которого работают компрессоры, расходуется механическая работа.
Одноступенчатый компрессор

Давление р3=р2 и температура Т3=Т1.
Процесс сжатия в компрессоре в p-v и T-s координатах имеет вид:
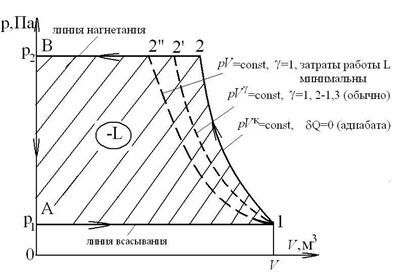
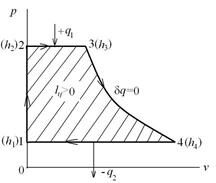
где А-1 – линия всасывания; 1-2 – процесс сжатия газа; 2-В – линия нагнетания сжатого газа в баллон; (-L) – работа, затрачиваемая на привод компрессора.
На диаграмме T-s работа, затрачиваемая на привод компрессора равна площади F23EF.
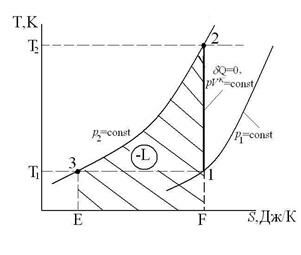
Линия А-1 и 2-В не изображают термодинамические процессы в координатах р[Па]-V[м3], так как количество рабочего тела на них переменно. При этом удельные параметры состояния газа (p, v, T) практически не изменяются. Основной характеристикой компрессора является степень повышения давления П=р2/р1. Для одноступенчатого компрессора П=8-12. Величина П=р2/р1 для одноступенчатого компрессора ограничивается максимальной температурой в конце процесса сжатия Т2max (3000C) из-за опасности возгорания масла и наличием вредного (мертвого) пространства между поршнем компрессора и днищем цилиндра из-за размещения в нем клапанов (всасывающего и нагнетательного), что учитывается объемным кпд компрессора
(3000C) из-за опасности возгорания масла и наличием вредного (мертвого) пространства между поршнем компрессора и днищем цилиндра из-за размещения в нем клапанов (всасывающего и нагнетательного), что учитывается объемным кпд компрессора  , где V – фактический объем всасываемого газа. Для реальных компрессоров
, где V – фактический объем всасываемого газа. Для реальных компрессоров  (всегда). Влияние вредного пространства на степень повышения давления в одноступенчатом компрессоре проиллюстрируем следующим рисунком:
(всегда). Влияние вредного пространства на степень повышения давления в одноступенчатом компрессоре проиллюстрируем следующим рисунком:
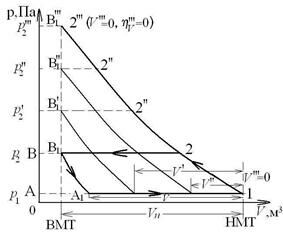
где процесс В1-А1 – это процесс расширения газа, оставшегося во вредном пространстве; т.А1 – фактическое начало всасывания газа. С ростом давления р2 объемный кпд компрессора  уменьшается и при
уменьшается и при  фактический объем всасываемого газа равен нулю (
фактический объем всасываемого газа равен нулю ( ) и
) и  .
.
При расчете работы на привод компрессора принимается, что процесс сжатия газа – равновесный, вредное пространство отсутствует и потерями давления на всасывание и нагнетание газа можно пренебречь. Тогда цикл компрессора будет иметь вид:

Механическая работа, затрачиваемая в одноступенчатом компрессоре на сжатие 1 кг газа, равна:
 ,
,
или  , или
, или  , где показатель политропы
, где показатель политропы  .
.
При медленном сжатии  (изотерма). При очень быстром сжатии
(изотерма). При очень быстром сжатии  (адиабата). Работа при адиабатном сжатии равна
(адиабата). Работа при адиабатном сжатии равна
 .
.
При изотермическом сжатии работа равна:
 .
.
Сжатие в многоступенчатом компрессоре

При расчете работы на привод многоступенчатого компрессора принимается, что Т2=Т , т.е. что температура газа в конце процесса сжатия в каждой ступени одинакова, и что работа сжатия в каждой из ступеней компрессора одинакова, т.е. l1=l2=l3=lц/3, где 3 – число ступеней компрессора в рассматриваемом примере. Каждая ступень работает в одном и том же интервале температур от Т1 до Т2, как показано на следующей схеме:
, т.е. что температура газа в конце процесса сжатия в каждой ступени одинакова, и что работа сжатия в каждой из ступеней компрессора одинакова, т.е. l1=l2=l3=lц/3, где 3 – число ступеней компрессора в рассматриваемом примере. Каждая ступень работает в одном и том же интервале температур от Т1 до Т2, как показано на следующей схеме:
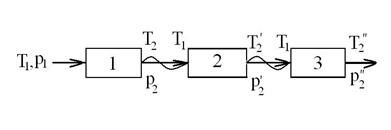
При этом в каждой ступени имеет место один и тот же политропический процесс сжатия:
 ,
,  и т.д.,
и т.д.,
где П1=П2=П3=П. Тогда р2=Пр1, р =П2р1, р
=П2р1, р =П3р1 и т.д.
=П3р1 и т.д.
Рекомендуем посмотреть лекцию "Личностные особенности детей и подростков с отклонениями в развитии".
При этом конечное давление в многоступенчатом компрессоре с числом ступеней N будет равно:
 .
.
Тогда для трехступенчатого компрессора (N=3) работа, затраченная на сжатие газа, будет равна:
 ,
,
а для произвольного числа ступеней N будем иметь следующее выражение:
 .
.




















