Двухатомный газ с молекулами из различных атомов. Вращение молекул
2.8. Двухатомный газ с молекулами из различных атомов. Вращение молекул
Будем рассматривать теперь идеальные газы с учетом внутренней структуры их молекул. Наиболее простой случай представляет собой двухатомный газ. Двухатомный газ можно рассматривать как таковой только при условии малости kТ по сравнению с энергией диссоциации молекул. В таблице приведены характерные температуры, соответствующие диссоциации некоторых молекул.
| молекула | Eдис/k, К |
| H2 | 52000 |
| N2 | 113000 |
| O2 | Рекомендуемые материалы-50% Динамика механических систем -50% Электростатика + Магнитостатика -50% Плоская и пространственная статика -51% Динамические реакции подшипников -51% Динамические реакции подшипников -50% Растяжение — сжатие, Кручение 59000 |
| Cl2 | 29000 |
| NO | 61000 |
| CO | 98000 |
Наиболее важный практический случай – когда в своем нормальном электронном состоянии молекула газа не имеет ни спина, ни орбитального момента вращения относительно оси (нет тонкой структуры). Следует различать случаи молекул, составленных из разных атомов (изотопы) и молекул, составленных из одинаковых атомов. Будем считать, что атомы разные (не тождественные).
Уровень энергии двухатомной молекулы складывается в известном приближении из трех независимых частей – электронной энергии (энергии кулоновского взаимодействия ядер в их равновесном положении, отсчитываемой от суммы энергий разведенных атомов); вращательной энергии и энергии колебания ядер внутри молекулы. Эти уровни могут быть записаны в следующем виде:
 .
.
При классическом вращении энергия имеет вид
 ,
,
но из квантовой механики следует, что L2 квантуется.
Здесь ε0-электронная энергия,  – колебательный квант, v – колебательное квантовое число, К – вращательное квантовое число;
– колебательный квант, v – колебательное квантовое число, К – вращательное квантовое число;
I = m’r02 – момент инерции молекулы, m’ – приведенная масса обоих атомов, r0 – равновесное состояние между атомами.
При подстановке этого выражения в статическую сумму, последняя распадается на три независимых множителя:
 ,
,
где вращательная и колебательная суммы определяются как
 ,
,
 ,
,
причем множитель 2К+1 в zвр учитывает вырождение вращательных уровней по направлениям момента импульса L. Соответственно, свободная энергия представится как:
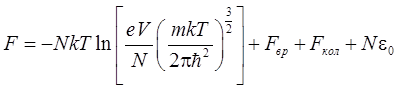
(m=m1+m2) – масса молекулы. Первый член можно назвать поступательной частью Fпос (поскольку он связан со степенями свободы поступательного движения молекул), а
 ,
,  .
.
Поступательная теплоемкость, приходящаяся на одну молекулу, равна cпос=3/2 k. Полная теплоемкость газа записывается в виде суммы
cV = cпос+ cвр + cкол; cр= cпос+ cвр + cкол + k,
каждое слагаемое которой связано с тепловым возбуждением соответственно поступательного, вращательного и колебательного движений.
Вычислим вращательную свободную энергию.
Рассмотрим случай, когда температура настолько высока, что
 .
.
Это означает, что вращательный квант  мал по сравнению с тепловой энергией kТ. В таблице представлены величины
мал по сравнению с тепловой энергией kТ. В таблице представлены величины  для некоторых двухатомных молекул.
для некоторых двухатомных молекул.
| Молекула |
|
| H2 | 85,4 |
| D2 | 43 |
| HD | 64 |
| H2 | 2,9 |
| O2 | 2,1 |
| Cl2 | 0,36 |
| NO | 2,4 |
| HCl | 15,2 |
В этом случае в сумме Zвр основную роль играют члены с большими числами К. Но при больших значениях К вращение молекулы квазиклассично. Поэтому в этом случае статистическая сумма Zвр может быть замечена соответствующим классическим интегралом по К:
 .
.
Отсюда свободная энергия
 .
.
Таким образом при рассматриваемых не слишком низких Т вращательная часть теплоемкости оказывается равной k (в соответствии с общим результатом классического рассмотрения по k/2 на каждую степень свободы):
 ,
,  ,
,  ,
,  .
.
Мы увидим ниже, что существует значительная область температур, в которой выполнено условие  и в то же время колебательная часть свободной энергии, а значит и колебательная часть теплоемкости отсутствуют. В этой области теплоемкость двухатомного газа, приходящаяся на одну молекулу, равна
и в то же время колебательная часть свободной энергии, а значит и колебательная часть теплоемкости отсутствуют. В этой области теплоемкость двухатомного газа, приходящаяся на одну молекулу, равна
 ,
,  .
.
Рассмотрим теперь обратный предельный случай низких температур, когда
 .
.
В этом случае достаточно сохранить две первых члена суммы, поскольку именно они будут вносить наибольший вклад.
 .
.
В этом приближении свободная энергия будет равна
 .
.
Отсюда энтропия:
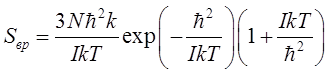
и теплоемкость
Если Вам понравилась эта лекция, то понравится и эта - 3 Борьба против ордынского ига в правление Д.И. Донского.
 .
.
Таким образом, вращательная энтропия и теплоемкость газа при T ® 0 обращаются в ноль в основном по экспоненциальному закону. При низких температурах, следовательно, двухатомный газ ведет себя как одноатомный (говорят, что в этом случае вращательные степени свободы «заморожены»).
В общем случае произвольных температур сумма  может быть рассчитана только численно. На рис. приведен график cвр (в единицах k) как функции безразмерной величины
может быть рассчитана только численно. На рис. приведен график cвр (в единицах k) как функции безразмерной величины  .
.
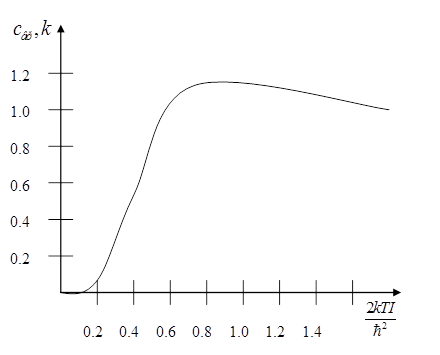
Рис. 2.2
Вращательная теплоемкость имеет максимум, равный 1,1 при  , после чего асимптотически приближается к классическому значению 1.
, после чего асимптотически приближается к классическому значению 1.




















