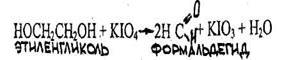Группа веществ, изолируемых дистилляцией
3. Группа веществ, изолируемых дистилляцией («ЛЕТУЧИЕ ЯДЫ»)
В данной главе дана общая характеристика группы «летучих ядов»; основы перегонки с водяным паром (для простых и азеотропных смесей). Определены объекты судебно-химического исследования; основы пробоподготовки; необходимая аппаратура и техника перегонки для проведения анализа на группу «летучих ядов». Рассмотрены современные методы изолирования, их характеристика, дана сравнительная оценка методам (рассмотрена дистилляция с водяным паром, микроперегонка и микродиффузия).
Определено токсикологическое значение некоторых летучих ядов. Показано использование химических реакций при обнаружении «летучих ядов».
Отдельно рассмотрено обнаружение цианидов методом микродиффузии. Показано количественное определение цианидов. Рассмотрено обнаружение алкилгалогенидов, альдегидов и кетонов, фенола, уксусной кислоты.
Отдельно рассмотрены спирты, токсикокинетика спиртов, распределение в организме, биотрансформация, экскреция. Определены объекты исследования при проведении анализа на спирты. Рассмотрены правила отбора проб у живых лиц, трупного материала. Показаны химические свойства спиртов, химические реакции для обнаружения спиртов в дистилляте (метанола, этанола, изоамилового спирта, пропилового, бутилового спиртов и этиленгликоля).
Особое внимание уделяется этиловому спирту. Показаны свойства, механизм действия на организм человека; его токсичность. Определены проблемы и распространенность алкоголизма, экспертиза алкогольного опьянения, клиника отравлений этиловым спиртом. Выделены методы анализа, применяемые в определении наркотического опьянения (качественно-количественные). Показаны предварительные качественные пробы на этиловый алкоголь при исследовании выдыхаемого воздуха и биологических жидкостей (проба Рапопорта А.М., индикаторные трубки Мохова – Шинкаренко).
Показана необходимость количественного определения спиртов (химические и современные биохимические методы исследования; газохроматографический метод исследования этилового спирта).
4.1. ОБЩАЯ ХАРАКТЕРИСТИКА ГРУППЫ
Рекомендуемые материалы
В химико-токсикологическом анализе деление токсикологически важных веществ на группы основано на способах их изолирования из исследуемого объекта. Таких групп насчитывается шесть, причем три из них подлежат обязательному судебно-химическому исследованию при проведении полного (общего) судебно-химического анализа.
Одной из групп токсикологически важных веществ, подлежащих обязательному исследованию, являются «летучие яды», или вещества, изолируемые дистилляцией. Все они изолируются из биологического объекта одним из наиболее старых и широко используемых методов дистилляцией - перегонкой с водяным паром.
В группу «летучих ядов» входят вещества, различные по своей химической природе:
1. Синильная кислота HCN имеет собственную низкую температуру кипения + 26,5°С и занимает первое место по своей летучести с водяным паром.
2. Алкилгалогениды:
СНС13
(хлороформ)
Cl3C-CH(OH)2
(хлоралгидрат)
ССl4
(четыреххлористый углерод)
C2H4CI2
(дихлорэтан)
C2Cl6
(гексахлорэтан)
- Альдегиды и кетоны алифатического ряда:
СН2О (формальдегид)
СНз-СО-СНз (ацетон)
4. Алканолы (спирты):
СНзОН (метанол)
С2Н5ОН (этанол)
С3Н7ОН (пропанол)
С4Н9ОН (бутанол)
С5Н 11ОН (пентанол)
диолы СН2 ОН -СН2 ОН (этиленгликоль)
5. Сложные эфиры алифатического ряда:
CH3COOC2H5 (амилацетат)
6. Карбоновые кислоты алифатического ряда:
CH3COOH (кислота уксусная)
CH3-СНOH-СООН (кислота молочная или альфа-оксипропионовая)
7. Сероуглерод CS2
8. Элементоopгaнические соединения жирного ряда:
(C2H5)4Pb (тетраэтилсвинец)
9. Ароматические углеводороды:
С6Н6 (бензол)
CH3-С6Н5 (толуол)
ксилолы (содержат два радикала -СНз в бензольном кольце в различных положениях)
10. Нитро- и аминопроизводные ароматического ряда:
С6Н5NО2 (нитробензол)
С6Н5NH2 (анилин)
11. Оксипроизводные ароматического ряда:
С6Н5ОН (фенол)
крезолы
кислота салициловая (о-оксибензойная)
12. Фосфор и первые продукты его окисления и восстановления
Н3РО2 (кислота фосфорноватистая)
Н3РО3 (кислота фосфористая)
PH3 (фосфин)
ФОСы (эфиры фосфорных кислот)
13. Жидкие алкалоиды:
кониин
никотин
анабазин
Из перечисленных соединений согласно действующего до настоящего времени приказа Минздрава СССР №1021 от 25.12.73 г., в обязательный круг химико - токсикологического исследования при проведении общего анализа включены:
1. Кислота синильная.
2. Алкилгалогениды: хлороформ, дихлорэтан.
3. Альдегиды: формальдегид.
4. Алканолы: метанол, этанол, пропанол, бутанол, пентанол, изоамиловый спирт.
5. Оксипроизводные ароматического ряда: фенол, крезолы.
По физическим свойствам «летучие» яды, в основном, представляют собой летучие жидкости (за исключением таких твердых веществ, как хлоралгидрат, фенол, салициловая кислота, фосфорорганические соединения).
Способность химических соединений перегоняться с водяным паром зависит от их физических свойств. С водяным паром перегоняются некоторые жидкости, практически не смешивающиеся или ограничено смешивающиеся с водой, азеотропные смеси. Известны также вещества (метанол, ацетон, уксусная кислота, этиленгликоль и др.), которые смешиваются с водой и перегоняются с водяным паром, но не образуют азеотропных смесей.
При перегонке смесей органических веществ большое значение имеет их взаимная растворимость. При этом возможны 3 случая:
1 Жидкости взаимно не растворимы, т.е. образуют двухфазную систему. При перегонке с водяным паром одной из фаз является вода.
2. Жидкости ограниченно растворимы друг в друге, т.е. двухфазная система образуется только при определенных соотношениях компонентов. Такую систему образуют с водой толуол, нитробензол, дихлорэтан, тетраэтилсвинец и др.
3. Компоненты смешиваются в любых соотношениях, т.е. вещества растворимы в воде, образуется однофазная система. С водой такую систему образуют метанол, ацетон, формальдегид, этиленгликоль, уксусная кислота.
В случае образования двухфазной системы (жидкости, не растворимые или ограниченно растворимые в воде) при нагревании смеси давление пара каждой жидкости будет таким же, как и давление ее пара в чистом виде, независимо от наличия другой жидкости. Каждая жидкость в смеси будет вести себя так, как будто отсутствует другая жидкость.
В основе перегонки взаимонерастворимых веществ с водяным паром лежит закон Дальтона.
Согласно этому закону общее давление паров смеси (упругость) равно сумме парциальных давлений (упругостей) ее компонентов при данной температуре.
Р общее = Р воды +Р вещества
При нагревании компоненты смеси увеличивают упругость своих паров независимо друг от друга. Когда общее давление достигнет атмосферного и превысит его на незначительную величину смесь закипает и начинает перегоняться, при этом температура кипения смеси ниже температур кипени каждого из её компонентов в чистом виде за счет сложения их парциальные давлений.
Поскольку одним из компонентов является вода, то вещества буду перегоняться при t°<1000C. Особенно удобна дистилляция с водяным паром в тех случаях, когда изолируемое вещество имеет очень высокую температуру кипения или же разлагается при своей температуре кипения.
Так, для того, чтобы перегонять анилин в чистом виде, требуется нагреть его до температуры кипения, равной 184°С, в смеси же с водой он перегоняется при температуре 75°С.
Такое токсичное вещество, как тетраэтилсвинец, разлагается при своей температуре кипения, равной 200°С.
Кроме того, при проведении судебно-химического исследования сильный нагрев нежелателен, т.к. при высокой температуре может произойти подгорание органических веществ исследуемого объекта и образование следовых количеств синильной кислоты, что приведёт к ложноположительным результатам анализа.
Таким образом, при дистилляции с водяным паром понижается температура кипения перегоняемых соединений и устраняется опасность их термического разложения.
Для многих органических веществ способность перегоняться с водяным может быть объяснена образованием с водой азеотропных (нераздельнокипящих) смесей, состав которых не меняется при перегонке (например, 96% этанола и 4% воды).
Азеотропными называются смеси, у которых пар, находящийся в равновесии с жидкостью, обладает теми же свойствами, что и сама жидкая смесь. Они перегоняются при постоянной температуре и не могут быть разделены простой или фракционной перегонкой.
Из веществ, летучих с водяным паром и представляющих токсикологический интерес азеотропные смеси образуют: алкилгалогениды (хлороформ, ССl4)
§ этиловый и изоамиловый спирты
§ фенол, анилин и др.
В случае образования однофазной системы (жидкости растворимы в воде), если индивидуальная температура кипения вещества низкая (ацетон, метиловый спирт), то оно перегоняется быстро и полностью.
При высокой t°кип обычно полноты отгонки не достигается, при этом приходится использовать селективные переносчики, чтобы образовалась низкокипящая смесь. Так, при перегонке этиленгликоля с водяным паром в качестве селективного переносчика используют бензол, а для уксусной кислоты – гептан. При этом, если температура кипения этиленгликоля составляет 197°С, то смесь этиленгликоль-вода-бензол перегоняется при 118° С. Для уксусной кислоты соответственно 118° С и 80° С.
Оценка метода: очень простой, быстрый, экономичный, не требует специальной аппаратуры. Анализируемые вещества изолируются в чистом виде, только сильно разбавлены водой, поэтому перегонку с водяным паром можно рассматривать не только как метод изолирования, но и как метод очистки.
Объекты судебно-химического исследования. Пробоподготовка
В качестве объектов судебно-химического исследования с целью обнаружения «летучих ядов» на экспертизу обычно направляются внутренние органы трупа, кровь, моча. При подозрении на отравление хлорорганическими веществами дополнительно направляется сальник и 1/3 головного мозга, метанолом - 1/3 головного мозга, этанолом - кровь из крупных вен, моча, мышечная ткань.
Объекты помещают в банки, которые герметично закрывают и опечатывают и немедленно пересылают в лабораторию для исследования. При подозрении на отравление этанолом задержка с транспортировкой материала на 5-10 суток может служить причиной недостоверных результатов его количественного определение.
Методика: Объект в количестве 100 г тщательно измельчают, смешивают с водой до густой кашицы, помещают в круглодонную колбу таким образом, чтобы она заполнилась не более чем на 1/3 её объема, подкисляют кислотой щавелевой или виннокаменной до рН 2-3 и подвергают перегонке.
Подкисление объекта органической кислотой проводят с той целью, чтобы превратить нелетучие соли синильной кислоты (цианиды калия, натрия), в виде которых она находится в биологическом объекте, в свободную HCN, являющуюся легко летучим соединением.
NaCN-------->HCN
В данном случае нельзя воспользоваться сильными минеральными кислотами, т.к. это привело бы:
1) к разрушению молекулы HCN (гидролиз), что приведет к eё потере и недооткрытию.
2) к переоткрытию фенола в результате гидролиза его сернокислых эфиров, (являющихся нормальной частью биологического материала).
4.2. СОВРЕМЕННЫЕ МЕТОДЫ ИЗОЛИРОВАНИЯ «ЛЕТУЧИХ ЯДОВ»
Аппаратура и техника перегонки
Дистилляция с водяным паром проводится в специальном приборе, который состоит из трех основных частей: герметично соединенных друг с другом:
1. Парообразователь
2. Колба с исследуемым объектом (помещается на водяную баню)
3. Холодильник с приемником
Сборку установки начинают со стороны приемника, в последнюю очередь к колбе с исследуемым объектом присоединяют заранее нагретый парообразователь (разборка ведется в обратном порядке). Водяную баню, в которой стоит колба с объектом, также нагревают, чтобы избежать конденсации водяного пара.
Дистилляцию проводят медленно, так, чтобы можно было считать капли отгона
Собирают 2-3 дистиллята. Первый в количестве 1-3 мл собирают в приемник с 5% раствором натрия гидроксида для улавливания легколетучей синильной кислоты и превращения ее в нелетучий цианид натрия. При этом алонж холодильника должен быть погружен в раствор NaOH, чтобы избежать потерь летучей HCN. Весь первый дистиллят используют для обнаружения синильной кислоты.
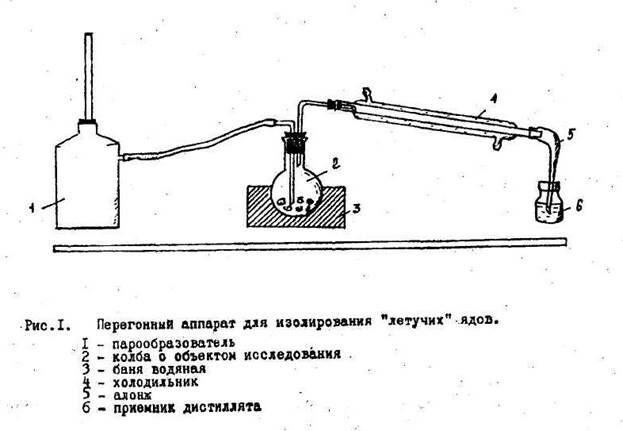
Второй (и третий) дистиллят собирают в пустой, чистый приемник в количестве 20-30 мл и используют для обнаружения всех остальных веществ из группы «летучих ядов». Двух-трех отгонов обычно бывает достаточно для качественного исследования.
При проведении исследования на группу «летучих» ядов, необходимо
обращать внимание на следующее:
1. Запах объекта (иногда это может дать какие-либо дополнительные ориентирующие данные). Правда, запах биологического объекта, как правило, маскирует запах летучего ядовитого вещества, но в некоторых случаях все же возможно определение запаха искомого соединения. Например, изоамиловый спирт придает объекту запах сивушных масел, нитробензол и синильная кислота запах горького миндаля.
2. Запах и внешний вид дистиллята. Перед выполнением химического исследования обязательно проводят наружный осмотр дистиллята, обращая внимание на его прозрачность или мутность, наличие капель на дне склянки или маслянистой пленки на поверхности жидкости, наличие характерного запаха.
Так изоамиловый спирт легче воды и плохо смешивается с ней, поэтому при содержании значительных количеств изоамилового спирта дистиллят обладает характерным раздражающим запахом сивушных масел и иногда содержит на поверхности маслянистые капли или даже два слоя этого вещества.
Присутствие в отгоне фенола можно обнаружить по характерному запаху карболовой кислоты и молочновидному помутнению, поскольку фенол плохо растворим в воде. При больших количествах фенола на дне приемника могут присутствовать бесцветные или розоватые капли (продукты окисления фенола).
Хлороформ и четыреххлористый углерод тяжелее воды и не смешиваются с ней, поэтому на дне приемника можно наблюдать бесцветные капли или слой этих веществ.
Исследование дистиллятов с целью идентификации веществ из группы «летучих ядов» традиционно строится на использовании микрохимических реакций. Так, реакция образования берлинской лазури, которая является высокочувствительной и специфичной для доказательства синильной кислоты имеет положительное судебно-химическое значение (т.е. на основании одной этой реакции можно дать положительное заключение о наличии в исследуемом объекте HCN). Она является особенно ценной еще и потому, что образующийся характерный осадок может быть представлен в качестве вещественного доказательства судебно-следственным органам.
Известно, что общей реакцией на алкилгалогениды является реакция отщепления органически связанного хлора. Реакция достаточно чувствительна, но не специфична. О таких реакциях принято говорить, что они имеют отрицательное судебно-химическое значение.
Заключение о присутствии того или иного из «летучих ядов» делается на основании комплекса реакций.
Кроме перегонки с водяным паром в токсикологической химии применять еще два метода дистилляции:
1. Микроперегонка
2. Микродиффузия
Микроперегонка. В последние годы исследование токсикологически важных «летучих» веществ все шире проводится методом газожидкостной хроматографии. Для изолирования в этом случае используется микроперегонка, поскольку количество объекта составляет 1-5 г.
Метод основан на ускоренной диффузии «летучих» веществ биологической пробы при повышенной температуре в присутствии сильных электролитов и проводится в герметически закрытом флаконе. Парогазовая фаза отбирается микрошприцем и используется для анализа.
Микродиффузия. Не потерял своего значения и метод микродиффузии, позволяющий обнаружить малые количества в объекте. Прибор для микродиффузии представляет собой небольшой круглый толстостенный сосуд из стекла, внутри которого расположен второй сосуд меньшего диаметра. Таким образом, имеется внутренняя круговая стенка и наружная кольцевая камеры. К верхнему краю герметично пришлифовывается крышка.
Исследуемый объект вносится в наружную камеру, а поглощающая жидкость - во внутреннюю. К объекту в наружную камеру на расстоянии 2-3 см от него помещают раствор вещества-электролита, который способствует переходу летучего соединения в пространство прибора. Прибор закрывают крышкой, слегка наклоняют для смешивания объекта и электролита, после чего оставляют на время, необходимое для диффузии. При этом летучие вещества из объекта сначала переходят в пространство прибора, а затем в растворитель во внутренней камере (или в раствор реактивов, реагирующих с этими веществами). В этой жидкости их и определяют.
На скорость перехода летучих веществ в пространство прибора влияют некоторые электролиты. Так, прибавление раствора калия карбоната к крови или тканям, содержащим этанол, ускоряет его диффузию.
4.3. ТОКСИКОЛОГИЧЕСКОЕ ЗНАЧЕНИЕ НЕКОТОРЫХ ЛЕТУЧИХ ЯДОВ
4.3.1.СИНИЛЬНАЯ КИСЛОТА (цианистый водород, нитрил муравьиной кислоты)
Синильная кислота HCN представляет собой бесцветную, подвижную жидкость с запахом горького миндаля. Т. кип. 25,65 °С. Смешивается с водой и многими органическими растворителями (спирты, эфиры, ароматические углеводороды, четыреххлористый углерод и др.). Синильная кислота - слабая кислота, образует с металлами соли - цианиды.
В свободном и связанном виде синильная кислота встречается в растениях, чаще всего в виде гликозида амигдалина, содержится в коксовом газе, табачном дыме, образуется при термическом разложении найлона, полиуретанов и др.
Синильную кислоту применяют в производстве цианидов, хлорциана,
акрилонитрила, акрилатов, аминокислот, гидроксинитрилов, как фумигант.
Сильно токсична, задерживает окислительные и ферментативные процессы,
связывает гемоглобин в циангемоглобин, парализует дыхательный центр и вызывает удушье; проникает через неповрежденную кожу.
Цианиды калия и натрия - реагенты для извлечения серебра и золота из руд, реактивы в комплексонометрическом анализе для определения серебра, никеля и ртути, компоненты электролитов для очистки платины от серебра и для гальванического золочения и серебрения. Высокотоксичны, вызывают удушье вследствие паралича тканевого дыхания. Порошки и растворы KCN раздражают кожу.
Качественное обнаружение синильной кислоты
1. Реакция образования берлинской лазури
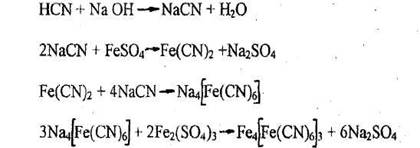
Появление синего осадка или синей окраски указывают на наличие синильной кислоты. При малых количествах синильной кислоты в растворах окраска появляется только через 24-48 час.
При изучении данной реакции следует проделать ее несколько раз со все уменьшающейся концентрацией исследуемого вещества в растворе.
Чувствительность реакции - 20 мкг синильной кислоты в 1 мл раствора. Реакция специфична и имеет положительное судебно-химическое значение.
2. Реакция образования роданида железа
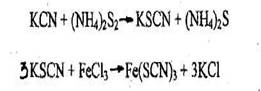
Появление кроваво-красной окраски указывает на наличие цианидов в растворе. При взбалтывании окрашенного раствора с диэтиловым эфиром окраска переходит в эфирный слой.
Чувствительность реакции - 10 мкг синильной кислоты в 1 мл.
Обнаружение цианидов методом микродиффузии
Метод микродиффузии обнаружения синильной кислоты и её солей основан на реакции с пиридином и барбитуровой кислотой. Суть реакции заключается в расщеплении пиридинового цикла при действии хлорамина Т в щелочной среде - с образованием производного глутаконового альдегида. Производное глутаконового альдегида малоустойчивое соединение, существующий в двух таутомерных формах, который далее конденсируется с барбитуровой кислотой с образованием окрашенного соединения.
В наружную камеру прибора для микродиффузии вносят 2-4 мл крови
или мочи (или 1 г гомогената ткани), прибавляют 3-4 капли 10 % раствора
кислоты серной. Во внутреннюю камеру прибора наливают 3,3 мл 0,1 моль/л
раствора натрия гидроксида. Прибор плотно закрывают крышкой и оставляют на 3-4 ч при комнатной температуре. Затем из внутренней камеры берут 1 мл жидкости, прибавляют 1 мл 0,1 моль/л раствора натрия гидроксида , 2 мл 1 моль/л раствора натрия гидрофосфата и 1 мл 0,25 моль/л раствора хлорамина Т. Жидкость взбалтывают и через 2-3 мин прибавляют 3 мл реактива, содержащего барбитуровую кислоту и пиридин. Смесь взбалтывают и оставляют на 10 мин. Появление красной окраски указывает на присутствие цианидов в исследуемой жидкости.
Количественное определение
Для количественного определения изолирование синильной кислоты
проводят из отдельной навески биологического материала. Перегонку ведут до тех пор, пока последняя порция дистиллята не перестанет давать реакции образования берлинской лазури. При исследовании свежего биологического материала можно использовать титриметрический метод анализа. Весовой метод применяют к свежему и загнившему биологическому материалу.
1. Титриметрический метод. Метод основан на взаимодействии синильной кислоты с 0,1 моль/л (или 0,01 моль/л при малых количествах синильной кислоты) раствором серебра нитрата. Непрореагировавший серебра нитрат оттитровывают 0,1 моль/л (или 0,01 моль/л) раствором аммония или калия тиоцианата, индикатор - железо-аммониевые квасцы.
2. Весовой метод. Дистиллят собирают в 2-3 приёмника, соединенных между собой и содержащих 0,2 % раствор серебра нитрата. По окончании отгонки содержимое приёмников обмывают водой очищенной и промывные воды присоединяют к основной жидкости. Раствор подкисляют кислотой азотной до кислой реакции по лакмусу и осадок количественно переносят на фильтр. Полученный осадок промывают раствором аммиака для растворения серебра цианида от нерастворимого в нём серебра сульфида. Фильтрат подкисляют кислотой азотной разбавленной до резко кислой реакции (рН1-2) на лакмус, выделившийся осадок серебра цианида отфильтровывают, промывают водой очищенной и высушивают вместе с фильтром. Затем фильтр сжигают и осадок прокаливают во взвешенном фарфоровом тигле до постоянного веса.
Осадок металлического серебра взвешивают и пересчитывают на кислоту синильную по формуле:
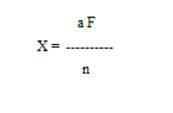
где X - количество исследуемого вещества в мг;
а - вес весовой формы в мг;
F - коэффициент пересчёта, равный для синильной кислоты (по серебру);
n - навеска исследуемого вещества в г.
4.3.2. АЛКИЛГАЛОГЕНИДЫ
Алкилгалогениды находят широкое применение в лакокрасочной, кожевенной, электротехнической, фармацевтической промышленности; при приготовлении полимерных материалов как пластификаторы, мономеры и сополимеры. Используются в качестве растворителей, в том числе для обезжиривания и экстрагирования жиров и эфирных масел, хладагентов, пестицидов, в органическом синтезе, при производстве каучука, резинотехнических изделий.
Почти все хлорпроизводные алканов опасные яды. Максимальная смертность отмечается при отравлениях хлороформом, четырёххлористым углеродом, 1,2-дихлорэтаном. В картине отравления помимо фазы наркоза, которая проявляется преимущественно при ингаляционных отравлениях, выделяют и токсическую. Токсическая фаза, протекающая с поражением печени, почек и ЦНС, наиболее выражена при приёме хлорпроизводных алканов внутрь, но отмечается и при других путях поступления. Токсичность хлорпроизводных алканов усиливается при одновременном или предварительном действии этанола, как при ингаляции, так и при внутрижелудочном введении. Потенцирующее действие отмечается при комбинации хлорпроизводных алканов и с другими алифатическими спиртами.
Усиление загрязнения окружающей среды хлорпроизводными углеводородов - вероятная причина роста раковых заболеваний.
Поступают в организм при ингаляции, перорально, через кожные покровы.
Определение летучих хлорпроизводных алканов в выдыхаемом воздухе основано на последовательном применении ГХ и масс-спектрометрии. Используют также ГЖХ и хромато-масс-спектрометрический метод. В воде -ГХ и спектрофотометрические. В биологическом материале определяют ГХ и масс-спектрометрическими методами. Применяют также хроматографию в тонком слое. Сохраняют значение методы, основанные на реакции Фудживара - окрашивание раствора пиридина при взаимодействии с хропроизводными углеводородов в щелочной среде.
4.3.2.1.ХЛОРОФОРМ(трихлорметан) СНСl3
Хлороформ представляет собой бесцветную прозрачную жидкость с резким характерным запахом, сладковатым, жгучим вкусом; т. кип. 61,1°С; образует азеотропную смесь с водой (т. кип. 56,2 °С, 97,4 % хлороформа). Используют хлороформ главным образом для производства хладона 22, как растворитель, хладагент, в синтезе лекарственных препаратов. Ранее применялся в медицине как средство для наркоза. Хлороформ - негорюч, на свету разлагается, особенно при контакте с открытым пламенем, образуя фосген. Вызывает наркоз. Обладает гепатотропным, нефротоксическим и кардиотоксическим действием; вызывает канцерогенный и мутагенный эффекты; раздражает слизистые оболочки.
Качественное обнаружение
- Реакция отщепления атомов хлора
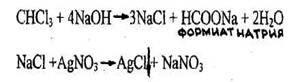
Появляется белый осадок, растворимый в растворе аммиака. Параллельно проводят пробу в тех же условиях с 1 мл исследуемого раствора и натрия гидроксидом, но без нагревания (для исключения ионов хлора в исследуемом растворе).
Реакция не специфична, является общей для всех хлорпроизводных. Чувствительность реакции 0,2 мг.
- Реакция с резорцином в щелочной среде
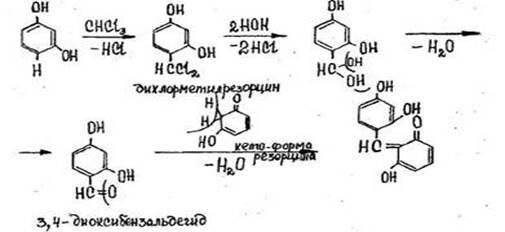
После нагревания пробирки на кипящей водяной бане в течение 5-10 мин. появляется розовая или малиновая окраска. Параллельно выполняется контрольный опыт («слепой» опыт), цель которого - исключить ошибки за счет продуктов окисления резорцина, окрашенных в зеленый цвет и маскирующих розовое окрашивание.
Реакция не специфична, ее дают все хлорпроизводные, кроме дихлорэтана, а также формальдегид.
- Реакция образования изонитрила
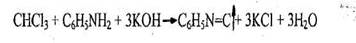
Появляется резкий раздражающий запах изонитрила. Реакция не специфична, ее дают все хлорпроизводные, за исключением дихлорэтана.
Чувствительность реакции 0,01 мг.
- Реакция с реактивом Фелинга.
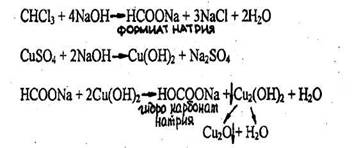
Выпадает желтый осадок гидрооксида меди (Cu(OH)2), переходящий в красный осадок закиси меди (Cu2O).
Реакция не специфична, ее дает хлороформ, хлоралгидрат и формальдегид. Не дают четыреххлористый углерод и дихлорэтан. Чувствительность реакции 3 мг.
4.3.2.2. ХЛОРАЛГИДРАТ (2,2,2-трихлорэтандиол-1,1) СС13СН(ОН)2
Бесцветные, прозрачные кристаллы или мелкокристаллический порошок с характерным острым запахом, слегка горьковатого вкуса. Т.пл. 51,4 °С, т. кип. 97,5 °С. Растворим в этаноле, диэтиловом эфире, слабо растворим в бензоле, сероуглероде.
Применяют как успокаивающее внутрь и ректально, как снотворное и противосудорожное средство.
Признаки острого отравления при передозировке: глубокий сон, затем наркотическое состояние, ослабление дыхания и падение сердечной деятельности.
Качественное обнаружение
Хлоралгидрат дает все реакции, которые используют для обнаружения хлороформа (см. реакции 1-4), т.к. они проводятся в присутствии щелочи, под влиянием которой хлоралгидрат разлагается с выделением хлороформа:
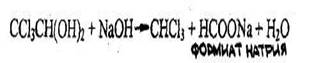
Для отличия хлоралгидрата от хлороформа используются следующие пробы:
- Реакция с реактивом Несслера
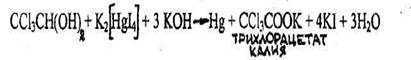
Образуется кирпично-красный осадок, который затем становится грязно-зеленым. Другие хлорпроизводные этой реакции не дают.
Реакция не специфична, ее дают альдегиды и другие восстановители.
2. Экстракция из дистиллята (при положительном результате проведённых реакций 1-4).
Часть дистиллята 2-3 раза встряхивают в делительной воронке с порциями эфира по 5 мл, эфирные вытяжки соединяют и фильтруют через сухой фильтр в фарфоровую чашку. Фильтрат выпаривают досуха при комнатной температуре под тягой. Если в дистилляте был хлороформ, то он улетучивается вместе с эфиром. При наличии хлоралгидрата в чашке остается остаток кристаллического вещества. Для подтверждения хлоралгидрата в остатке к нему прибавляют 2-Змл воды и полученный раствор подвергают исследованию при помощи вышеуказанных реакций.
4.3.2.3. ЧЕТЫРЕХХЛОРИСТЫЙ УГЛЕРОД (тетрахлорметан) ССl4
Бесцветная жидкость с резким сладковатым запахом, т. кип. 76,7 °С, образует азеотропную смесь с водой (т. кип. 66 °С, 95,9 % четыреххлористого углерода). Четыреххлористый углерод - сырье для производства хладонов, растворитель, огнетушащее средство. Четыреххлористый углерод - негорюч, взрыво- и пожароопасен. Ядовит при вдыхании, попадании внутрь через желудочно-кишечный тракт или всасывании через кожные покровы и слизистые оболочки; обладает канцерогенным, мутагенным, тератогенным, эмбриотропным действием.
Качественное обнаружение
1. Реакция отщепления хлора (методика описана выше).
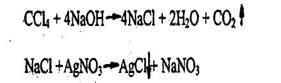
2. Реакция с резорцином в щелочной среде (методика описана выше - см. 4.3.2.1)
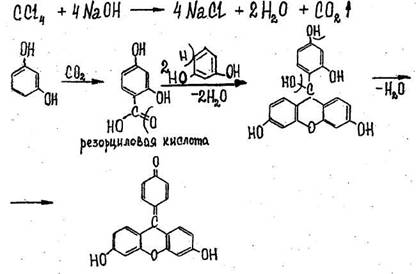
3. Реакция образования изонитрила (методика описана выше - см. 4.3.2.2)

В отличие от хлороформа и хлоралгидрата четыреххлористый углерод не дает реакции с реактивом Фелинга, т.к. в процессе нагревания с раствором щелочи не образуется веществ, обладающих восстановительными свойствами.
Заключение о наличии четыреххлористого углерода в дистилляте делают при положительном результате реакций 1-3 и отсутствии результата реакции с реактивом Фелинга.
4.3.2.4. 1.2 -ДИХЛОРЭТАН (хлористый этилен) CICH2CH2CI
Бесцветная жидкость со сладковатым запахом; т. кип. 83,47 °С, образует азеотропную смесь с водой (т. кип. 71,6 °С, 91,8 % дихлорэтана). Используют дихлорэтан главным образом для производства винилхлорида, а также этилендиамина, этиленгликоля, полисульфидных каучуков; как растворитель, фумигант. Дихлорэтан может вызывать психические расстройства, поражения печени и почек, головокружение и рвоту при попадании внутрь или при воздействии паров в концентрациях, превышающих ПДК, равную 10 мг/м3.
Качественное обнаружение
- Реакция отщепления хлорид - ионов в жестких условиях (при длительном кипячении со спиртовым раствором щелочи или при нагревании под давлением).
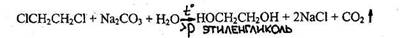
Хлорид-ион доказывают реакцией с нитратом серебра.
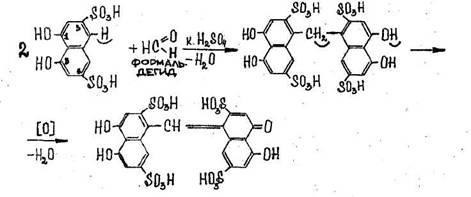
- Реакция образования этиленгликоля и обнаружение его после переведения в формальдегид
![]()
Наличие образовавшегося в процессе реакции формальдегида определяют при помощи реакции с хромотроповой или фуксинсернистой кислотами.
Чувствительность реакции 0,4 мг.
- Реакция образования ацетиленида меди
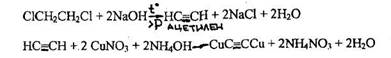
При нагревании 1,2-дихлорэтана в запаянной ампуле с раствором натрия гидроксида образуется ацетилен, который при взаимодействии с солями меди дает ацетиленид меди, имеющий розовую или вишнево-красную окраску.
Реакция специфична: другие галогенпроизводные ее не дают. Чувствительность реакции 0,25 мг.
Для отличия 1,2-дихлорэтана от хлороформа, хлоралгидрата и четыреххлористого углерода могут быть использованы изонитрильная реакция, реакция с резорцином и реактивом Фелинга, которых дихлорэтан не дает.
Реакции обнаружения хлорпроизводных, имеющих токсикологическое значение
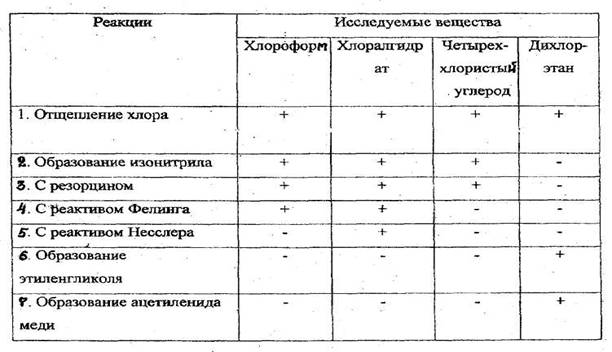
4.3.3. АЛЬДЕГИДЫ И КЕТОНЫ
4.3.3.1. ФОРМАЛЬДЕГИД (муравьиный альдегид, метаналь) НСНО
Формальдегид представляет собой бесцветный газ с резким раздражающим запахом. Хорошо растворим в воде, спиртах и других полярных растворителях. Чистый газообразный формальдегид относительно стабилен при 80-100 °С, при температурах ниже 80 °С полимеризуется; процесс ускоряется в присутствии полярных растворителей, в том числе воды.
Формалин - водный раствор формальдегида (обычно 37 - 40 %), содержащий 6-15 % метанола (ингибитор полимеризации формальдегида). Представляет собой бесцветную жидкость с характерным острым запахом.
Формальдегид используют в органическом синтезе, в производстве синтетических смол и пластмасс, для синтеза многих лекарственных средств и красителей, для дубления кож, как дезинфицирующее, антисептическое и дезодорирующее средство.
При вдыхании воздуха, содержащего большое количество формальдегида, развиваются явления острого отравления со слезотечением, резким кашлем, чувством стеснения в груди. При приёме внутрь (в большинстве случаев ошибочном) в результате всасывания формальдегида наблюдается потеря сознания, судороги, угнетение нервных центров, раздражение почек.
Качественное обнаружение
1. Реакция с резорцином в щелочной среде
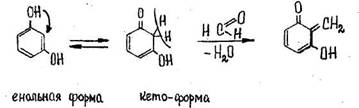
Появляется розовая или малиновая окраска.
Реакция не специфична (дают алкилгалогениды и др.).
Чувствительность 0,03 мкг.
2. Реакция с реактивом Фелинга
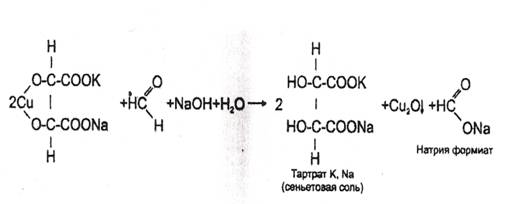
В пробирку вносят 1 мл исследуемого раствора, прибавляют 1--2 кап. 10% раствора гидроксида натрия до щелочной реакции (по лакмусу), а затем добавляют 2-3 кап. реактива Фелинга (готовится перед употреблением путем смешивания равных количеств растворов Фелинга №1 и №2). Жидкость сильно взбалтывают и нагревают. При охлаждении на дне пробирки виден желтый или красный осадок оксида меди (I).
Реакция не специфична (дают алкилгалогениды и другие). Имеет отрицательное судебно-химическое значение.
3. Реакция с фуксинсернистой кислотой (реактив Шиффа)
Появляется сине- или красно-фиолетовая окраска, иногда не сразу, а через 10-15 мин.
Чувствительность реакции 0,03 мкг.
4. Реакция с кодеином и концентрированной серной кислотой
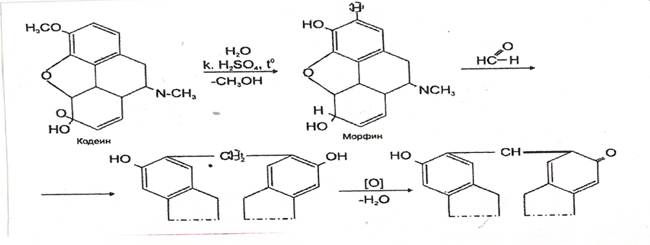
Через 5-10 мин. появляется сине – или красно-фиолетовое окрашивание.
Реакция специфична, имеет положительное судебнохимическое значение.
Чувствительность реакции 0,02 мкг.
- Реакция с хромотроповой кислотой (1,8-диоксинафталтн-3,6-дисульфокислота) в присутствии концентрированной серной кислоты
В фарфоровую чашку вносят 1 мл исследуемого раствора, а затем прибавляют 5 мл концентрированной кислоты серной и несколько кристаллов кислоты хромотроповой. Наблюдается фиолетовая или красно-фиолетовая окраска.
Реакция специфична, имеет положительное судебно-химическое значение. Чувствительность 1 мкг.
- Реакция восстановления ионов серебра (реакция «серебряного зеркала»)
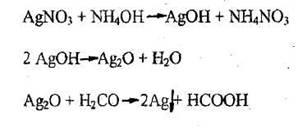
Реакция не специфична, имеет отрицательное судебно-химическое значение.
Чувствительность реакции - сотые доли микрограмма.
4.3.3.2. АЦЕТОН (2-пропанон, диметилкетон) СН3СОСН3
Ацетон представляет собой летучую бесцветную жидкость, с характерным запахом; т. кип. 56,1 °С. Смешивается с водой и органическими растворителями, например эфиром, метанолом, этанолом, сложными эфирами.
Ацетон - широко применяемый растворитель органических веществ, служит сырьем для синтеза многих соединений.
При вдыхании ацетон накапливается в организме, так как выводится из организма медленно, возможны хронические отравления. Вдыхание больше, концентраций ацетона может вызвать глубокое угнетение ЦНС, коллапс и кому. Смерть может наступить от остановки дыхания или острой сердечной недостаточности. Прием внутрь вызывает резкое раздражение слизистой оболочки желудочно-кишечного тракта, может развиться токсический гепатит, возможно нарушение функции почек. Тяжелое отравление ацетоном может развиться и при его аппликации на кожу.
Качественное обнаружение
1.Реакция образования йодоформа
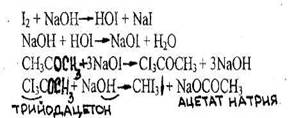
Образуется желтый осадок йодоформа.
В отличие от этанола ацетон дает реакцию в мягких условиях - без нагревания и со слабой щелочью.
Чувствительность реакции 0,1 мг. Реакция имеет отрицательное судебно-химическое значение, ее дает этиловый спирт.
1. Реакция с нитропруссидом натрия
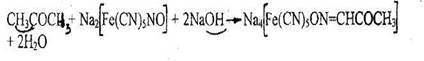
Появляется оранжево-красное окрашивание, переходящее при добавлении 10% раствора уксусной кислоты в красно-фиолетовое или вишнево-красное.
Реакция не специфична для ацетона, ее дают другие альдегиды и кетоны.
2. Реакция с фурфуролом
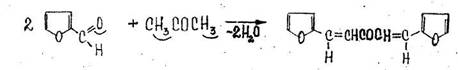
Появляется красная окраска.
Реакция не специфична для ацетона, ее дают альдегиды и кетоны.
4.3.4. ФЕНОЛ(гидроксибензол, карболовая кислота) С6Н5ОН
Фенолы - карболовая кислота, крезол, резорцин, гидрохинон. Бесцветные или окрашенные кристаллы либо аморфные вещества; часто имеют сильный характерный запах.
Фенол представляет собой бесцветные, розовеющие на воздухе кристаллы с характерным запахом; т.пл. 40,8 °С. Образует с водой двухкомпонентную азеотропную смесь (т. кип. 99,6 °С, 9,2 % по массе фенола).
Оказывают местное прижигающее, психотропное (наркотическое), нейротоксическое (судорожное), нефротоксическое действие. Смертельная доза при приеме внутрь - 2 г. Возможны отравления парами фенолов при попадании через рот или на кожу. Всасывание быстрое. При приеме внутрь фенол быстро всасывается кровью, транспортируется и распределяется по всему организму. В печени фенол подвергается биотрансформации: 10 % фенола окисляется до двухатомных фенолов (орто- и пара -соединений). При отравлении фенолом у больного темно-зелёное окрашивание мочи объясняется присутствием в ней гидрохинона и хингидрона.
Фенол относится к группе печёночных ядов. Его гепатотоксическое действие проявляется в развитии токсической дистрофии печени. Выражается в увеличении размеров печени и появления боли в печени. Также появляется желтуха, бледность, головокружение, признаки геморрагического диатеза, повышение температуры тела, нарушение психической деятельности. Церебротоксическое действие фенола проявляется печёночной энцефалопатией. Тяжелые формы отравления фенолом сопровождаются потерей сознания и печёночной комой. При попадании фенола в организм через рот наблюдаются боли в желудке, понос, иногда с кровью, рвота беловатыми, хлопьевидными массами, появляется запах фенола изо рта, моча приобретает оливковое окрашивание. На вскрытии: слизистые оболочки рта, пищевода и желудка покрыты молочного цвета пятнами, жесткими на ощупь. Отмечаются белковое и жировое перерождение паренхиматозных органов, мелкие кровоизлияния во внутренних органах и тканях мозга.
Изолирование фенола проводят методом дистилляции водяным паром. При этом фенол образует азеотропную смесь, состав которой не меняется при перегонке. При больших количествах фенола при насыщении им дистиллята ощущается характерный запах и заметны молочная муть и бесцветные или красноватые капли, растворяющиеся вследствие образования фенолята от добавления раствора натрия гидроксида. Для обнаружения в моче свободного фенола её подкисляют уксусной кислотой и подвергают перегонке с водяным паром. Дистиллят нейтрализуют бикарбонатом натрия и извлекают эфиром. При изолировании дистилляцией с водяным паром фенол выделяется в чистом виде, поэтому дополнительных методов очистки не требуется.
Для проведении анализа дистиллят делят на две части. Для одной части дистиллята проводят качественное обнаружение:
- Реакция с бромной водой (образование трибромфенола).
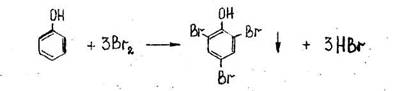
Образуется желтовато-белый осадок трибромфенола.
Чувствительность реакции 1:50000.
Реакция имеет отрицательное судебно-химическое значение, ее дают анилин и другие ароматические амины.
- Реакция образования индофенола
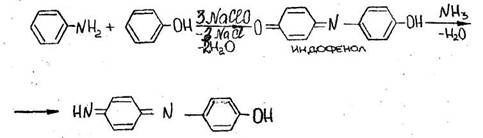
Появляется грязно-фиолетовая окраска, после прибавления раствора аммиака, переходящая в синюю (щелочная соль индофенола).
Реакция имеет отрицательное судебно-химическое значение, ее дают соединения, содержащие фенольную группу.
Часть второго дистиллята подщелачивают раствором гидрокарбоната натрия до щелочной реакции, вносят в делительную воронку и извлекают 2 мл эфира. Эфирную вытяжку упаривают при комнатной температуре досуха. Сухой остаток растворяют в 2-3 мл воды и с раствором проделывают реакции:
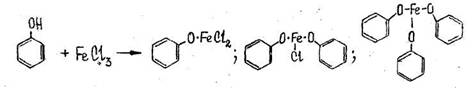
- Реакция с железа (Ш) хлоридом
Появляется сине-фиолетовая окраска, исчезающая от добавления воды, спирта и кислот (отличие от салициловой кислоты).
Чувствительность реакции 1:1000
Реакция имеет положительное судебно-химическое значение.
4.3.5.УКСУСНАЯ КИСЛОТА (этановая кислота) СНзСООН
Бесцветная прозрачная жидкость с резким запахом. Для безводной («ледяной») т.пл. 16,64 °С, т. кип. 117,8 °С. Смешивается со многими растворителями, хорошо растворяет органические соединения.
Уксусная кислота - один из главных промежуточных метаболитов, выполняющих как структурную, так и энергетическую функцию в обмене веществ.
Пары уксусной кислоты раздражают слизистые оболочки верхних дыхательных путей, растворы (концентрация выше 30 % по массе) при соприкосновении с кожей вызывают ожоги.
Используют в пищевой, химической промышленности, в фармации.
Химико-токсикологическое исследование на наличие уксусной кислоты проводят при специальных заданиях или при наличии соответствующих указаний в материалах делах.
Уксусную кислоту отгоняют из объектов биологического происхождения, подкисленных 10 % кислоты серной или фосфорной. Дистиллят собирают в сосуд, содержащий 0,1 моль/л раствор натрия гидроксида, ввиду летучести уксусной кислоты. Количество уксусной кислоты определяют оттитровывая кислотой избыток натрия гидроксида.
Качественное обнаружение
- Реакция с хлоридом железа (III)
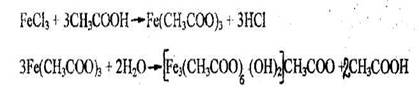
Появляется красная окраска. При нагревании окрашенного раствора происходит гидролиз, в результате которого выпадает бурый осадок.
Чувствительность реакции 1,25 мг.
- Реакция этерификации (образования этилацетата)
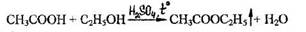
Появляется специфический запах этилацетата.
3. Реакция образования индиго
При нагревании уксусной кислоты с солями кальция образуется ацетон, который подвергается конденсации с о-нитробензальдегидом.
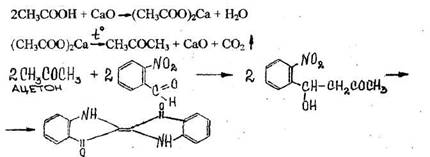
Отверстие пробки накрывают фильтровальной бумагой ,смоченной свежеприготовленным раствором о-нитробензальдегида в 5% растворе гидроксида натрия. Затем пробирку нагревают до прокаливания ее содержимого. На бумаге появляется синее пятно (окраска индиго).
Чувствительность реакции 10 мг.
- Реакция образования окиси какодила, обладающего неприятным запахом
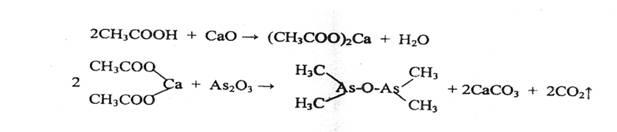
Чувствительность реакции 10 мг.
4.4.СПИРТЫ
Спирты, включенные в обязательный круг судебно-химического исследования при проведении общего анализа: метанол, этанол, пропанол, бутанол, амиловый. Токсикологическое значение спиртов связано с их широким применением в народном хозяйстве и в быту.
По физическим свойствам спирты - летучие жидкости и поэтому для их изолирования применяют метод перегонки с водяным паром. При этом учитывают взаимную растворимость изолируемого спирта и водяного пара. При исследовании токсических спиртов методом ГЖХ для изолирования в этом случае используют метод микродиффузии.
В последние годы наблюдается значительный рост числа интоксикаций, обусловленных употреблением спиртных напитков и суррогатов алкоголя. Это связано с резким повышением уровня алкоголизации населения, ростом количества некачественных спиртных напитков и употреблением с целью опьянения технических спиртсодержащих жидкостей. Смертельные отравления алкоголем и его суррогатами прочно занимают первое место и почти в 3 раза превышают по количеству летальных исходов следующие за ними интоксикации наркотиками.
4.4.1.ТОКСИЧЕСКОЕ ДЕЙСТВИЕ СПИРТОВ в первую очередь связано с их влиянием на ЦНС. Все спирты являются ядами ЦНС, так как обладают наркотическим действием и ослабляют процессы возбуждения.
Метиловый спирт избирательно поражает зрительный нерв и сетчатку глаз, что в 50% случаев приводит к слепоте. Обладает кумулятивными свойствами. Смертельная доза от 30 до 100 г, наступление слепоты возможно от принятия 7-8 г чистого спирта. При отравлении метанолом латентный период составляет 3-4 дня, но иногда смерть наступает очень быстро, в течении 30 минут, причем состояния опьянения при этом может и не быть.
Амиловый спирт обладает наркотическим действием поражая ЦНС, а также сильным местным раздражающим действием, вызывая некроз слизистых оболочек. Смертельная доза при приеме внутрь 10-15 г. При судебно-химическом исследовании органов трупа наводящим указанием является специфический запах изоамилового спирта, исходящий от биологического материала.
Этиловый спирт при приеме внутрь (острая интоксикация) вызывает вначале возбуждение, а затем угнетение и паралич ЦНС. Относится к веществам наркотического действия и вызывает пристрастие - алкоголизм. Наркотический эффект этанола зависит от скорости всасывания (резорбции), фазы интоксикации (стадии резорбции и элиминации), от концентрации в крови, толерантности. При длительном воздействии (хроническая интоксикация) на организм этанол может привести к тяжелым функциональным расстройствам нервной систем (алкогольные психозы - «белая горячка»: бред, галлюцинации с устрашающими видениями), вызвать поражение органов пищеварения, сердечно-сосудистой системы, жировое перерождение печени (цирроз) и т.д. Известно, что алкоголь влияет на потомство, приводя к рождению детей с умственными и физическими недостатками.
В последнее время обнаружено мощное токсическое воздействие этанола на биоритмы человека. При нарушении нормального хода этих биологических часов происходит рассогласование суточных ритмов - так называемая ресинхронизация, при этом у человека падает умственная и физическая работоспособность, нарушается сон, аппетит, изменяется обмен веществ. Исследования установили очень важный факт: вызываемые алкоголем нарушение психофизиологического состояния человека сохраняются и после полного выведения спирта из организме. Только на третьи сутки после приема алкоголя восстанавливаются разрушенные им суточные биоритмы.
Смертельная доза этанола при однократном приеме составляет 4-12 г на килограмм массы тела, то есть для взрослого человека она составляет около 300 мл чистого 96% спирта (без учета толерантности).
Алкогольная кома развивается при концентрации спирта в крови 3 г/л (3%>), абсолютно смертельная концентрация в крови - 5-6 г/л (5-6 %).
Токсикокинетика спиртов
Всасывание (резорбция). В организм спирты попадают через желудочно-кишечный тракт и легкие. Всасывание начинается быстро, уже во рту и пищеводе, но основная масса спирта всасывается в желудке или кишечнике. Механизм всасывания спирта - простая диффузия, молекулы его транспортируются в кровь в неизмененном виде. Скорость всасывания зависит от концентрации и количества принятого спирта, от степени и характера наполнения желудка и кишечника. При приеме натощак максимальная концентрация этанола в крови наблюдается через 40-80 мин ( в среднем около 1 часа), при полном желудке - через 1,5-2,5 часа.
Транспорт (распределение). Через кровь этанол распространяется по органам и тканям, обильно снабжаемым кровью, и концентрируется в тканях пропорционально содержанию в них воды. Наибольшие количество спирта содержатся в биологических жидкостях (кровь, моча, спинномозговая жидкость) и головном мозге. Несколько меньше его в тканях, мышцах, и минимальное количество - в жировой ткани. Небольшие количества этилового спирта могут присутствовать в биоматериале вследствие естественных процессов при гниении крови и других органов трупа.
Метаболизм (биотрансформация). После всасывания спирты подвергаются в организме процессам биотрансформации в основном через окисление до соответствующих альдегидов и кислот, конечными продуктами превращения которых являются СО2 и Н2О.
Так, метанол окисляется до формальдегида, а затем до муравьиной кислоты:
СН3ОН → Н2СО → НСООН → СО2 + Н2О
Этанол на 90% и более окисляется до ацетальдегида и уксусной кислоты:
С2Н5ОН → СН3СОН → СНзСООН → СО2+Н2О
Катализирует процесс фермент алькогольдегидрогеназа (АДГ), акцептором Н2 служит коэнзим никотинамид-аденин-динуклеотид (НАД).
Этот процесс протекает в основном в печени, меньше в легких, почках, мышечной ткани. У хронических алкоголиков процессы биохимического окисления спирта протекают, кроме того, в мышцах с помощью фермента каталазы, поэтому такие люди выносят большие дозы алкоголя.
Скорость метаболизма зависит, главным образом, от времени, очень незначительно - от концентрации спирта. У взрослого человека скорость метаболизма спирта около 10 мл/час, суточный метаболизм - 400-500 мл.
Метанол окисляется в организме значительно медленнее, его можно обнаружить в крови на 3-4 день после смерти.
Выделение (элиминация) спирта протекает по механизму простой диффузии и происходит через легкие, кожу, почки, кишечник, слюнные железы в виде метаболитов. Только 10% этанола выделяется в неизмененном виде, из них 7% - через легкие, 2-2,5% - почками.
Длительность нахождения (и обнаружения) алкоголя в организме человека обусловлена, в основном, количеством выпитого алкоголя и может быть определена с учетом скорости окисления, которая составляет 7-10 г алкоголя в час. Если в 100 мл водки содержится 40 мл алкоголя, тогда алкоголь может определяться в выдыхаемом воздухе, слюне и крови в течение 4-5 часов с момента употребления этой дозы напитка. В моче алкоголь может быть определен и позднее, так как в составе мочи он находится в мочевом пузыре долгое время до опорожнения пузыря. При приеме больших количеств алкоголя он содержится в организме до суток и более. При этом в конце этого срока к непосредственному действию алкоголя присоединяется влияние продуктов его распада, а также изменения внутренней среды организма, вызываемые интоксикацией алкоголем, такие как, например, гипогликемия и метаболический ацидоз. Именно этим объясняются симптомы, наблюдаемые после алкогольной интоксикации в период, когда алкоголя в организме уже нет: утомляемость, жажда, дрожание конечностей, головная боль, потливость, сердцебиение, колебание артериального давления, неустойчивое, а, нередко, и депрессивное настроение.
Объекты исследования и пробоподготовка
Наиболее важными объектами для судебно-химической экспертизы служат кровь и моча, реже ткани мозга, легких, печени, почек, редко - глубокие мышцы бедра. Желудок не может быть взят в качестве объекта исследования, так как возможно образование спирта естественным путем при брожении углеводов или при гнилостных процессах его содержимого. Содержание эндогенного алкоголя в крови находится в пределах 0,008-0,4%. При диагностике состояния алкогольного опьянения в наркологической практике объектами служат выдыхаемый воздух, слюна, кровь, моча.
Правила отбора проб для исследования
1. О правилах изъятия и направления на судебно-химическую экспертизу внутренних органов трупа, мы уже говорили.
2. При отборе жидких биологических сред у живых лиц также необходимо соблюдать определенные требования, а именно:
Если Вам понравилась эта лекция, то понравится и эта - Условные рефлексы второго рода.
Моча отбирается в сухой стерильный флакон «под пробку». Флакон тотчас же закрывают пробкой. Отбор пробы мочи должен производиться в условиях, исключающих подмену или замену ее другими жидкостями.
Слюна отбирается в стерильный сухой флакон из-под пенициллина в количестве 5 мл и тут же закрывается пробкой.
Перед отбором пробы крови в сухой стерильный флакон из-под пенициллина закапывают 1-2 капли гепарина или 0,8 мл 3,8%-го раствора натрия цитрата и встряхиванием флакона смачивают его стенки.
Кровь в количестве 5 мл отбирается пункцией кубитальной вены при строгом соблюдении асептических условий самотеком во флакон, обработанный гепарином или цитратом. Флакон тотчас же закрывают стандартной резиновой пробкой, фиксируют пробку и содержимое флакона перемешивают. Кожа в месте пункции предварительно обрабатывается раствором сулемы 1:1000 или риванолом 1:500. Дезинфекция кожи спиртом, эфиром, настойкой йода не допускается.
У всех флаконов с отобранными пробами фиксируют пробки алюминиевыми колпачками с помощью приспособления для обжима колпачков, обеспечивающего герметизацию флакона, и ставят их в холодильник. В случае герметизации другим способом флаконы должны быть опечатаны. На каждый флакон наклеивается этикетка с указанием номера пробы (по регистрационной книге), даты, времени забора пробы, фамилии освидетельствуемого, фамилии медицинского работника, подготовившего пробу.
Биосреды должны исследоваться позднее суток с момента их отбора. Допускается их хранение в холодильнике при температуре -4° С в течение 5 суток.