Физико-химические свойства природных газов и конденсата
1.физико-химические свойства природных газов и конденсата
1.1. Состав и классификация природных газов[1,2]
Состав природных газов. В состав природных газов входят:
а) углеводороды -алканы CnH2n+2 и цикланы CnH2n;
б) неуглеводороды- азот N2, угл. газ СО2, сероводород Н2S, ртуть, меркаптаны RSH.
в) инертные газы – гелий, аргон, криптон, ксенон.
Фазовые состояния.
Метан (СН4), этан (С2Н6) и этилен (С2Н4) при нормальных условиях (р=0,1 МПа и Т=273 К) являются реальными газами и составляют сухой газ.
Пропан (С2Н6), пропилен (С3Н6), изобутан(i=С4Н10), нормальный бутан-(n=С4Н10), бутилены (С4Н8) при атмосферных условиях находятся в парообразном (газообразном) состоянии, при повышенных давлениях—в жидком состоянии. Они входят в состав жидких (сжижаемых, сжиженных) углеводородных газов.
Углеводороды, начиная с изопентана (i= С5Н12) и более тяжелые (17³n>5) при атмосферных условиях находятся в жидком состоянии. Они входят в состав бензиновой фракции.
Рекомендуемые материалы
Углеводороды, в молекулу которых входит 18 и более атомов углерода (от С18Н28), расположенных в одну цепочку, при атмосферных условиях находятся в твердом состоянии.
Классификация природных газов.
Природные газы подразделяют на три группы.
1. Газы, добываемые из чисто газовых месторождений. Они представляют собой сухой газ, практически свободный от тяжелых углеводородов.
2. Газы, добываемые вместе с нефтью. Это физическая смесь сухого газа, пропан-бутановой фракции (сжиженного газа) и газового бензина.
3. Газы, добываемые из газоконденсатных месторождений. Они состоят из сухого газа и жидкого углеводородного конденсата. Углеводородный конденсат состоит из большого числа тяжелых углеводородов, из которых можно выделить бензиновые, лигроиновые, керосиновые, а иногда и более тяжелые масляные фракции. Кроме того, присутствуют N2, СО2, H2S, Не, Аг и др.
Искусственные газы получают из твердых топлив (горючие сланцы, бурый уголь) в газогенераторах, ретортах, тоннельных и прочих печах при высоких температурах, а иногда и при повышенных или высоких давлениях.
Изменение состава природного газа в процессе разработки.
Во время эксплуатации газовых скважин метан —газообразный и находится при температуре выше критической, этан — на грани парообразного и газообразного состояния, а пропаны и бутаны — в паровом. С повышением давления и понижением температуры компоненты, входящие в состав природных газов чисто газовых месторождений, могут переходить в жидкое состояние. При эксплуатации газоконденсатных месторождений с понижением давления до определенного значения (давление максимальной конденсации) обычно наблюдается переход тяжелых углеводородов в жидкое состояние, при последующем уменьшении давления часть их переходит обратно в газообразное состояние.
Это приводит к тому, что состав газа, а также состав и количество конденсата в процессе разработки газоконденсатных месторождений без поддержания давления изменяются, что следует учитывать при проектировании заводов по переработке газа и конденсата. Если газоконденсатные месторождения разрабатывают с поддержанием давления путем закачки газа в пласт (сайклинг-процесс), состав конденсата практически не изменяется, а состав газа может изменяться при прорыве сухого газа в эксплуатационные скважины. Если для поддержания пластового давления закачивают в пласт воду, состав газа и конденсата в процессе разработки остаются неизменными.
В процессе разработки газовых и газоконденсатных залежей предвестником обводнения по данным эксплуатации скважин по ряду месторождений является увеличение азота и редких газов (например, Шебелинское месторождение) или увеличение газоконденсатного фактора и минерализации, выносимой из скважины воды (месторождения Краснодарского края).
Таким образом, физико-химические свойства газа и его состав необходимо знать как на стадии разведки, так и при эксплуатации месторождения.
1.2. Основные параметры [1,2]
1.2.1.Газовые законы
Термодинамическое состояние природного газа описывается в целом через средние параметры и компонент через парциальные параметры
Парциальные параметры. Парциальное давление компонента смеси pi - давление, которое он бы имел при удалении из объёма, занимаемого смесью, остальных компонент при неизменных величинах начального объёма и температуры;
парциальный объем компонента смеси vi- объём, который он бы имел при удалении из объёма, занимаемого смесью, остальных компонент при неизменных величинах начального давления и температуры.
Газовые законы. Связь между парциальными и средними параметрами устанавливается через следующие законы:
закон Авогадро - 1кмоль газа при нормальных условиях ( р=760 мм рт.ст.; Т=00С) занимает объём 22.41м3;
закон Дальтона - аддитивности парциальных давлений pi
р= å рi ; (1.1)
закон Амаги - аддитивности парциальных объёмов vi
v=å vi. (1.2)
1.2.2. Параметры газовых смесей
К средним параметрам относятся:
плотность газа в нормальных условиях
r = М/22.41, кг/м3 ; (1.3)
относительная плотность - плотность, отнесённая к плотности воздуха rв при тех же значениях давления и температуры;
концентрации компонент - массовые gi=Gi /G; молярные yi=mi /m; объёмные xi=vi /v;
средние характеристики –
давление р=pi /xi ; объём v=vi /xi;
молекулярная масса M= å (xi Мi)/100=100/ å (gi /Mi) ; (1.4)
плотность r =100/ å (gi / r i)=100M/ å (xi Mi)/ ri= å (xi r i). (1.5)
При этом: плотности воздуха r0= 1,293кг/м3, r20= 1,205кг/м3 (верхний индекс – температура в градусах Цельсия); концентрации связаны между собой соотношениями gi=xi Mi /M; yi=xi.
1.2.3. Содержание тяжелых углеводородов в газе
В газе три тяжелые фракции: пропановая, бутановая и газовый бензин. Последний принимается состоящим по массе из 1/3 бутана и 2/3 пентана (плюс вышекипящие).
Содержание тяжелых компонентов в г/м3 определяется по формуле
Аi=10girсм= 10уiri, г/м3. (1.6)
В газовый бензин целиком переходит пентан плюс вышекипящие и часть нормального бутана, по величине равная половине содержания пентана плюс вышекипящие.
Объём паров после испарения жидкости. Объём паров, получаемый после испарения G кг жидкого углеводорода (при нормальных физических условиях р=0,1013МПа, Т=273 К ), можно вычислить по формуле
Vп=G / rп= 22,41 G / М,[ м3] (1.7)
1.2.4. Критические и приведённые термодинамические параметры
Критическим состоянием называется такое состояние вещества, при котором плотность вещества и его насыщенного пара равны друг другу. Параметры, соответствующие этому состоянию, называются критическими параметрами.
Критической Ткр называется такая температура, выше которой газ под действием давления любого значения не может быть превращён в жидкость.
Критическое давление ркр, - зто давление необходимое для сжижения газа при критической температуре.
Критическим объёмом vкр называют объём, равный объёму одного моля газа при критических значениях давления и температуры.
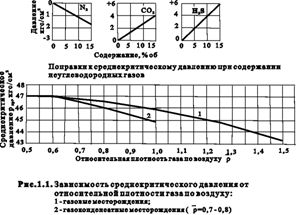
Для природных газов значения Ткр и ркр при известных параметрах компонент xi, pкрi, Ткрi определяются как среднекритические (псевдокритические).
pкр= å(Pкрi xi) , Ткр = å(Tкрi xi) при хС5+<10%. (1.8)
Если известна относительная плотность газа `r, то средние значения критических давления и температуры природного газа можно определить по графикам, приведенным на рис. 1.1 и 1.2. При содержании в природном газе N2, СО2 или Н2S в значения Ткр и ркр вводятся соответствующие поправки.
Когда содержание N2, СО2 или Н2S превышает 15% об., вместо графиков для определения Ткр и ркр следует пользоваться формулой (1.8).

Для приближенных расчетов при изменении относительной плотности `r от 0,5 до 0,9 значения ркр и Ткр можно определить по формулам:
давление в кгс/см2

температура в К

которые справедливы для кривых 1 на рис. 1.1 и 1.2.
Часто в расчетах, например при определении вязкости и коэффициента сверхсжимаемости газа, пользуются так называемыми приведенными давлениями и температурами.
Приведенным давлением рпр называется отношение давления газа р к его критическому давлению ркр : pпр=p/ pкр
Приведенной температурой газа Тпр называется отношение абсолютной температуры газа Т к его критическому значению: Тпр=Т/Ткр.
1.3. Уравнения состояния [1,2,5]
1.3.1. Уравнения состояния природных газов
Уравнением состояния называется аналитическая зависимость между термодинамическими параметрами, описывающими поведение вещества. В качестве таких параметров используются: давление р, температура Т и плотность r.
Уравнение состояние совершенного газа
р= rRT. (1.9)
Определение совершенного газа. Совершенный газ - это газ в котором можно пренебречь объёмом молекул и взаимодействием их между собой
Подходы в описании уравнений состояния реальных газов:
а) в уравнение совершенного газа вводится один коэффициент z, который учитывает отклонение данных газов от совершенного и называется коэффициентом сверхсжимаемости, а само модифицированное уравнение называют обобщённым газовым законом;
в) получают эмпирические уравнения состояния с числом параметров больших двух.
1.3.1.1. Обобщённое уравнение состояния
р=zr RT . (1.10)
Термодинамические параметры, определяющие коэффициент. сверхсжимаемости. Коэффициент сверхсжимаемости z является функцией приведенных значений давления рпр, температуры Тпр и для тяжелых углеводородов С5+ - ацентрического фактора w.
Ацентрический фактор - учитывает нецентричность сил притяжения и рассчитывается по формуле Эдмистера

w = 3/7[ lg(pкр /pст)/(Tкр /Tкип-1)]-1, (1.11)
где отношение критической температуры к температуре кипения можно определить по формуле Гуревича (до С7, включительно)
 (1.12)
(1.12)
для смесей газов w= å (yi wi), 0< wi < 0,4 .
Коэффициент сверхсжимаемости определяется графически (рис 1.3) или приближенно аналитически.

1.3.1.2. Многопараметрические зависимости
Зависимость - Редлиха Квонга
р=RТ/(v-b)-a/[T0.5v(v+b)], (1.13)
где a=0.4275 R2 T2,5кр /ркр; в=0.08664 R Tкр/ркр.
Область действия - сухие газы в докритической области.
Уравнение Пенга- Робинсона
p=R*T/(v-b)-a(T)/[v(v+b)+b(v-b)]. (1.14)
Здесь: а(T)=akp a(Tпр, w ); akp=0.45724 R2 Tkp2/Pkp;
b=0.0778 R Tkp /Pkp; a ={1+m (1-Tпр0.5)}2;
m=0.37464+1.54226 w -0.26992 w 2.
Для многокомпонентных смесей а= å(yi ai); b= å (yi bi).
Область действия - критическая область; для газоконденсатных смесей
1.3.2. Расчетные методы определения
коэффициента сверхсжимаемости [5,6]
Из уравнения состояния Пенга-Робинсона , (1.15)
, (1.15)
где А=а(Т) р/(R2 T2); B=p b/(R T).
Область использования: р<50МПа; хС 5+<40моль%; пары воды
Выбор z: z газовой фазы соответствует наименьший положительный корень уравнения, а z жидкой фазы - наибольший положительный корень.
Аппроксимация Платонова-Гуревича
 , (1.16)
, (1.16)
где ркр и Ткр вычисляются по формулам Хенкинсона, Томаса и Филлипса

Область использования - р<40МПа; хС 5+<10моль%.
Погрешность формулы: меньше 1% при p< 25МПа; 3% при p= 25- 35МПа и 5% - от 35 до 40МПа.
1.4. Физико-химические и теплофизические свойства
природных газов[1,5,6].
1.4.1. Вязкость
Вязкость - свойство жидкостей и газов, характеризующих сопротивляемость скольжению или сдвигу одной их части относительно другой.
Коэффициент динамической вязкости m характеризует силы взаимодействия между молекулами газа, которые преодолеваются при его движении.
Основной единицей вязкости в системе СИ является паскаль-секунда (Па*с). В нефтепромысловой практике вязкость измеряют в пуазах (П) или сантипуазах (сП). 1сП = 0,01 П= 0,001 Па*с.
Коэффициент кинематической вязкости. В расчетах наряду с абсолютной вязкостью газа применяют кинематическую вязкость n, равную абсолютной вязкости, деленной на плотность газа: n=m/r.
Единицей кинематической вязкости является квадратный метр на секунду (м2/с) или квадратный миллиметр на секунду (мм2/с) 1 мм2/с = 10-6 м2/с.
В нефтепромысловой практике кинематическую вязкость измеряют в стоксах (Ст) или сантистоксах (сСт) 1 Ст = 10-4 м2/с; 1 сСт = 10-6 м2/с = 1 мм2/с.
При пересчетах абсолютной вязкости газа в кинематическую значения плотности r или удельного веса g берутся при рассматриваемых давлениях и температурах.
Учет влияния на вязкость азота -  .
.
Природа вязкости газов и жидкостей. В газах расстояние между молекулами существенно больше радиуса действия молекулярных сил, поэтому вязкость газов – следствие хаотического (теплового) движения молекул, сопровождающее переносом от слоя к слою определённого количества движения, в результате медленные слои ускоряются, а более быстрые замедляются. Работа внешних сил, уравновешивающих вязкое сопротивление и поддерживающее установившееся течение, полностью переходит в теплоту.
В жидкостях, где расстояние между молекулами много меньше, чем в газах, вязкость обусловлена молекулярным взаимодействием, ограничивающим подвижность молекул. В жидкости молекула может проникнуть в соседний слой лишь при образовании в нём полости, достаточной для перескакивания туда молекулы. На образование полости (на “рыхление” жидкости) расходуется так называемая энергия активации вязкого течения.
При больших давлениях (больше 10 -15МПА) газы становятся не идеальными, так как средние расстояния между молекулами становятся сравнимыми с радиусом межмолекулярного взаимодействия, и природа вязкости газов становится аналогичной жидкости.
Качественная зависимость вязкости газов и жидкостей от температуры .
В идеальном газе вязкость m не зависит от плотности (давления), а определяется величинами средней скорости и длиной свободного пробега молекул. Так как средняя скорость возрастает с повышением температуры Т (несколько возрастает также и длина свободного пробега), то вязкость газов увеличивается при нагревании (пропорционально корню квадратному от температуры) (рис.1.4). Присутствие неуглеводородных компонентов в газе повышает вязкость природного газа.
В жидкостях энергия активации уменьшается сростом температуры и понижением давления. В этом состоит одна из причин резкого снижения вязкости жидкостей с повышением температуры и роста её при высоких давлениях.
В силу того, что при больших давлениях газы приобретают свойства жидкости, то при давлениях больших 10-15Мпа вязкость природных газов падает с ростом температуры (рис.1.4), но само значение вязкости повышается с ростом давления.

1.4.2. Теплоёмкость
Теплоемкостью С называют количество теплоты, необходимое для нагревания единицы массы или объема вещества на 1° С.
Удельная теплоемкость - отношение теплоёмкости к единице количества газа.
Для газов обычно различают теплоемкости при постоянном объеме Сv и постоянном давлении Сp. Сv связана с процессом, характеризующимся тем, что при неизменности объема вся энергия, сообщаемая газу в форме теплоты, затрачивается на увеличение внутренней энергии газа. Сp связана с процессом, характеризующимся тем, что, нагревая тело, предоставляют ему возможность расширяться при неизменном давлении. Таким образом, часть сообщенной телу теплоты идет на производство работы расширения. Поэтому Сp > Сv.
Для идеальных газов между Сp и Сv существует следующее соотношение
Сp = Сv + R, где R — газовая постоянная.
В области давлений, где газы считаются идеальными, значения теплоемкостей постоянны. Однако для реальных газов значения теплоемкости изменяются в зависимости от давления и температуры.
Для смеси газов теплоемкость определяется по сумме теплоемкости входящих компонентов по формуле

где Сi— теплоемкости отдельных компонентов смеси; yi – объемное (молярное) содержание компонентов в долях единицы; n – число компонент
Связь молярной теплоемкости углеводородных и неуглеводородных компонент. При изобарическом процессе молярная теплоёмкость неуглеводородных компонентов природных газов (азота, углекислого газа, сероводорода) равна примерно половине теплоёмкости углеводорода с одинаковой молекулярной массой при одной и той же температуре
Связь молярной теплоемкости с массовой. Массовая теплоёмкость равна отношению молярной теплоёмкости к молекулярной массе газа Мi , т.е массе киломоля i-го компонента, кг/моль.
1.4.3. Дросселирование газа. Коэффициент Джоуля-Томсона
Дросселирование - расширение газа при прохождении через дроссель - местное сопротивление (вентиль, кран и т.д.), сопровождающее изменением температуры.
Определение дроссельного эффекта (эффекта Джоуля-Томсона). Отношение изменения температуры газа в результате его изоэнтальпийного расширения (дросселирования) к изменению давления называется дроссельным эффектом, или эффектом Джоуля - Томсона.
При охлаждении газа эффект считается положительным, при нагревании его — отрицательным.
Коэффициент Джоуля-Томсона. Изменение температуры при снижении давления на 1ата (0,1Мпа) называется коэффициентом Джоуля - Томсона. Этот коэффициент изменяется в широких пределах и может иметь положительный или отрицательный знак.
Интегральный дроссель-эффект и области его значения. Изменение температуры газа в процессе изоэнтальпийного расширения при значительном перепаде давления на дросселе называется интегральным дроссель-эффектом. Это изменение можно определить по соотношению
 . (1.19)
. (1.19)
Интегральный коэффициент Джоуля-Томсона для природного газа изменяется от 2 до 4 К/МПа в зависимости от состава газа, падения давления и начальной температуры газа. Для приближенных расчетов среднее значение коэффициента Джоуля-Томсона можно принять равным 3 К/МПа.
1.4.4. Поверхностные явления при движении жидкой и паровой фаз
в пористой среде. Межфазное натяжение
Причина возникновения поверхностных явлений. Причиной возникновения на границах контакта фаз поверхностных явлений является значительное различие в физико-химических свойствах фаз.
Значение поверхностных явлений. Поверхностные явления во многом определяют количество и распределение в поровом пространстве связанных и остаточных нефти, воды, газа; форму кривых фазовых проницаемостей; эффективность методов повышения газоотдачи.
Виды поверхностных явлений. Среди поверхностных явлений, протекающих на границах раздела фаз, особое влияние на эффективность разработки газовых залежей оказывают: поверхностное натяжение, капиллярное давление, смачиваемость, капиллярная пропитка и адсорбция.
Причина возникновения поверхностного натяжения и его физический смысл. Поверхностное натяжение на границе фаз возникает вследствие того, что молекулы вещества, находящиеся вблизи поверхности раздела взаимодействуют не только между собой, но и с молекулами вещества соседней фазы. При этом молекулы из внутреннего объёма перемещаются в поверхностный слой с образованием новой поверхности. Работа обратимого, изотермического образования единицы новой поверхности раздела фаз при постоянстве давления называется поверхностным натяжением s.
Единица измерения поверхностного натяжения. Величина поверхностного натяжения в СИ измеряется в Дж/м2 или в Н/м.
Изменение поверхностного натяжения с ростом Р и Т. Поверхностное натяжение нефти и воды на границе с газом обычно составляет от 5 до 70 мН/м и уменьшается с ростом давления и температуры.
Коэффициент поверхностного межфазного натяжения равен нулю при критических значениях давления и температуры.
1.4.5. Опасные свойства природного газа
Токсичность. Опасным свойством природных газов является их токсичность, зависящая от состава газов, способности их при соединении с воздухом образовывать взрывоопасные смеси, воспламеняющиеся от электрической искры, пламени и других источников огня.
Чистые метан и этан не ядовиты, но при недостатке кислорода в воздухе вызывают удушье.
Взрываемость. Природные газы при соединении с кислородом и воздухом образуют горючую смесь, которая при наличии источника огня (пламени, искры, раскаленных предметов) может взрываться с большой силой. Температура воспламенения природных газов тем меньше, чем выше молекулярная масса. Сила взрыва возрастает пропорционально давлению газовоздушной смеси.
Природные газы могут взрываться лишь при определенных пределах концентрации газа в газовоздушной смеси: от некоторого минимума (низший предел взрываемости) до некоторого максимума (высший предел взрываемости).
Низший предел взрываемости газа соответствует такому содержанию газа в газовоздушной смеси, при котором дальнейшее уменьшение его делает смесь невзрываемой. Низший предел характеризуется количеством газа, достаточным для нормального протекания реакции горения.
Высший предел взрываемости соответствует такому содержанию газа в газовоздушной смеси, при котором дальнейшее его увеличение делает смесь невзрываемой. Высший предел характеризуется содержанием воздуха (кислорода), недостаточным для нормального протекания реакции горения.
С повышением давления смеси значительно возрастают пределы ее взрываемости. При содержании инертных газов (азот и др.) пределы воспламеняемости смесей также возрастают.
Горение и взрыв — однотипные химические процессы, но резко отличающиеся по интенсивности протекающей реакции. При взрыве реакция в замкнутом пространстве (без доступа воздуха к очагу воспламенения взрывоопасной газовоздушной смеси) происходит очень быстро.
Скорость распространения детонационной волны горения при взрыве (900—3000 м/с) в несколько раз превышает скорость звука в воздухе при комнатной температуре.
Сила взрыва максимальна, когда содержание воздуха в смеси приближается к количеству, теоретически необходимому для полного сгорания.
При концентрации газа в воздухе в пределах воспламенения и при наличии источника воспламенения произойдет взрыв; если же газа в воздухе меньше нижнего предела или больше верхнего предела воспламенения, то смесь не способна взорваться. Струя газовой смеси с концентрацией газа выше верхнего предела воспламенения, поступая в объем воздуха и смешиваясь с ним, сгорает спокойным пламенем. Скорость распространения фронта волны горения при атмосферном давлении составляет около 0,3—2,4 м/с. Нижнее значение скоростей — для природных газов, верхнее — для водорода.
Детонационные свойства углеводородов парафинного ряда. Детонационные свойства проявляются от метана до гексана, октановое число которых зависит как от молекулярной массы, так и то строения самих молекул. Чем меньше молекулярная масса углеводорода, тем меньше его детонационные свойства, тем выше его октановое число.
1.4.6. Влажность природных газов
Природный газ в пластовых условиях всегда насыщен парами воды, так в газоносных породах всегда содержится связанная, подошвенная или краевая вода.
Виды влажности. Влажность газа характеризуется концентрацией воды в паровой фазе системы газ – вода. Обычно она выражается массой паров воды, приходящейся на единицу массы сухого газа (массовая влажность) или числом молей паров воды, приходящейся на моль сухого газа (молярная влажность).
Абсолютная влажность W характеризуется количеством водяного пара в единице объема газовой смеси, приведенной к нормальным условиям (Т=273К, р=0,1Мпа), измеряется в г/м3 или кг/1000м3.
Относительная влажность – отношение абсолютной влажности к максимальной, соответствующей полному насыщению парами воды, при данной температуре и давлении (в %). Полное насыщение оценивается в 100%.
Факторы, определяющие влагосодержание природных газов: давление, температура, состав газа; количество солей, растворенных в воде, контактирующей с данным газом.
Методы определения влагосодержания: экспериментально, по аналитическим уравнениям или номограммам, составленным при обработке экспериментальных или расчетных данных.
Влияние неуглеводородных компонент и свойств газа на влажность. Присутствие углекислого газа и сероводорода в газах увеличивает их влагосодержание. Наличие азота приводит к уменьшению влагосодержанияю, так как он способствует уменьшению отклонения газовой смеси от идеального газа и менее растворим в воде. С увеличение плотности (или молекулярной массы газа), за счет роста количества тяжелых углеводородов, влажность газа уменьшается из-за взаимодействия молекул тяжелых углеводородов с молекулами воды. Наличие в пластовой воде растворенных солей уменьшает влагосодержание газа, так как при растворении солей в воде снижается парциальное давление паров воды.
Влияние давления и температуры. При уменьшении температуры происходит уменьшение влагосодержания, а при падении давления его увеличение.
1.4.7. Гидратообразование.
Состав и структура гидратов. Природный газ, насыщенный парами воды, при высоком давлении и при определенной положительной температуре способен образовывать твердые соединения с водой – гидраты.
Особое значение гидратообразование приобретает при добычи газа из месторождений Сибири и Крайнего Севера. Низкие пластовые температуры и суровые климатические условия этих районов создают благоприятные условия для образования гидратов.
Если Вам понравилась эта лекция, то понравится и эта - Борьба Альфреда с датчанами.
Гидраты природных газов представляют собой неустойчивое физико-химическое соединение воды с углеводородами, которое с повышением температуры или при понижении давления разлагается на газ и воду. По внешнему виду — это белая кристаллическая масса, похожая на лед или снег.
Гидраты относятся к веществам, в которых молекулы одних компонентов размещены в полостях решетки между узлами ассоциированных молекул другого компонента. Такие соединения обычно называют твердыми растворами внедрения, а иногда соединениями включения.
По современным представлениям молекулы гидратообразователей в полостях между узлами ассоциированных молекул воды гидратной решетки удерживаются с помощью Ван-дер-Ваальсовых сил притяжения.
Влияние неуглеводородных компонент и свойств природного газа на гидратообразование. Увеличение процентного содержания сероводорода углекислого газа приводит к повышению равновесной температуры гидратообразования и понижению равновесного давления. Например, при давлении 50ата для чистого метана температура образования гидратов составляет 6оС, а при 25-ом содержании H2S она достигает 10оС. Природные газы, содержащие азот, имеют более низкую температуру образования гидратов, т. е. в этом случае гидраты становятся менее устойчивыми. Например, если в природном газе с относительной плотностью 0,6 отсутствует азот, гидраты его при температуре 10°С остаются устойчивыми до давления 34 ата, если же в газе содержится 18% азота, равновесное давление гидратообразования снижается до 30ата
Для образования гидратов в жидких углеводородных газах требуются более высокое давление и более низкие температуры. В отличие от природных газов выделение гидратов в жидких углеводородных газах сопровождается увеличением давления системы (в замкнутом объеме). Кроме того, как и в природных газах, в этом случае выделяется теплота, в результате чего повышается температура системы. Поскольку объем остается постоянным, с увеличением температуры в системе растет и давление.
Разложение гидратов жидких углеводородных газов сопровождается уменьшением объема и, следовательно, понижением давления. Образование гидратов в жидких углеводородах идет несравнимо труднее, чем в газообразных. Чтобы начался этот процесс, требуется выдержать систему при соответствующих условиях в течение некоторого времени и в основном в условиях равновесия. Однако при отрицательных температурах после появления мелких кристалликов льда гидраты начинают образовываться быстро. Гидраты жидких углеводородных газов легче воды.























