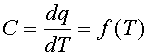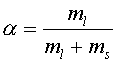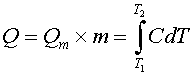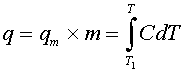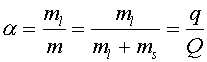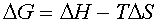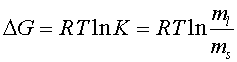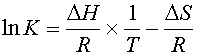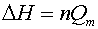Метод ДСК
Метод ДСК
В биологических мембранах липидный слой по всем имеющимся данным представляет собой жидкое тело с вязкостью, близкой к вязкости подсолнечного масла.
Строго говоря текучесть мембраны ограничена внутренней гидрофобной фазой, которая состоит из углеводородных цепей жирных кислот. Эта фаза, однако, не всегда бывает жидкой. При охлаждении до температур ниже 10оС мембраны замерзают, т.е. жидкая фаза затвердевает, приобретая свойства двумерного кристалла.
В мембранах, образованныых синтетическими липидами, фазовый переход из жидкого в твердое состояние может происходить при более высоких температурах, в зависимости от химического состава фосфолипида. В таблице 1 приведены температуры фазовых переходов некоторых синтетических фосфатидилхолинов (лецитинов).
Таблица 1. Температуры плавления некоторых синтетических фосфолипидов
| Жирные кислоты | Название остатка жирной кислоты | Сокращённое название фосффолипида | Температура плавления, Tc, oC |
Рекомендуемые материалыВариант 6 - Сельское хозяйство Историческая ономастика FREE Бонистика FREE Фалеристика FREE Ономастика FREE Геральдика и хронология 14:0 | Миристоил | ДМЛ | 23 |
| 16:0 | Пальмитоил | ДПЛ | 41 |
| 18:0 | Стеароил | ДСЛ | 58 |
| 18:1 | Олеил | ДОЛ | -21(цис-форма) |
Полное название фосфолипидов: ДМЛ - 1,2-димиристоилфосфатидилхолин (еще одно возможное сокращение - „ДМФХ”) и так далее.
Для изучения фазовых переходов при нагревании используют метод дифференциальной сканирующей микрокалориметрии (сокращенно - ДСК). Не останавливаясь на конструкции прибора, отметим только, что в конечном счете с его помощью записывается кривая теплоемкости, т.е. зависимость теплоемкости липидов или мембран в суспензии от температуры:
|
| (1) |
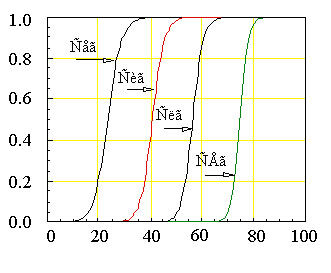
Рис.1. Фазовые переходы в суспензии фосфолипидных везикул (липосом) по данным дифференциальной сканирующей микрокалориметрии (ДСК).
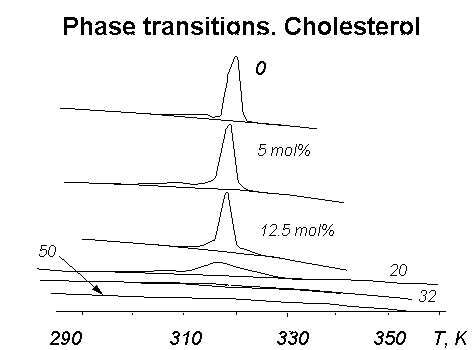
Перед приготовлением липосом к фосфолипидам было дабавлено разное количество холестерина; его содержание в молярных процентах указано у кривых.
По оси ординат отложена теплоемкость, по оси абсцисс - температура, K.
Метод называется дифференциальным, потому что измеряется только теплоемкость суспендированного материала на фоне гораздо большей теплоемкости раствора сравнения.
Примеры таких кривых даны на рис.1, где приведены кривые ДСК для дистеароилфосфатидилхолина (ДСЛ). На этих кривых, в частности, видно увеличение температурного интервала фазового перехода пр добавлении к липиду в мембране холестерина.
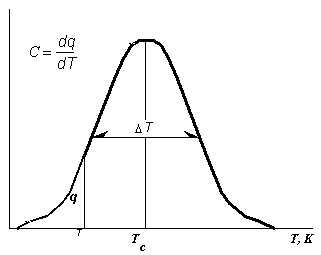
На рисунке 2 слева более подробно обозначены параметры кривой ДСК. На первом этапе нас будут интерессовать три из них:
1. Температура фазового перехода ("плавления") Tc.
2. Температурный интервал ("ширина") фазового перехода.
3. Общее количество тепла Q, поглощенного при плавлении.Оно представляет собой площадь под кривой ДСК, т.е. функции C=f(T)
Рис.2. Характеристик фазовых переходов в липидах по данным дифференциальной сканирующей микрокалориметрии.
С-теплоемкость.
T - полуширина фазового перехода,
Tc - температура плавления.
Кривые плавления
Кривой плавления называется зависимость доли жидкой фазы в общем количестве изучаемого вещества, в данном случае - липидов мембран.
Рис.3. Кривая плавления липиддов в липосомах, приготовленных из ДПЛ.
- доля жидкой фазы, T - температура,
Tc - температура плавления ( = 0,5), ml - количество липида в жидкой фазе, ms -количество липида в твердой фазе.
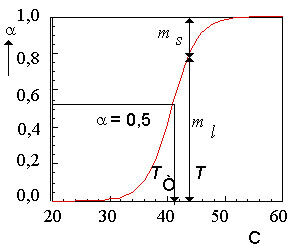
Обозначим количество липидов в жидкой фазе через ml, а количество липидов в твердой фазе через ms. Тогда доля жидких липидов будет равна:
|
| (2) |
На рис. 3. приведена кривая плавления дистеароил-фосфатидил холина (или дипальмитоил-лецитина, ДПЛ).
Методы измерения кривых плавления
Для определения доли жидкой фазы в общем объеме изучаемого материала, в нашем случае, - в липидной слое мембран, можно использовать разные методы.
Анализ кривых ДСК
Один из методов измерения кривых плавления основан на анализе кривых, полученных методом дифференциальной сканирующей калориметрии. Обратимся снова к рисунку 2.
Пусть удельная теплота плавления липида равна Qm, а количество липодов в образце составляет m кмолей. Общее количество энергии, поглощенной образцом в интервале температур плавления T1-T2 равно очевидно площади под кривой C=f(T), т.е.
|
| (3) |
В интервале температур от T1 до текущей температуры T расплавится количество молей липида mд , и при этом поглотится количество тепла, равное:
|
| (4) |
(заштрихованная площадь на рис.2).
При темпаратуре T молярная доля липидов, находящихся в жидкой фазе равна:
|
| (5) |
Таким образом, измеряя по отношению площадей под кривой C=f(T) при разных темпраратурах, мы строим кривую плавления =f(T).
Измерение флуоресценции зондов
Многие флуоресцирующие соединения обладают тем свойством, что спектры и (или) квантовые выходы их флуоресценции сильно зависят от окружающей среды: ее полярности, вязкости и других характеристик. Примером такого соединения может служить АНС: 1-анилино, 2-нафталенсульфонат, формула которого приведена ниже.
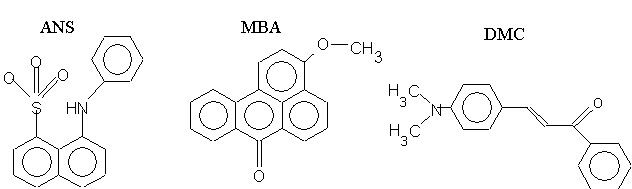
Рис.4. Структурные формулы некоторых флуоресцентных зондов, применяемых для измерения структцрных перестроек в липидном слое биологических и искуственных мембран.
Это соединение при добавлении его к суспензии мембран распределяется между водной и липидной фазами, но флуоресцирует практически только АНС, растворенный в липидной фазе. Поэтому интенсивность флуоресценции возрастает при плавлении липидов мембран и снижается при замерзании.
Фазовое равновесие
В области температур фазового перехода, если плавление происходит достаточно медленно, устанавливается равновесие:
Жидкое состояние - Твердое состоояние
Можно считать, что вся мембрана состоит из участков жидких липидов и участков твердых липидов. Тогда обратимый процесс фазового перехода можно рассматривать как процесс превращения таких участков (доменов) друг в друга со скоростями, пропорциональными концентрации доменов, иначе говоря, фазовое равновесие можно рассматривать как обратимую химическую реакцию:
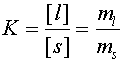
 С константой равновесия, где [l] и [s] - концентрации липидов в жидкой и твердой фазах, а ml и ms - количество липида в жидкой и твердой фазах, соответственно.
С константой равновесия, где [l] и [s] - концентрации липидов в жидкой и твердой фазах, а ml и ms - количество липида в жидкой и твердой фазах, соответственно.
Изменение свободной энергии при плавлении моля липида G равно изменению энтальпии H минус изменение тепловой энергии TS:
|
| (6) |
причём
|
| (7) |
Отсюда находим
|
| (8) |
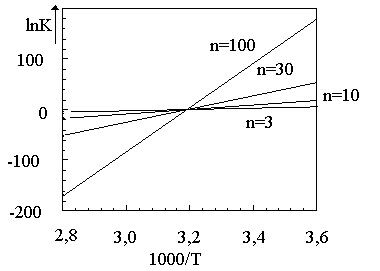
Таким образом, зависимость  представляет собой прямую линию с угловым коэффициентом
представляет собой прямую линию с угловым коэффициентом  и отсечкой на оси ординат, равной
и отсечкой на оси ординат, равной . Примеры такого рода прямых даны на рис. 7. Объяснеение величины n на этом рисунке будет дано ниже.
. Примеры такого рода прямых даны на рис. 7. Объяснеение величины n на этом рисунке будет дано ниже.
Рис. 7. Зависимость lnK от обратной абсолютной температуры.
Отсечка на оси ординат позволяет найти энтропию плавления (S/R), угловой коэффициент- энтальпию плавления (H/R). n - размеры кооперативной единицы плавления (объяснения в тексте).
Таким образом, из кривых плавления, полученных экспериментально, можно найти термодинамические характеристики процесса H и S. Для этого:
1. Находим отношение  (см. рис. 3) при разных температурах T, oC.
(см. рис. 3) при разных температурах T, oC.
2. Строим зависимость lnK от обратной абсолютной температуры (1/(toC+173).
3. Тангенс угла наклона прямой равен H/R. Расчитываем H.
4. Отсечка по ординате равна S/R. Расчитываем S.
Кооперативность фазовых переходов
Из кривых теплоемкости (типа приведенной на рис. 2) мы находим теплоту плавления образца Q и молярную теплоту плавления Qm=Q/m, где m - количество молей липида в образце (расчитанное как масса липида, деленная на его молекулярную массу).
Из кривых плавления (см. рис.3), мы находим энтальпию плавления H. На первый взгляд величины Qm и H должны быть примерно равны, поскольку система не совершает механической работы. Оказалось однако, что при плавлении синтетических липидов H превышает Qm в десятки, а иногда и в сотни раз.
В чем же тут дело?
Вернёмся к основному уравнению 6 на стр. 4. Его применение основано на том, что (цитируем) ".фазовое равновесие можно рассматривать как обратимую химическую реакцию:  с константой равновесия
с константой равновесия 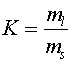
Спрашивается, какие "молекулы" l переходят в этой реакции в "молекулы" s. Очевидно, что это не отдельные молекулы фосфолипида, поскольку одна молекула не может находиться в жидкой или в твердой фазе.
Переходит из одного состояния в другое одновременно несколько молекул, образующие некий "кластер", а лучше сказать кооперативную единицу. В пределах кооперативной единицы все молекулы находятся в одинаковом состоянии, образуя либо кристаллическую (твердую) фазу либо жидкую фазу.
Каждый кластер межет изменять свое фазовое состояние по закону "все или ничего" и притом совершенно независимо от других кластеров. В этом смысле кооперативные единицы представляют собой как бы сверх-молекулы, которые могут переходить из состояния l в состояние s.
Изменение свободной энергии G, энтальпии H и энтропии S в уравнении 6 на стр.4 относится к молю таких "молекул". Довоьно очевидно, что если кооперативная единица образована n молекулами фосфолипида, то:
|
| (9) |
где n - размер кооперативной единицы, т.е. число молекул фосфолипида, входящих в одну кооперативную единицу.
Таким образом из кривых плавления непоссредственно определяются термодинамичекие характериситки в расчете на n молей фосфолипида, и чтобы получить эти характеристики в расчете на один моль надо найти сначала размер кооперативной единицы n. Что можно сделать, только если одновременно получены данные калориметрии, позволяющие определить теплоту плавления Q и расчитать молярную теплоту плавления Qm.
Разделив Qm на H, получаем n. Затем находим S, в расчете на один моль фосфолипида. В таблице 2 приведены полученные таким образом термодинамические параметры плавления синтетических фосфолипидов ( в расчете на один моль фосфолипида).
Влияние размера кооперативной единицы на форму кривых плавления
Чтобы проанализировать влияние кооперативности фазовых переходов на форму кривых плавления и калориметрических кривых, нам придется произвести некоторые расчеты. За основу возьмем данные таблицы 2. Для примера проанализируем форму кривых плавления одного из фосфолипидов, скажем, ДПЛ.
Таблица 2. Термодинамические параметры переходов гель-жидкий кристалл для 1,2-диацил-L-фосфатидилхолинов (по M.C. Phillips, 1972)
.
| Фосфолипид | Tc, oC | DH, ккал/моль | DS, кал/моль |
| ДОЛ (18:1) | -21 | 7,6 | 30,3 |
| ДМЛ (14:0) | 23 | 6,64 | 22,4 |
| ДПЛ (16:0) | 41 | 8,66 | 27,6 |
| ДСЛ (18:0) | 58 | 10,67 | Информация в лекции "Лекция 11" поможет Вам. 32,4 |
| ДБЛ (22:0) | 75 | 14,88 | 42,8 |