- Второе начало термодинамики
Второе начало термодинамики в применении к биосистемам:
Второе начало термодинамики указывает на качественное различие форм энергии. Тепловая энергия образуется в организме, является определенной формой связанной энергии, т.е. в процессе жизнедеятельности она не может не может быть полностью превращена в другие виды. Для описания связанной энергии используется понятие энтропии. 
Энтропия является функцией состояния и определяется с точностью до произвольной постоянной. Для изолированных систем энтропия не убывает, т.е. при протекании внутри системы необратимых процессов, энтропия возрастает, а при обратимом не меняется. Говорят о запасе энергии в системе, наиболее важно знать какую работу она может совершить над внешними телами, либо внутри самой системы. Для этого используется свободная энергия или энергия Гиббса. Для биосистем, процессы протекают при постоянной температуре и мало изменяющейся плотности и объеме. Т.о. для нормальных условий, свободно превращается часть внутренней энергии системы одинаковое в системе как свободной энергии, так и энергии Гиббса. Т.о. для оценки возможностей работы живого организма необходимо учитывать изменения свободной энергии или потенциал Гиббса. Существуют методы расчета изменения потенциала Гиббса для химических реакций.
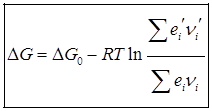
Однако для биологических систем закон возрастания энтропии не наблюдается, что послужило причиной сомнения возможности применения 2-го закона термодинамики для животных систем. Согласно формулировке этого закона, возрождения энтропии определяет направление большинства естественных процессов в природе. Однако, закон возрождения энтропии справедлив только в изолированной системе и не может быть применен к живому организму на основании того, что это открытая система. Для изолированной системе в состоянии равновесия энтропия максимальна, а все термодинамические потенциалы, в том и собственная энергия и энергия Гиббса оказывается минимальным. В открытой же системе в стационарном состоянии изменение энтропии может быть отрицательно, а значение F или G могут вообще не изменяться.
Для изолированных систем  :
: 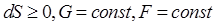
Для открытых систем: 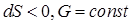
2-е начало термодинамики для открытых систем впервые было сформулировано Пригожыным.
Рекомендуемые материалы
Изменение энтропии открытых систем можно представить виде 2-х частей.
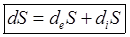
Первое слагаемое определяет изменение энтропии за счет внешних процессов. Второе слагаемое определяет изменение энтропии за счет процессов, протекающих внутри системы. 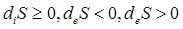
Это связано с необратимостью процессов расщепления питательных веществ, выравниванием градиентов, что всегда сопровождается увеличением энтропии. Аналогично энтропии можно разделить потенциал Гиббса.
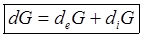
Внутренние процессы сопровождаются расходом и убыванием потенциала Гиббса, который за счет обмена с окружающей средой может как увеличиваться, так и уменьшаться. В общем случае знак и величина изменения энтропии в разные промежутки времени изменяются, поэтому удобно рассматривать скорость изменения энтропии в открытой системе.

Информация в лекции "Введение" поможет Вам.
Для поддержания жизнедеятельности необходимо непрерывное поступление в организм свободной энергии из окружающей среды для компенсации убыли свободной энергии за счет внутренних процессов. Уменьшение энтропии в животной системе в ходе потребления пищевых продуктов и солнечной энергии одновременно приводит к увеличению свободной энергии системы. Т.е. приток отрицательной энергии не связан с упорядочению живых структур. Деградация питательных веществ приводит к выделению свободной энергии необходимой организму. Поток отрицательной энтропии необходим для компенсации нарастания энтропии и убыли свободной энергии, которая происходит внутри клетки в результате самопроизвольных процессов жизнедеятельности. Т.о. открытая система представляет собой процесс круговорота и превращения свободной энергии. Если внутри открытой системы достигнуто равновесие в отношении температуры, то и процессы обмена с окружающей средой протекают равновесно. Устойчивым состоянием открытой системы является стационарное состояние. Термодинамические условия возникновения стационарного состояния является равенство между изменением энтропии внутри организма и потоком энтропии в окружающую среду. Т.е. для открытой системы условием стационарного состояния является: 
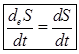
Постоянство энтропии не означает термодинамическое равновесие с окружающей средой. Равновесие организма с окружающей средой означает биологическую смерть. Для открытой системы постоянство энтропии устанавливает стационарное состояние системы и характеризует не отсутствие обратимых процессов, как в случае равновесия в изолированной среде, а взаимодействие с окружающей средой в наиболее оптимальной форме. Т.о. 2-е начало термодинамики для открытых систем помогает указать на целесообразность стационарного состояния системы. Впервые этот принцип был сформулирован Пригожыным в виде теоремы:
В стационарном состоянии производство энтропии внутри системы имеет постоянную и наименьшую из всех возможных скоростей.

Теорема указывает на то, что стационарное состояние обеспечивает наименьшие потери свободной энергии. В таком состоянии организм функционирует наиболее эффективно.





















